肥胖及非酒精性脂肪肝(NAFLD)等代谢疾病高发,现有药物疗效有限且副作用大。岩藻黄质(Fx)作为天然类胡萝卜素,具有调节脂质代谢潜力,但存在水溶性差、生物利用度低等问题;加之传统递送系统稳定性、安全性不足,同时Fx调控脂质代谢的关键靶点尚不明确,亟需开发兼具高效递送与明确作用机制的新型治疗策略。

近期,大连工业大学食品学院苏文涛教授团队创新性结合AI驱动靶点筛选与微流控超声技术,成功构建载岩藻黄素的乳酸杆菌来源细胞外囊泡口服递送系统(LCEV@Fx),系统验证了其在调控脂质代谢、缓解饮食诱导肥胖及改善肝脂肪变性方面的显著效果与作用机制。相关研究以“AI-driven target screening and microfluidic sonication-assembled oral delivery of fucoxanthin-loaded probiotic vesicles for targeted alleviation of diet-induced obesity”为题目,发表在期刊《Chemical Engineering Journal》上。
本文要点:
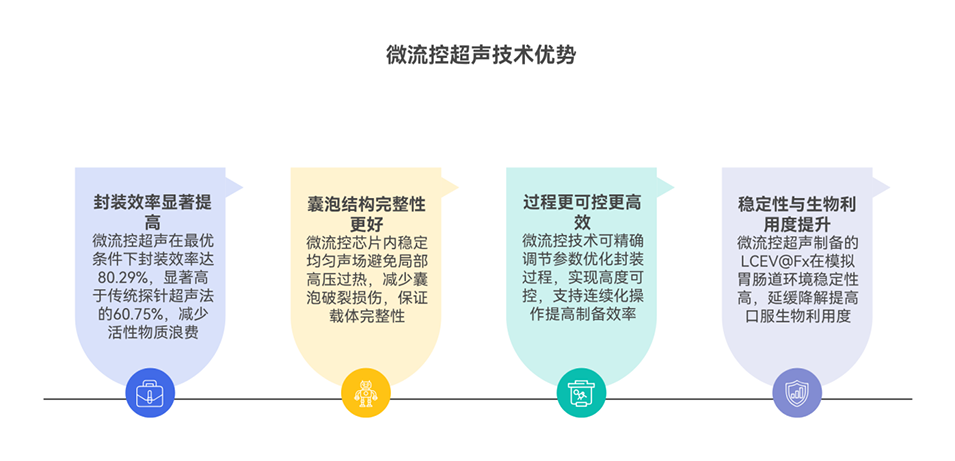
1、本研究借助微流控辅助超声技术,构建乳酸杆菌来源细胞外囊泡(LCEV)系统包封岩藻黄素(Fx),形成LCEV@Fx,并结合AI靶点筛选,从体内外评估其调控脂质代谢的作用。
2、微流控超声技术经模拟与实验验证,能产生稳定均匀的声压场,优化能量输入,减少囊泡结构损伤,提升包封效率。
3、体外实验中,由微流控超声组装的LCEV@Fx可抑制肝细胞脂质堆积、减轻氧化应激,还能抑制前脂肪细胞分化与脂质合成。
4、体内实验显示,囊泡包封延长Fx在胃肠道滞留时间,增强了整个浆膜层的吸收,并增加了肝脏蓄积。AI筛选与分子对接确认AMPKα1是Fx调控脂质代谢的关键靶点。
5、进一步实验证实,LCEV@Fx可减少高脂饮食小鼠白色脂肪堆积、改善肝脂肪变性,通过AMPK/SIRT1通路促进脂肪酸氧化,下调相关蛋白抑制脂质合成,为代谢疾病治疗提供新方向。
本文中,AI筛选出的靶点(AMPK)主要功能是解释药效机制。但更深层次的价值在于,这些靶点信息可以反向指导递送系统的设计策略,实现“机制指导设计”,而微流控技术正是实现这种精准设计的理想工具。
从“作用机制”到“设计需求”:AI不仅告诉我们Fx作用于AMPK,更揭示了其作用的具体亚型(AMPKα1)和可能的位置。这暗示了药物的作用场所在细胞内。这一机制信息对递送系统提出了明确的设计要求:LCEV@Fx必须能高效被细胞内涵体吞噬,并能有效逃逸以避免被溶酶体降解,才能将Fx足量地递送至胞浆中的靶点。
微流控的精准响应:微流控技术可以响应这一需求。例如,研究人员可以在微流控芯片中,将LCEV与特定的细胞穿膜肽(CPP)或pH敏感脂质材料在超声场下进行共组装。微流控精确控制的条件可以确保这些功能性分子以最佳的取向和密度镶嵌在囊泡膜上,从而精准赋予LCEV@Fx增强的细胞摄取或内涵体逃逸能力。
总之,AI的价值远不止于发现靶点后解释现象。它输出的生物学机制知识应成为指导递送系统“按需设计”的蓝图。而微流控作为先进的制备平台,能够将这种基于机制的设计蓝图转化为现实,制备出新一代的“智能”载体。这标志着研究从“经验驱动”迈向“机制驱动”的设计新时代。
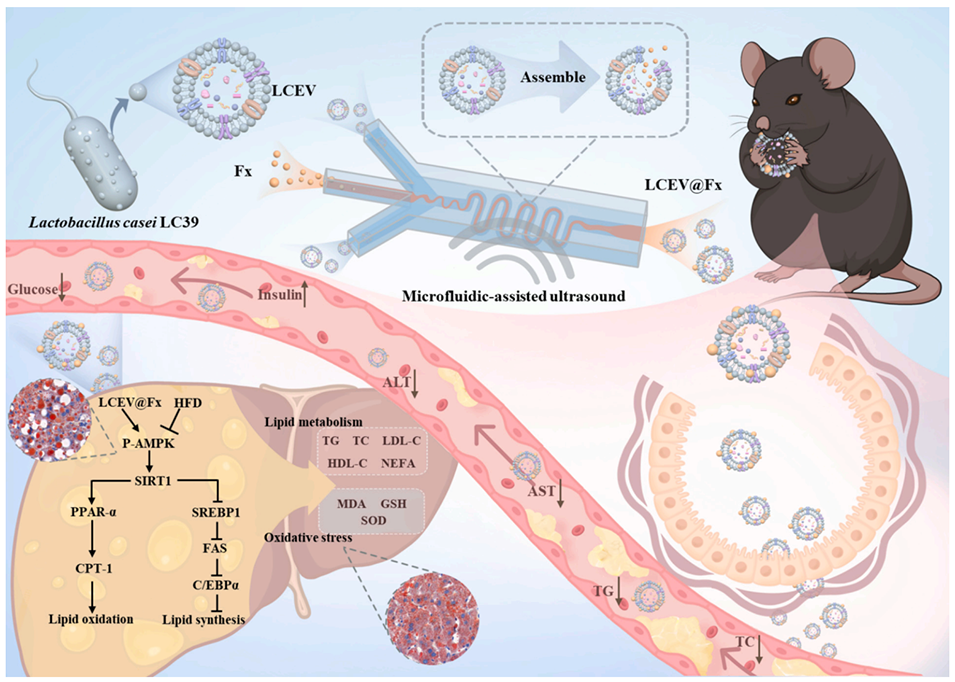
图1. 基于益生菌来源胞外囊泡(PDEVs)与微流控芯片辅助超声技术的口服递送系统,用于高效负载与递送岩藻黄素(Fx)以提升其生物利用度。LCEV@Fx 经肠道吸收后进入血液循环并在肝脏蓄积,通过抑制脂质合成、促进脂质氧化调控脂质代谢,进而纠正高脂饮食(HFD)诱导的脂质代谢紊乱,有效缓解相关代谢疾病。
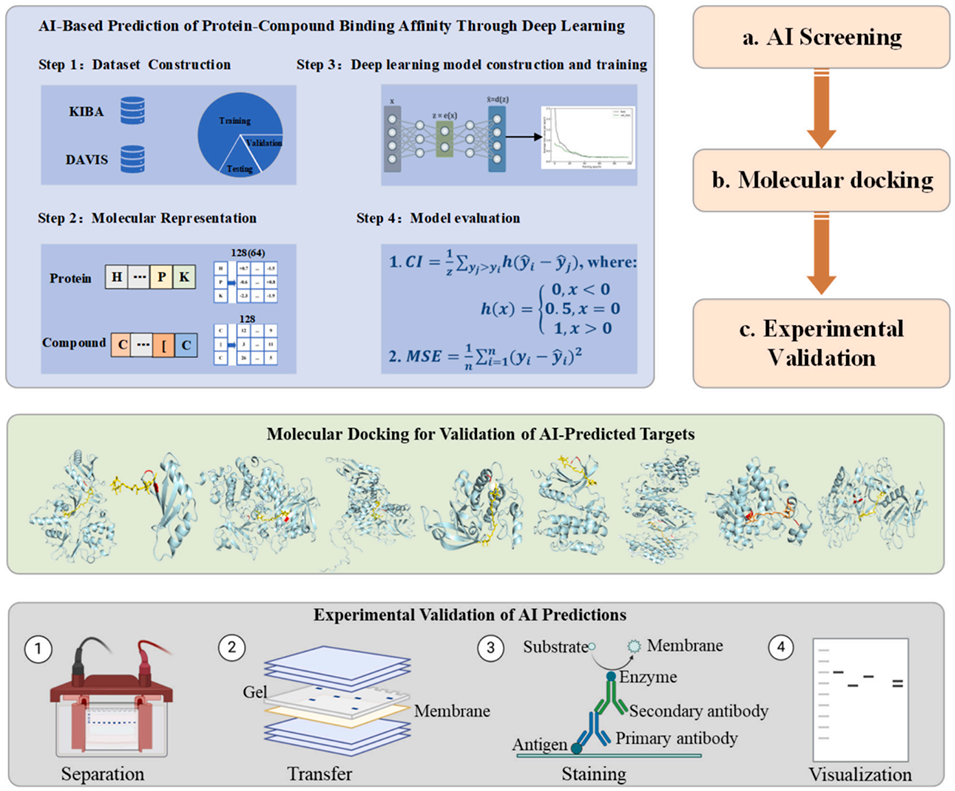
图2. 基于人工智能(AI)的蛋白质-配体结合亲和力预测流程。该流程包括构建 KIBA 与 DAVIS 数据集、对蛋白质(以 FASTA 格式)和小分子(以 SMILES 格式)进行分子表征、训练深度学习模型以预测结合亲和力,模型评估采用均方误差(MSE)与一致性指数(CI)。通过 AI 筛选确定高潜力靶点后,进行分子对接模拟以评估结合模式与结合能,最后对结果进行实验验证。
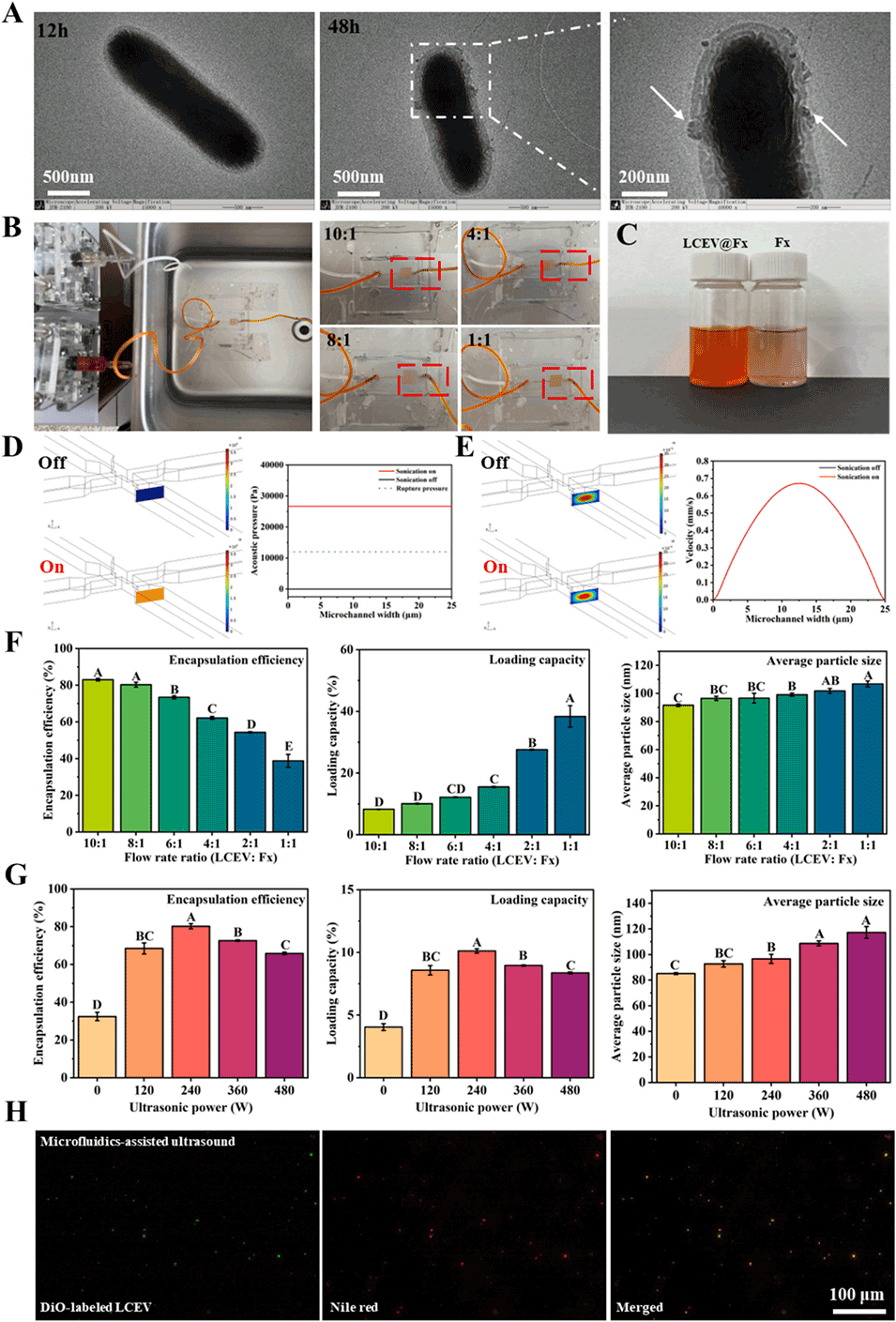
图3. 微流控超声组装载岩藻黄素(Fx)乳酸杆菌来源胞外囊泡(LCEV@Fx)的参数优化与表征。(A)干酪乳杆菌 LC39 培养 12 小时和 48 小时的透射电子显微镜(TEM)图像及局部放大图;(B)微流控芯片辅助超声的操作装置及不同流速比下的内部运行情况;(C)载 Fx 的 LCEV 与游离 Fx 的外观对比;(D)微通道内有无超声时的声压分布模拟;(E)微通道内流体速度场变化模拟;(F)不同流速比对包封率、负载量及平均粒径的影响;(G)不同超声功率对包封率、负载量及平均粒径的影响;(H)荧光素(DIO)标记的 LCEV 与尼罗红(替代 Fx)的共定位图像。不同字母表示差异显著(p<0.05)。
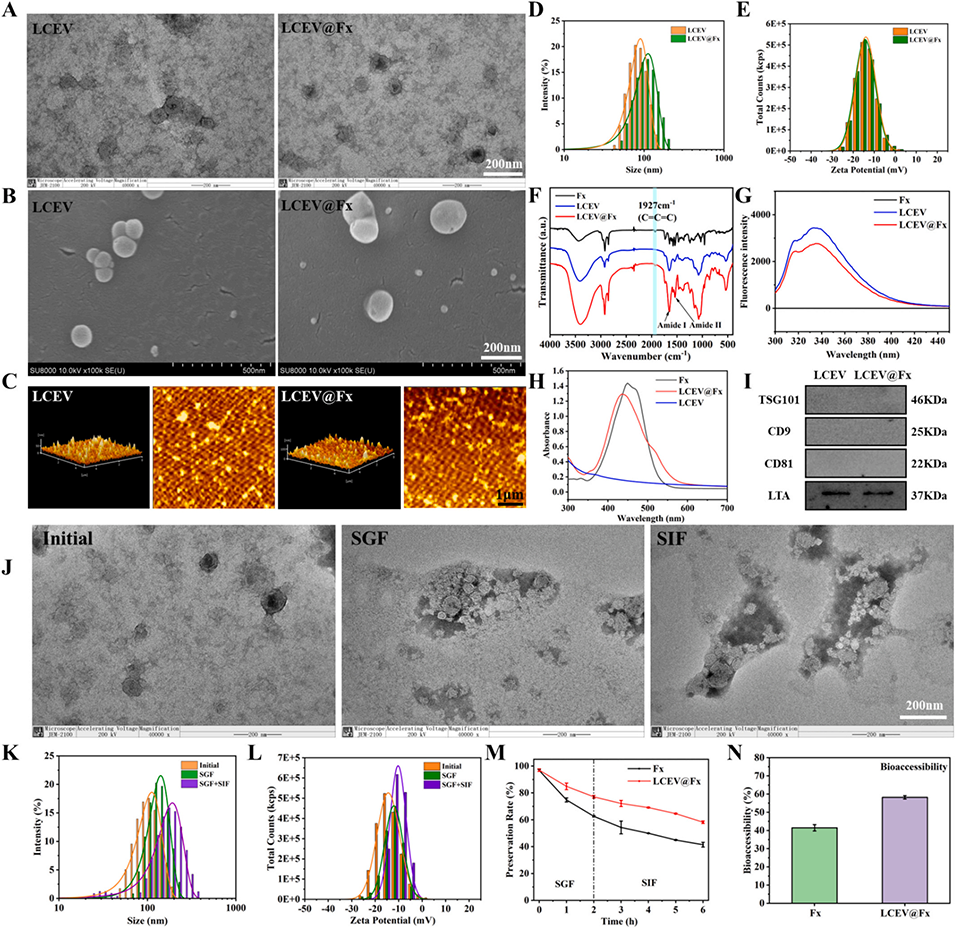
图4. LCEV@Fx 的表征与稳定性分析。(A)LCEV 负载 Fx 前后的透射电子显微镜(TEM)图像;(B)冷冻场发射扫描电子显微镜(Cryo-SEM)图像;(C)原子力显微镜(AFM)图像;(D)粒径分布;(E)zeta 电位分布;(F)傅里叶变换红外光谱(FTIR);(G)荧光光谱;(H)紫外-可见吸收光谱(UV-Vis);(I)蛋白质印迹分析(Western blot)。(J)模拟消化过程中 LCEV@Fx 的 TEM 图像;(K)模拟消化过程中 LCEV@Fx 的粒径分布;(L)模拟消化过程中 LCEV@Fx 的 zeta 电位分布;(M)模拟消化不同时间点 LCEV@Fx 与游离 Fx 的保留率;(N)LCEV@Fx 模拟消化前后的生物可及性。
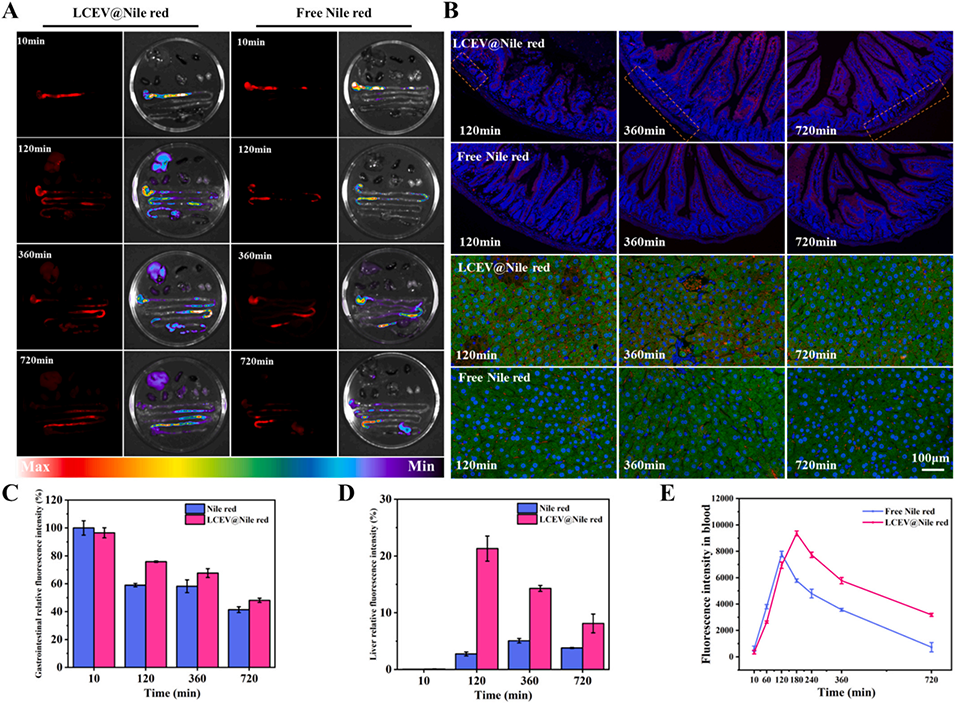
图5. LCEV@尼罗红与游离尼罗红在小鼠体内的生物分布与代谢。(A)不同时间点 LCEV@尼罗红与游离尼罗红在小鼠主要器官中的分布;(B)小鼠口服 LCEV@尼罗红或游离尼罗红后,肠道与肝脏组织的共聚焦显微镜图像;(C)不同时间点小鼠胃肠道内的荧光强度分析;(D)不同时间点小鼠肝脏内的荧光强度分析;(E)不同时间点小鼠血液中的荧光强度分析。
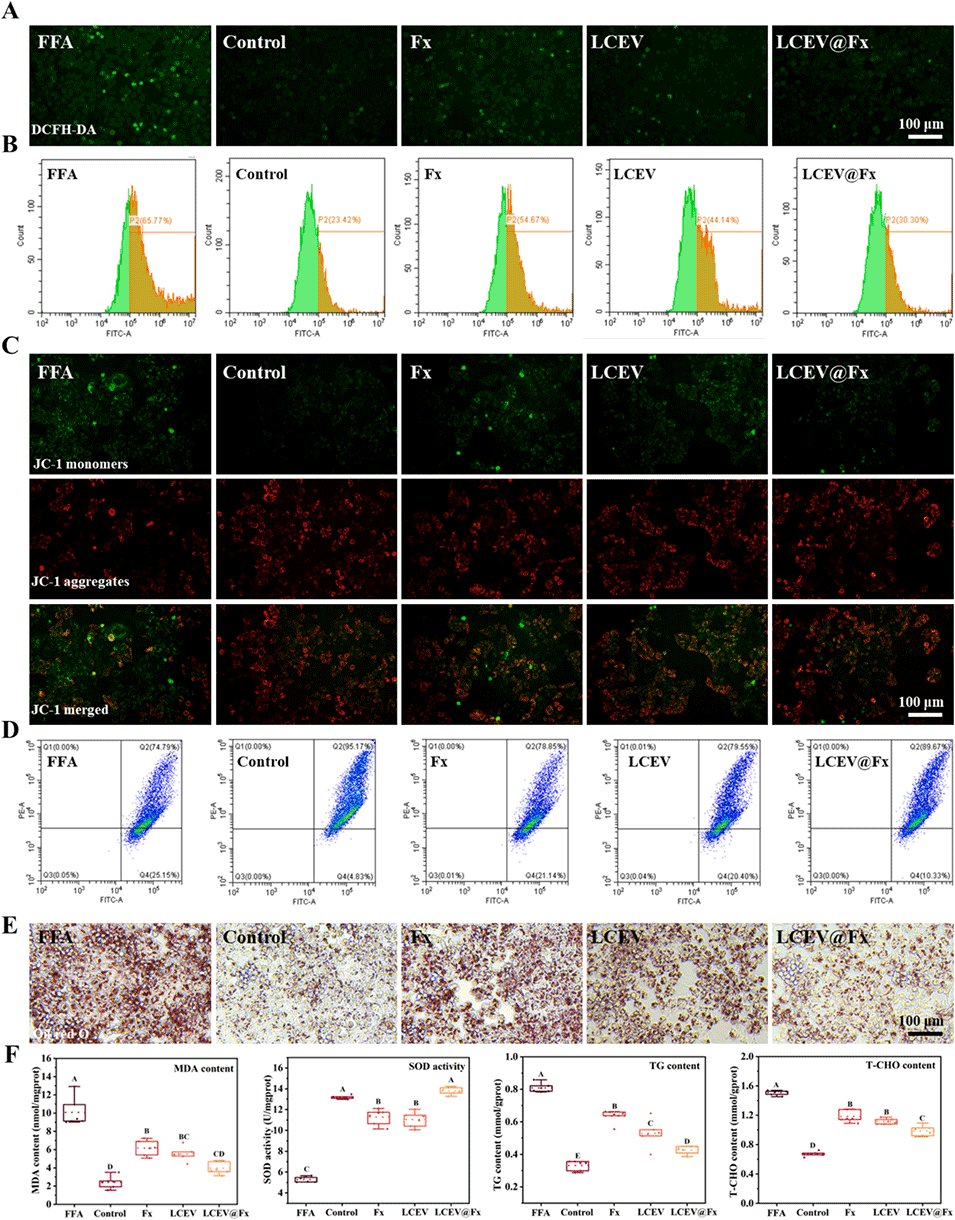
图6. LCEV@Fx 对游离脂肪酸(FFA)诱导的 HepG2 细胞氧化应激与脂质堆积的调控作用。(A)2,7-二氯荧光素二乙酸酯(DCFH-DA)染色检测细胞内活性氧(ROS)水平的代表性图像;(B)流式细胞术定量分析细胞内 ROS 变化;(C)JC-1 染色评估线粒体膜电位变化(区分单体与聚集体荧光信号);(D)流式细胞术定量分析线粒体膜电位变化;(E)油红 O 染色评估细胞内脂质堆积;(F)丙二醛(MDA)含量、超氧化物歧化酶(SOD)活性、甘油三酯(TG)及总胆固醇(T-CHO)水平的定量分析。不同字母表示差异显著(p<0.05)。
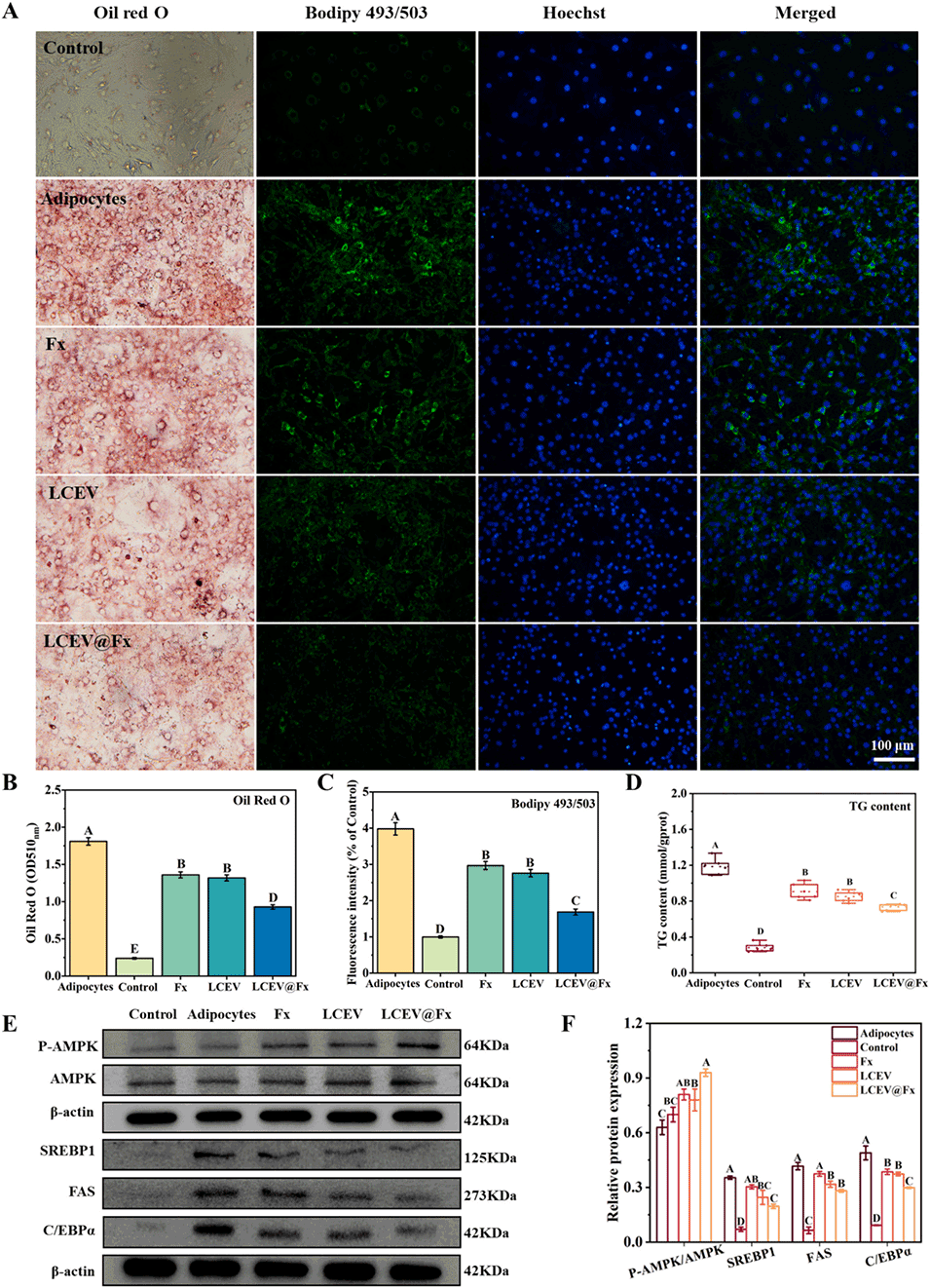
图7. LCEV@Fx 对 3T3-L1 前脂肪细胞分化过程中脂质堆积与成脂的影响。(A)油红 O 与 Bodipy 493/503 染色显示不同处理组脂质堆积的代表性图像;(B)油红 O 染色后通过光密度(OD)值定量分析脂质堆积;(C)Bodipy 493/503 荧光强度定量分析;(D)不同处理组甘油三酯(TG)含量分析;(E)蛋白质印迹分析(Western blot)检测磷酸化腺苷酸活化蛋白激酶(p-AMPK)/AMPK、固醇调节元件结合蛋白 1(SREBP1)、脂肪酸合成酶(FAS)及 CCAAT 增强子结合蛋白 α(C/EBPα)的蛋白表达水平;(F)蛋白表达水平的定量分析。不同字母表示差异显著(p<0.05)。
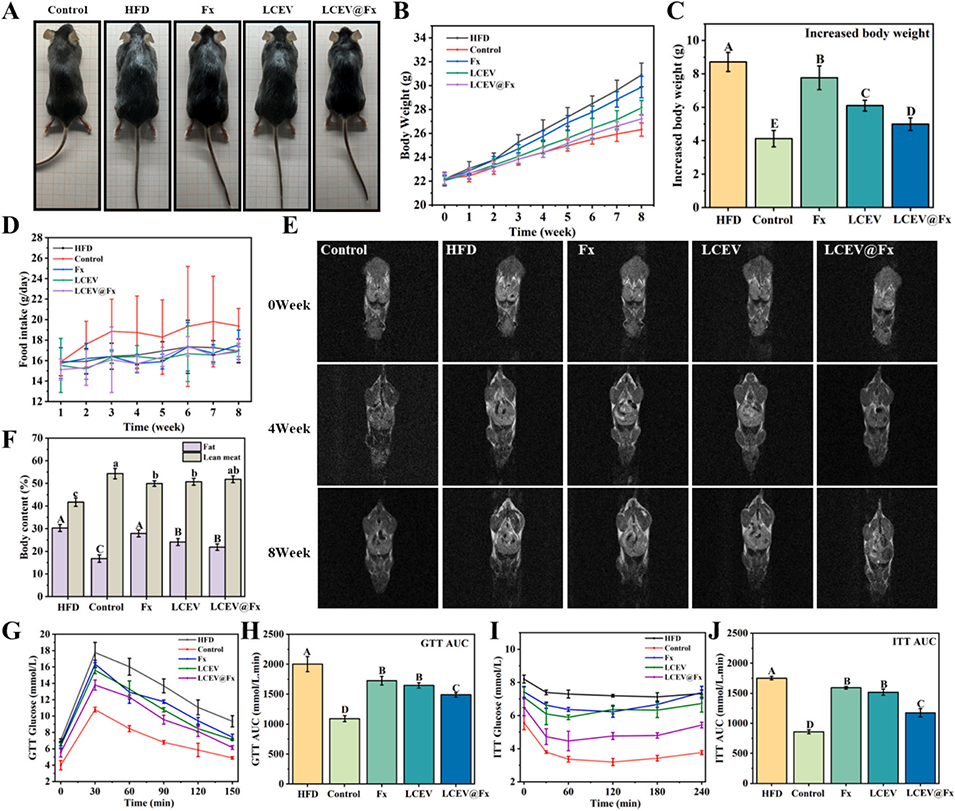
图8. LCEV@Fx 对高脂饮食(HFD)喂养小鼠体重、体脂含量及代谢的影响。(A)小鼠代表性外观图像;(B)体重变化;(C)体重增量;(D)食物摄入量;(E)磁共振成像(MRI)图像;(F)体脂与瘦体重比值分析;(G)葡萄糖耐量试验(GTT)过程中的血糖变化;(H)GTT 曲线下面积;(I)胰岛素耐量试验(ITT)过程中的胰岛素敏感性;(J)ITT 曲线下面积(8 周实验期间不同处理组小鼠数据)。不同字母表示差异显著(p<0.05)。
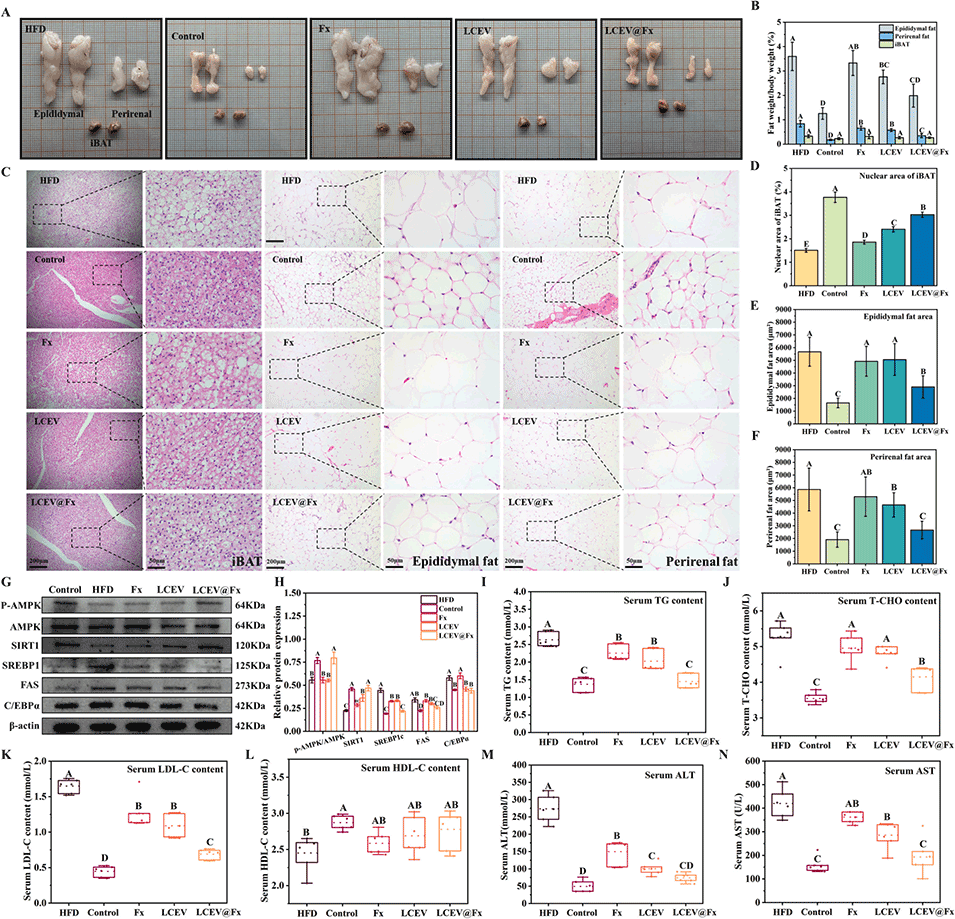
图9. LCEV@Fx 对高脂饮食(HFD)喂养小鼠脂肪组织及血清脂质代谢指标的影响。(A)不同处理组小鼠脂肪组织(附睾脂肪、肾周脂肪、棕色脂肪组织)的代表性图像;(B)不同脂肪组织重量占体重的百分比;(C)脂肪组织的苏木精-伊红(H&E)染色代表性图像;(D)肩胛间棕色脂肪组织(iBAT)中细胞核面积占比的定量分析;(E)肾周脂肪面积定量分析;(F)附睾脂肪面积定量分析。(G)蛋白质印迹分析(Western blot)检测脂质代谢相关通路蛋白(p-AMPK/AMPK、沉默信息调节因子 1(SIRT1)、SREBP1、FAS、C/EBPα)的表达水平;(H)蛋白表达水平的相对定量分析。(I)小鼠血清甘油三酯(TG)水平;(J)血清总胆固醇(T-CHO)水平;(K)血清低密度脂蛋白胆固醇(LDL-C)水平;(L)血清高密度脂蛋白胆固醇(HDL-C)水平;(M)血清天冬氨酸转氨酶(AST)水平;(N)血清丙氨酸转氨酶(ALT)水平。不同字母表示差异显著(p<0.05)。
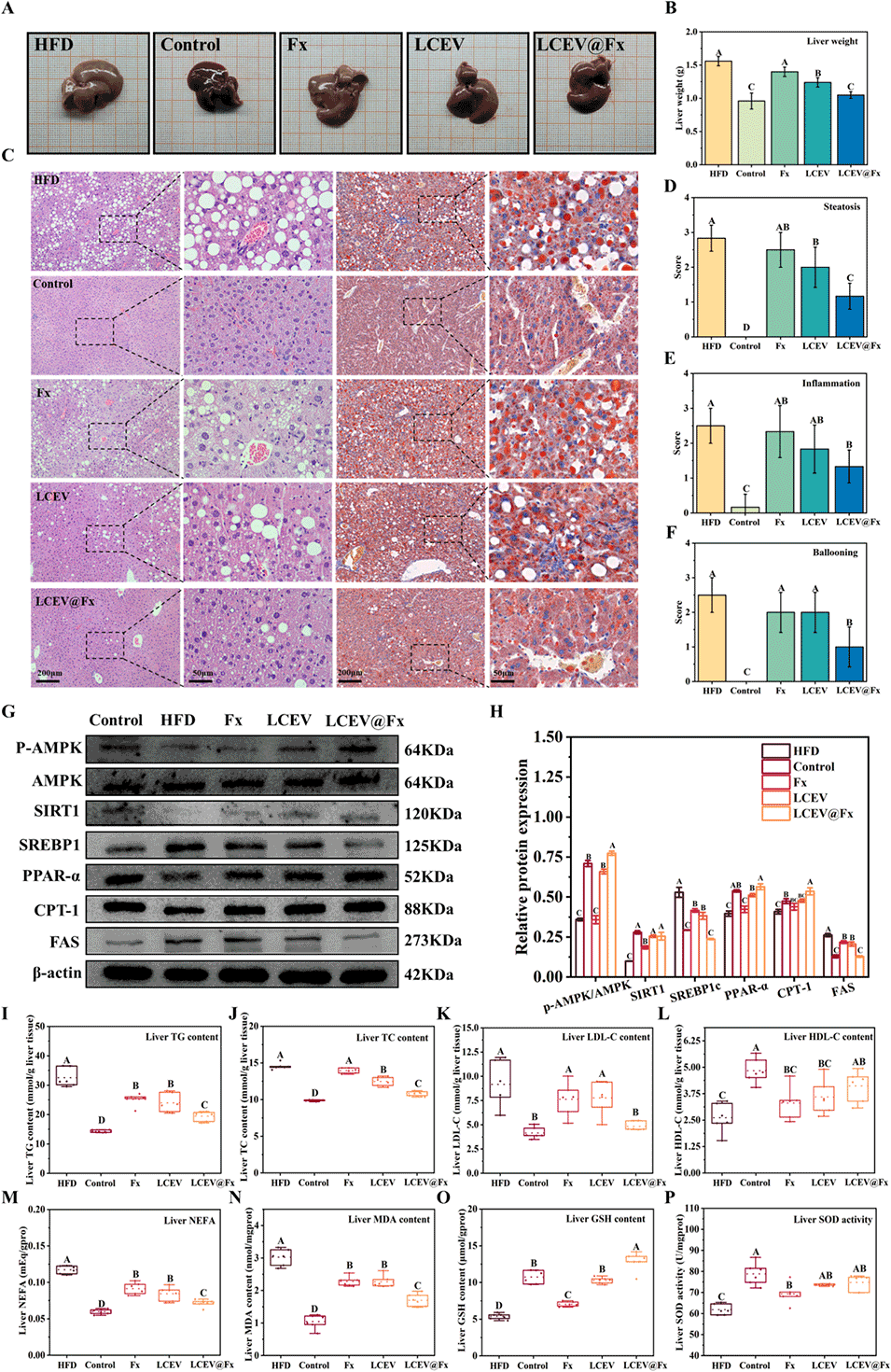
图10. LCEV@Fx 对高脂饮食(HFD)喂养小鼠肝脏脂质代谢与氧化应激的影响。(A)不同处理组小鼠肝脏外观代表性图像;(B)肝脏重量;(C)肝脏苏木精-伊红(H&E)染色与油红 O 染色代表性图像;(D)肝脏脂肪变性评分;(E)肝脏炎症评分;(F)肝脏气球样变评分。(G)蛋白质印迹分析(Western blot)检测 p-AMPK/AMPK、SIRT1、固醇调节元件结合蛋白 1c(SREBP1c)、过氧化物酶体增殖物激活受体 α(PPAR-α)、肉碱棕榈酰转移酶 1(CPT-1)及 FAS 的蛋白表达水平;(H)蛋白表达水平的相对定量分析。(I)肝脏甘油三酯(TG)水平;(J)肝脏总胆固醇(T-CHO)水平;(K)肝脏低密度脂蛋白胆固醇(LDL-C)水平;(L)肝脏高密度脂蛋白胆固醇(HDL-C)水平;(M)肝脏非酯化脂肪酸(NEFA)水平;(N)肝脏丙二醛(MDA)水平;(O)肝脏还原型谷胱甘肽(GSH)水平;(P)肝脏超氧化物歧化酶(SOD)活性。不同字母表示差异显著(p<0.05)。
论文链接:https://doi.org/10.1016/j.cej.2025.164598
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














