
导读:
近期,江苏省农业科学院农产品加工研究所李莹、冯进、黄午阳等人通过将负载姜黄素(Cur)的透明质酸(HA)修饰纳米脂质载体(HA-NLC)包埋于果胶钙基质中,成功构建了具有序列靶向能力的分层微球(HA-NLC@MPs)。该递送系统借助果胶基质保护载体在上消化道的完整性,并通过结肠微生物的特异性降解实现靶向释放;释放出的HA-NLC则凭借其表面的HA靶向结合炎症结肠过度表达的CD44受体,从而协同促进姜黄素在病灶部位的积累与吸收,显著增强了其对结肠炎的改善效果。相关研究以“Advanced targeted curcumin delivery using biodegradable hierarchical microspheres with calcium pectinate matrix and hyaluronic acid moieties for enhancing colitis amelioration”为题目,发表在期刊《Carbohydrate Polymers》上。
本文要点:
1、本研究构建了一种具有序列靶向能力的分层结构姜黄素载体(HA-NLC@MPs),用于增强结肠炎治疗效果。
2、首先,以卵清蛋白-透明质酸偶联物为乳化剂,制备了载姜黄素的透明质酸修饰纳米结构脂质载体(HA-NLC)。随后,通过电喷雾将HA-NLC固定在果胶钙基质中,形成约140μm的超分子微球(HA-NLC@MPs)。
3、研究表明,果胶基质能保护载体完整性,防止姜黄素在上消化道泄漏,并在结肠细菌作用下选择性降解。释放的HA-NLC上暴露的透明质酸可通过分化簇44受体介导的内吞作用,促进姜黄素被发炎的结肠上皮细胞跨细胞吸收。
4、体外和体内研究显示,以HA-NLC@MPs为载体时,姜黄素在结肠炎小鼠的结直肠组织中大量积累,通过调节巨噬细胞极化、TLR4/MyD88/NF-κB信号级联以及肠道菌群稳态,其缓解结肠炎的效果显著优于纳米载体。
在本研究中,电喷雾技术调控HA-NLC@MPs微球特性(尺寸、结构及稳定性等)的具体原理如下:
1、参数协同调控尺寸均一性:通过控制电喷雾的流速(15mL/h)、电压(11kV)和接收距离(3.0cm),使HA-NLC与果胶混合液在电场力作用下形成均匀液滴。流速决定单位时间喷出的液体量,电压影响液滴分裂程度,接收距离则关联液滴飞行过程中的固化速率,三者协同作用使微球体积平均直径(D4,3)稳定在约145.30±13.58μm,确保尺寸均一性。
2、材料交联构建稳定结构:电喷雾过程中,含HA-NLC的果胶溶液被喷入0.3% CaCl2接收液,果胶分子的羧基与Ca2+发生交联,形成具有“蛋盒”结构的凝胶网络,将HA-NLC包裹其中。这种结构使微球能抵抗胃和小肠的消化环境,同时为后续在结肠的靶向降解奠定基础。
3、保留载体功能性:电喷雾全程室温操作,且未使用有机溶剂,避免了高温导致的Cur降解或脂质氧化,同时保障了HA的生物活性,确保微球在结肠降解后,释放的HA-NLC能通过CD44受体介导的内吞作用被发炎的结肠上皮细胞吸收,提高姜黄素的靶向递送效率。
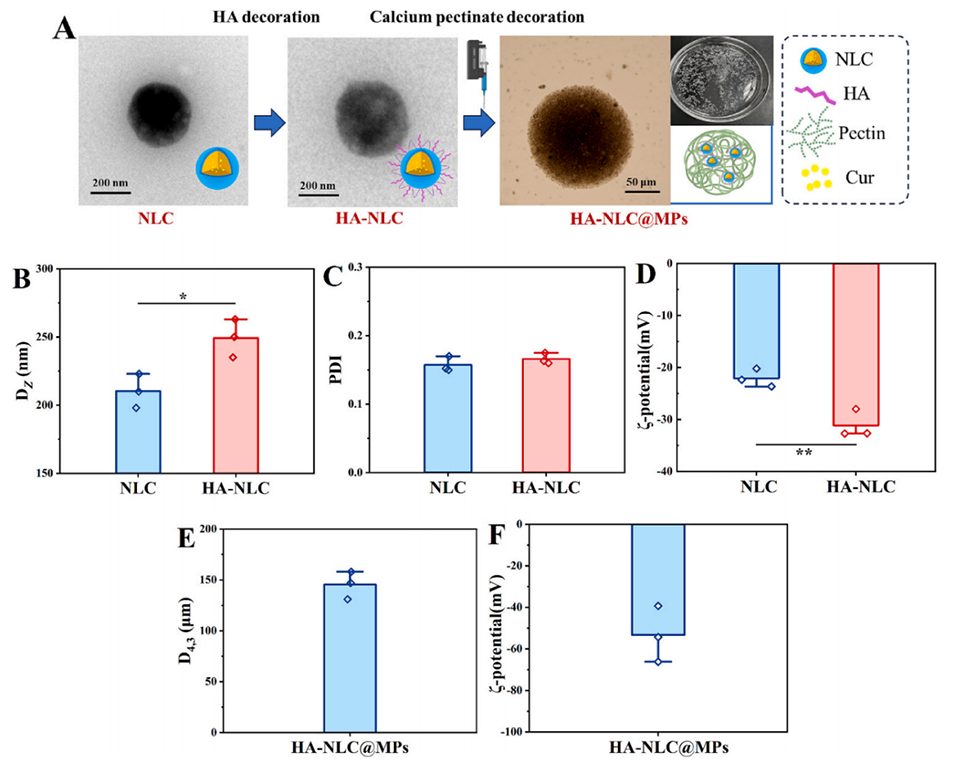
图 1. 三种姜黄素递送系统的微观结构。(A) 透射电镜图像。(B) NLC 和 HA-NLC 的流体力学直径(DZ)、(C) 多分散指数(PDI)及 (D) ζ 电位。(E) HA-NLC@MPs 的体积平均直径(D4,3)及 (F) ζ 电位。* 和 ** 分别表示 p<0.05 和 p<0.01。
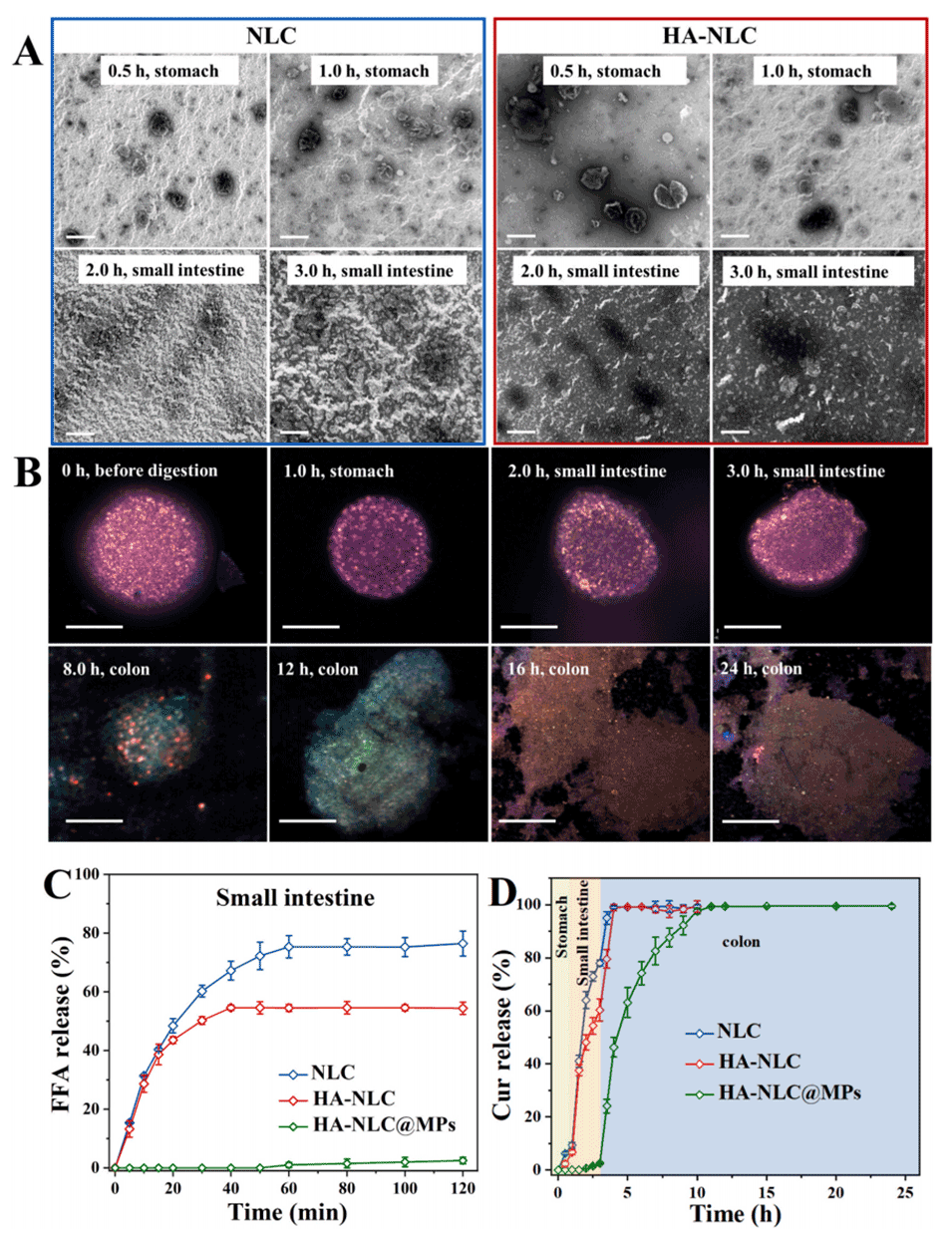
图 2. NLC、HA-NLC 和 HA-NLC@MPs 的体外消化行为。(A) 透射电镜观察 NLC 和 HA-NLC 在胃和小肠阶段的微观结构演变。(B) 激光共聚焦显微镜观察 HA-NLC@MPs 在胃、小肠和结肠阶段的微观结构演变。(C) 载体在小肠阶段的游离脂肪酸(FFAs)释放曲线。(D) 姜黄素在胃、小肠和结肠阶段的累积释放曲线。A 图比例尺:200 nm。B 图比例尺:100 μm。
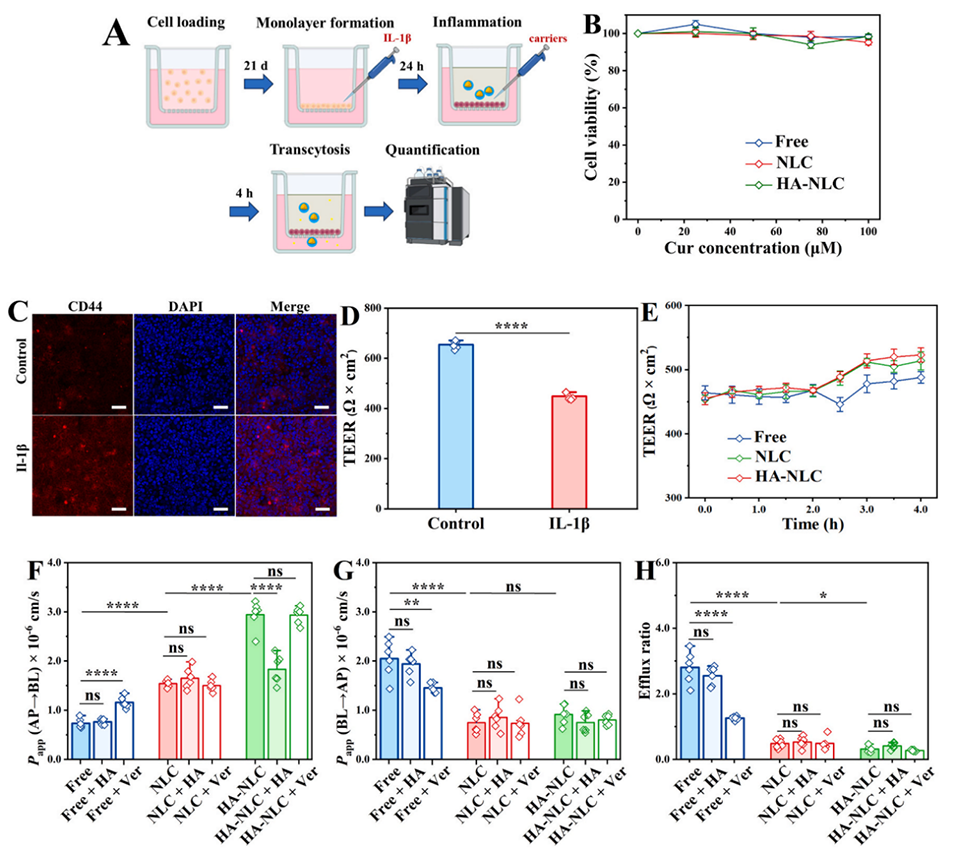
图 3. 姜黄素载体在发炎的 Caco-2/HT29-MTX(E12)单层细胞中的跨细胞转运效率。(A) 姜黄素渗透实验的示意图。(B) 不同形式姜黄素的细胞毒性。(C) 正常和发炎单层细胞中 CD44 的表达及 (D) 跨上皮电阻(TEER)值。(E) 单层细胞渗透实验过程中的 TEER 值变化。(F) 表观渗透系数(Papp,A→B)、(G) 表观渗透系数(Papp,B→A)及 (H) 不同姜黄素制剂在透明质酸(HA)或维拉帕米(Ver)存在下的外排率。*、**、**和***分别表示 p<0.05、p<0.01、p<0.001 和 p<0.0001。ns:无显著性差异。C 图比例尺:100 μm。
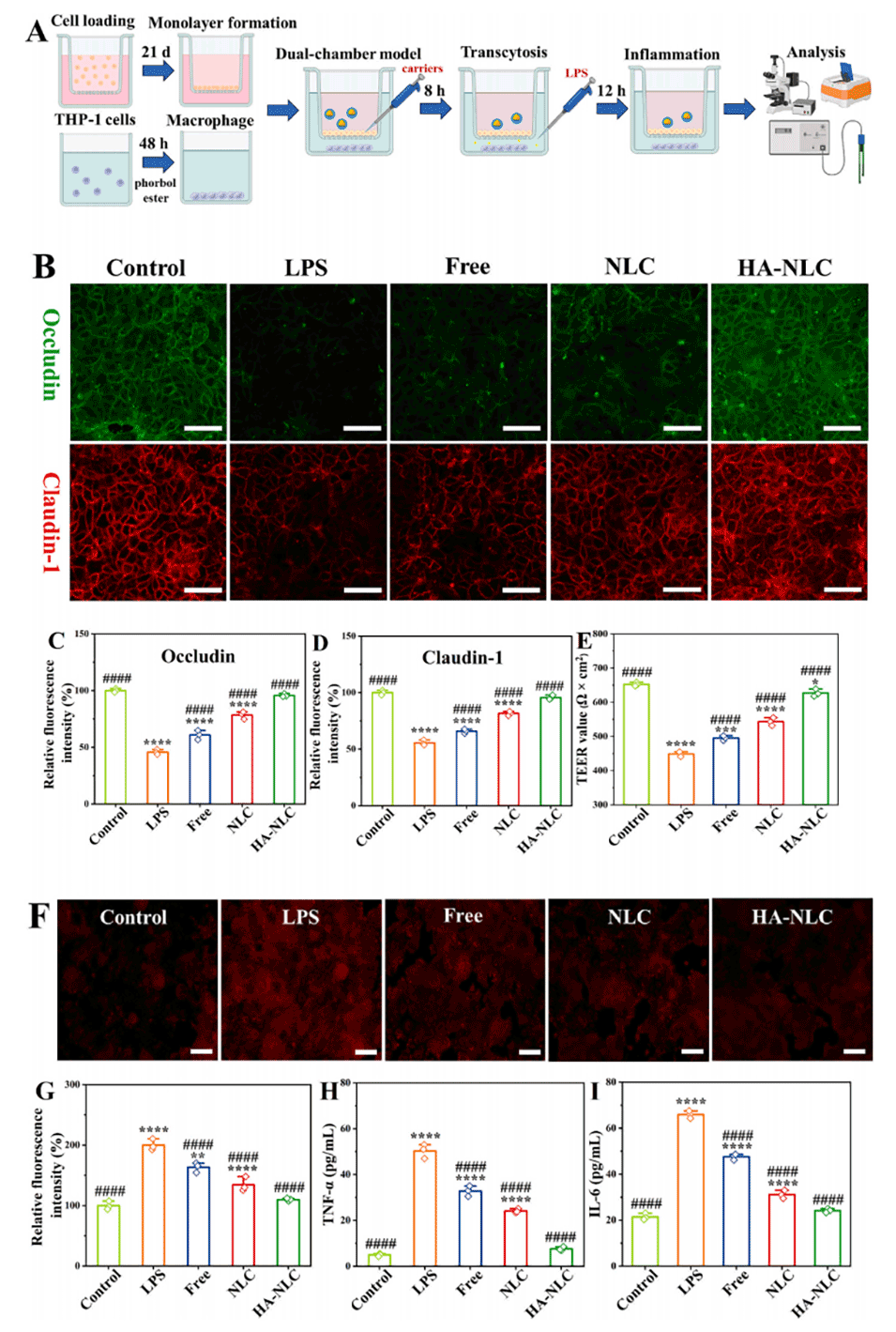
图 4. 体外抗炎效果分析。(A) 双室细胞模型用于抗炎测试的示意图。(B) 上皮紧密连接蛋白的免疫荧光图像。(C) 闭合蛋白(occludin)和 (D) Claudin-1 的荧光密度。(E) TEER 值。(F) 经 CellROX™ Deep Red 处理的巨噬细胞的荧光图像及 (G) 荧光密度。(H) 肿瘤坏死因子 -α(TNF-α)和 (I) 白细胞介素 - 6(IL-6)的促炎细胞因子水平。*、**、**和***分别表示与对照组相比 p<0.05、p<0.01、p<0.001 和 p<0.0001;#、##、### 和 #### 分别表示与脂多糖(LPS)组相比 p<0.05、p<0.01、p<0.001 和 p<0.0001。B 图和 F 图比例尺:100 μm。
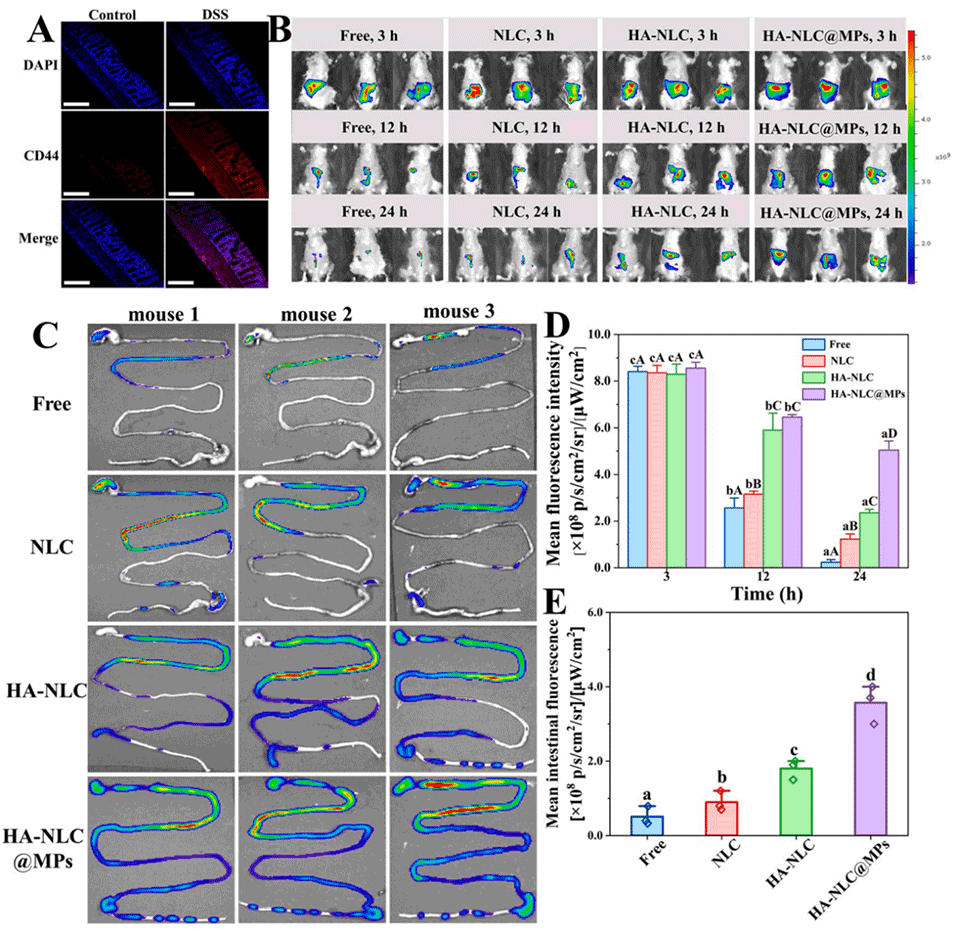
图 5. IR780 探针在不同载体中的体内生物分布。(A) 对照组和葡聚糖硫酸钠(DSS)组结肠组织中抗 CD44 抗体的免疫荧光染色。(B) 溃疡性结肠炎(UC)小鼠在口服不同制剂后 3、12 和 24 小时的荧光图像,以及 (D) 相应的半定量分析结果。(C) 口服后 24 小时胃肠道(GIT)的荧光图像,以及 (E) 相应的半定量分析结果。D 中不同小写字母表示同一载体在不同时间点存在显著差异(p<0.05);不同大写字母表示同一时间点不同载体间存在显著差异(p<0.05)。E 中不同小写字母表示存在显著差异(p<0.05)。A 图比例尺:200 μm。
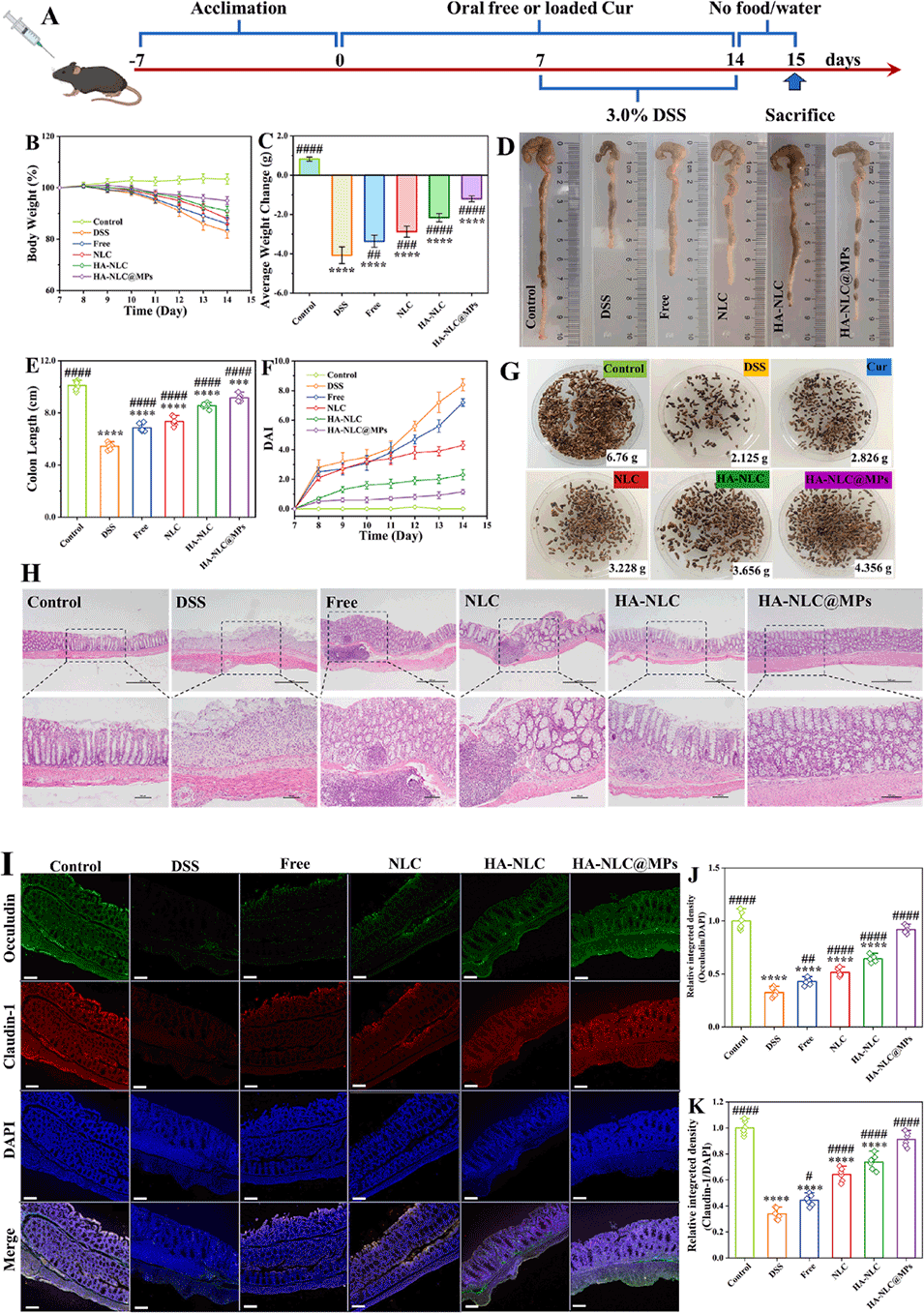
图 6. 姜黄素载体对 DSS 诱导的结肠炎的治疗效果。(A) 不同姜黄素制剂对 DSS 诱导的小鼠溃疡性结肠炎进行体内营养干预的示意图。(B) 体重、(C) 平均体重变化、(D) 结肠的光学照片、(E) 结肠长度、(F) 疾病活动指数(DAI)、(G) 粪便的光学照片及 (H) 结肠切片的苏木精 - 伊红(H&E)染色。(I) 结肠组织中紧密连接蛋白的代表性免疫荧光染色,以及 (J) 闭合蛋白和 (K) Claudin-1 通过 Image-J 软件得到的相对积分密度。H 图比例尺:500 μm(上图)、100 μm(下图)。I 图比例尺:100 μm。
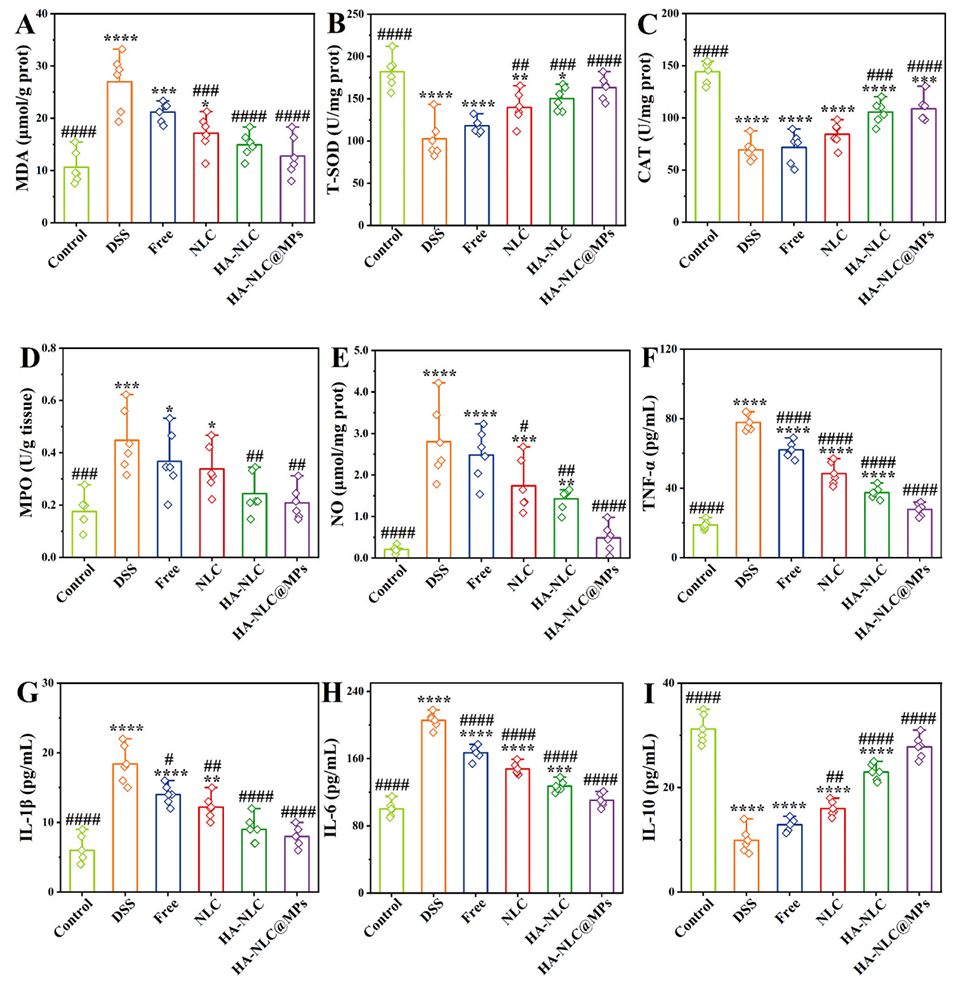
图 7. 口服姜黄素载体对 DSS 诱导的结肠炎小鼠氧化应激和炎症细胞因子水平的影响。(A) 丙二醛(MDA)水平、(B) 总超氧化物歧化酶(T-SOD)活性、(C) 过氧化氢酶(CAT)活性、(D) 髓过氧化物酶(MPO)活性、(E) 一氧化氮(NO)水平,血清中 (F) TNF-α、(G) IL-6、(H) 白细胞介素 - 1β(IL-1β)等促炎细胞因子水平及 (I) 白细胞介素 - 10(IL-10)等抗炎细胞因子水平。*、**、**和***分别表示与对照组相比 p<0.05、p<0.01、p<0.001 和 p<0.0001;#、##、### 和 #### 分别表示与 DSS 组相比 p<0.05、p<0.01、p<0.001 和 p<0.0001。
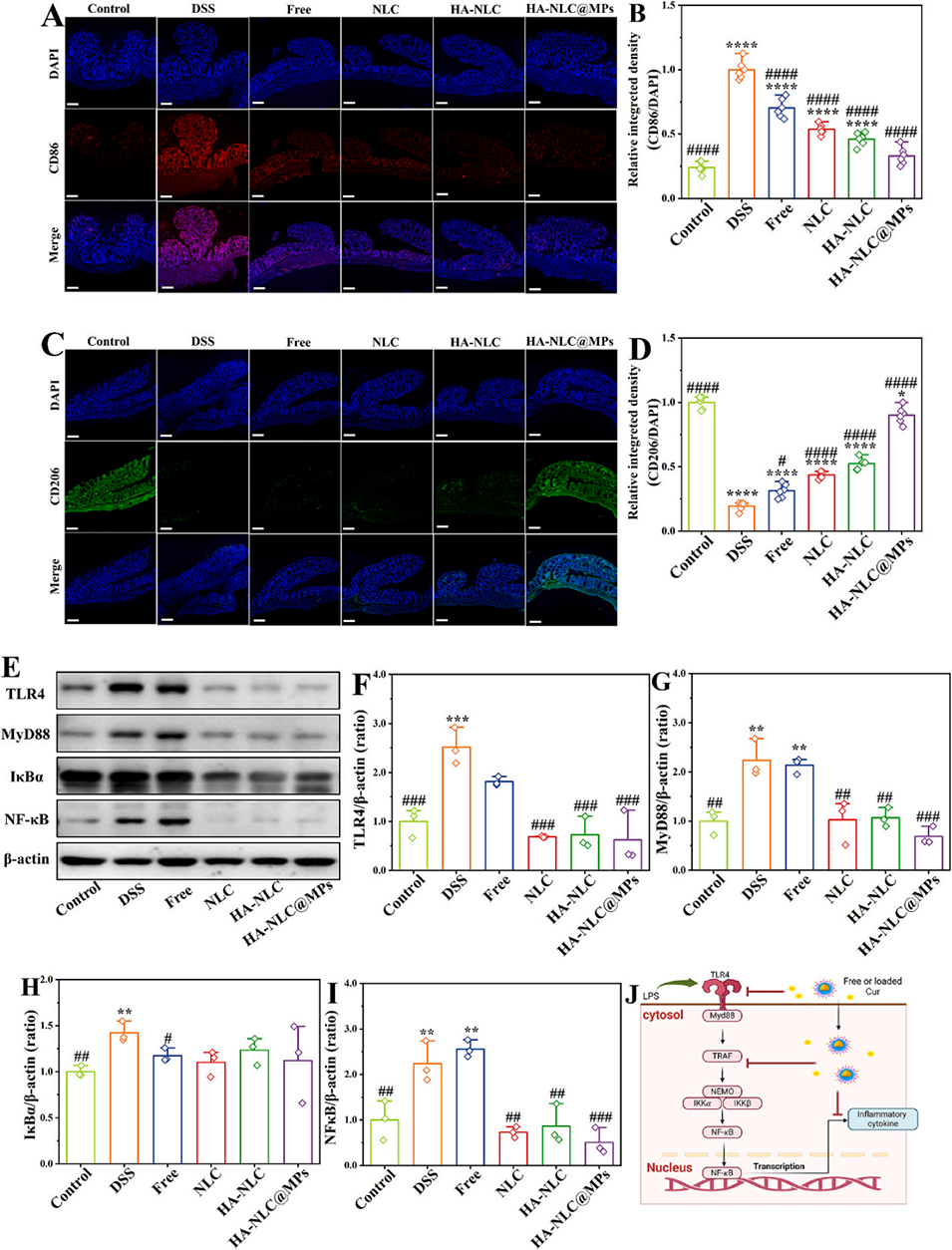
图 8. 不同姜黄素制剂对巨噬细胞极化及 TLR4/MyD88/NF-κB 信号通路的调节作用。(A) CD86 和 (C) CD206 的免疫荧光染色及 (B、D) 不同组中相应的半定量分析结果。(E) TLR4/MyD88/NF-κB 信号级联的蛋白质印迹分析及 (F-I) 蛋白质表达水平的定量分析。(J) 姜黄素通过该通路干预炎症细胞因子产生的潜在机制示意图。*、**、**和***分别表示与对照组相比 p<0.05、p<0.01、p<0.001 和 p<0.0001;#、##、### 和 #### 分别表示与 DSS 组相比 p<0.05、p<0.01、p<0.001 和 p<0.0001。A 图和 C 图比例尺:100 μm。
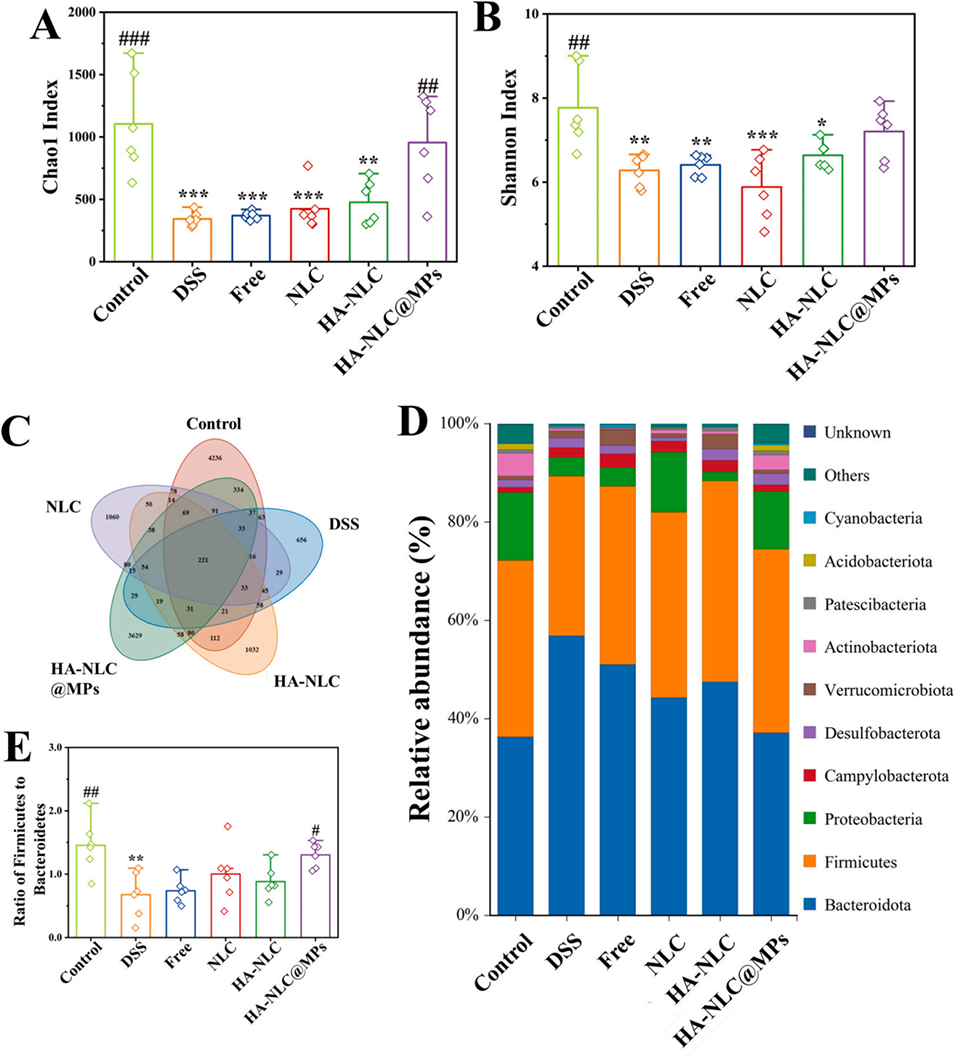
图 9. (A) 肠道菌群 Chao1 指数和 (B) 操作分类单元(OTU)水平分析的 Shannon 指数。(C) OTU 水平上共有和特有细菌的维恩图。(D) 门水平的肠道菌群组成及 (E) 厚壁菌门与拟杆菌门的比值。
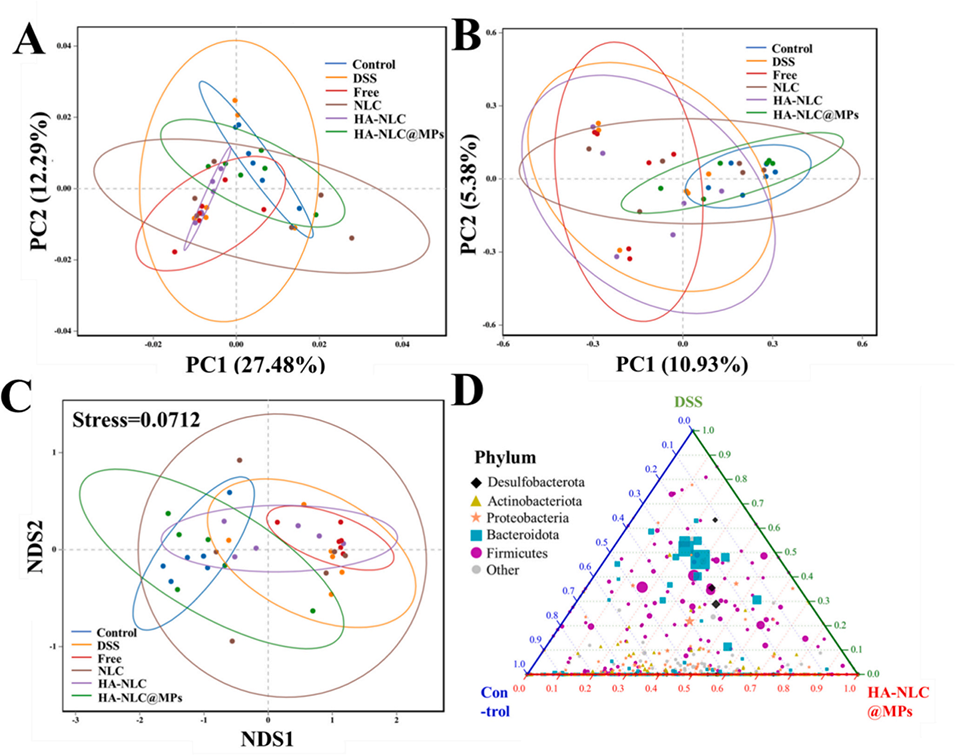
图 10. (A) 主成分分析(PCA)、(B) 主坐标分析(PCoA)及 (C) 非度量多维尺度分析(NMDS)的肠道菌群结果。(D) 对照组、DSS 组和 HA-NLC@MPs 组门水平核心菌群组成的三元分析。
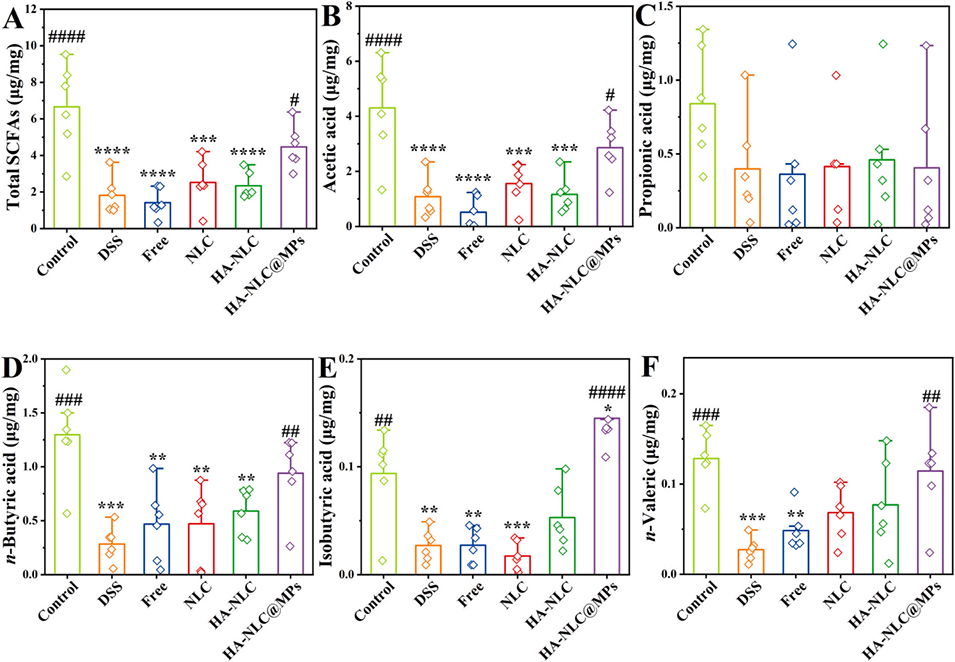
图 11. HA-NLC@MPs 中的姜黄素对盲肠中短链脂肪酸(SCFAs)的富集作用。(A) 总短链脂肪酸、(B) 乙酸、(C) 丙酸、(D) 正丁酸、(E) 异丁酸及 (F) 正戊酸水平。*、**、**和***分别表示与对照组相比 p<0.05、p<0.01、p<0.001 和 p<0.0001;#、##、### 和 #### 分别表示与 DSS 组相比 p<0.05、p<0.01、p<0.001 和 p<0.0001。
论文链接:https://doi.org/10.1016/j.carbpol.2025.123273
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














