
导读:
溃疡性结肠炎(UC)表现为结肠微环境中过度氧化应激和免疫失调。针对这些病理特征,华侨大学傅超萍副教授团队开发了一种微流控技术制备的口服递送系统,该系统由甲基丙烯酸酯化透明质酸水凝胶微球封装聚多巴胺包覆的硒纳米颗粒构成,兼具抗氧化和免疫调节功能,能靶向作用于发炎结肠组织并有效缓解病症。相关研究以“Microfluidics-enabled polydopamine-coated selenium nanoparticles in hyaluronic hydrogel microspheres for targeted antioxidant and immunomodulatory therapy of ulcerative colitis”为题目,发表在期刊《Materials Today Bio》上。
本文要点:
1、本研究开发了一种微流控工程化口服递送系统,用于溃疡性结肠炎(UC)靶向抗氧化和免疫调节治疗。
2、该系统由甲基丙烯酸酯化透明质酸(HAMA)水凝胶微球组成,其中封装聚多巴胺包覆的硒纳米颗粒(CS-Se@PDA)。
3、这种微球具有均匀的结构,能通过静电和共价相互作用稳定锚定CS-Se@PDA纳米颗粒。聚多巴胺涂层增强了纳米颗粒的稳定性、黏膜黏附性和清除活性氧(ROS)的能力,HAMA外壳则提供pH响应性保护和CD44介导的对发炎结肠组织的靶向性。
4、体外研究表明其具有良好的生物相容性、有效的ROS中和作用,并能使巨噬细胞极化为抗炎的M2表型。
5、在葡聚糖硫酸钠诱导的结肠炎小鼠模型中,口服这种微球显著缓解了临床症状,包括体重下降得到缓解、结肠长度增加、组织学损伤减少,还能恢复紧密连接蛋白表达,有效抑制促炎细胞因子等。
6、总之,这种集成了抗氧化和免疫调节功能的微流控结肠靶向递送系统,为UC和其他炎症相关胃肠道疾病的非侵入性治疗提供了有前景的策略。

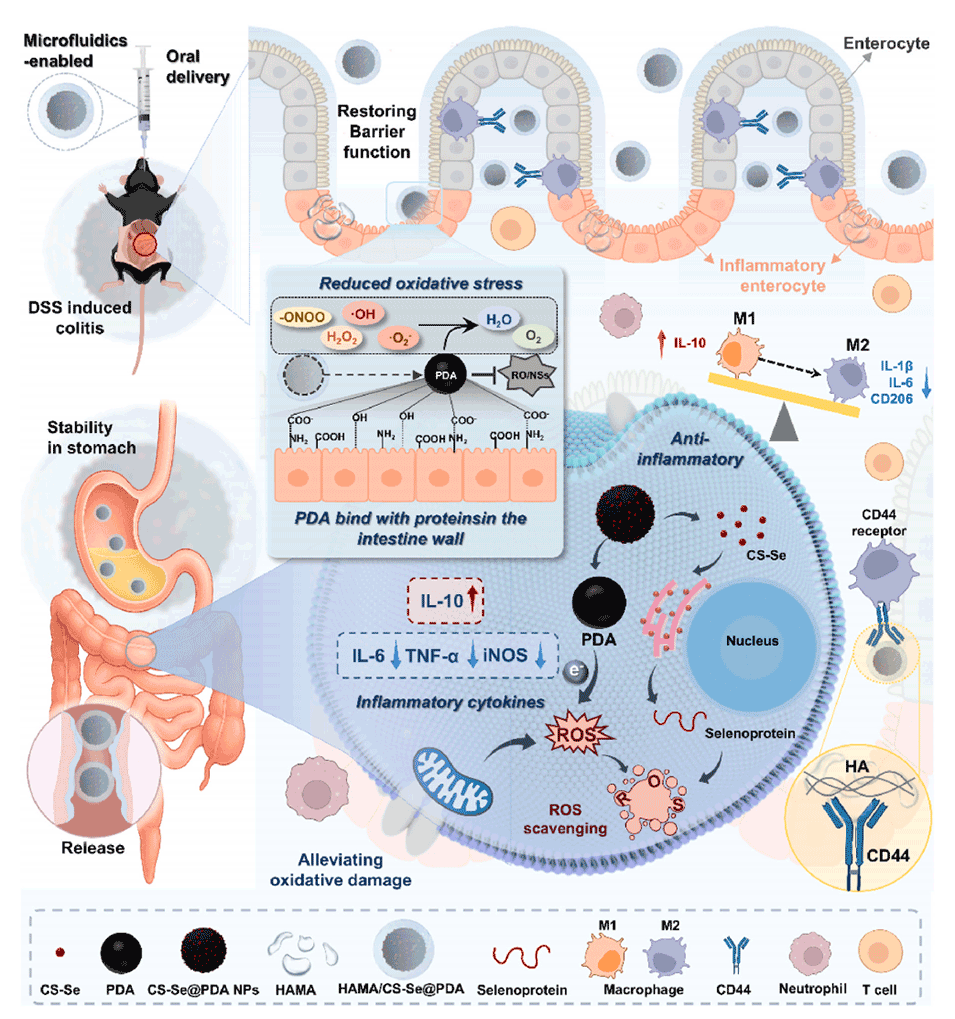
图 1. HAMA/CS-Se@PDA 水凝胶微球口服给药治疗炎症性肠病(IBD)的作用机制示意图。
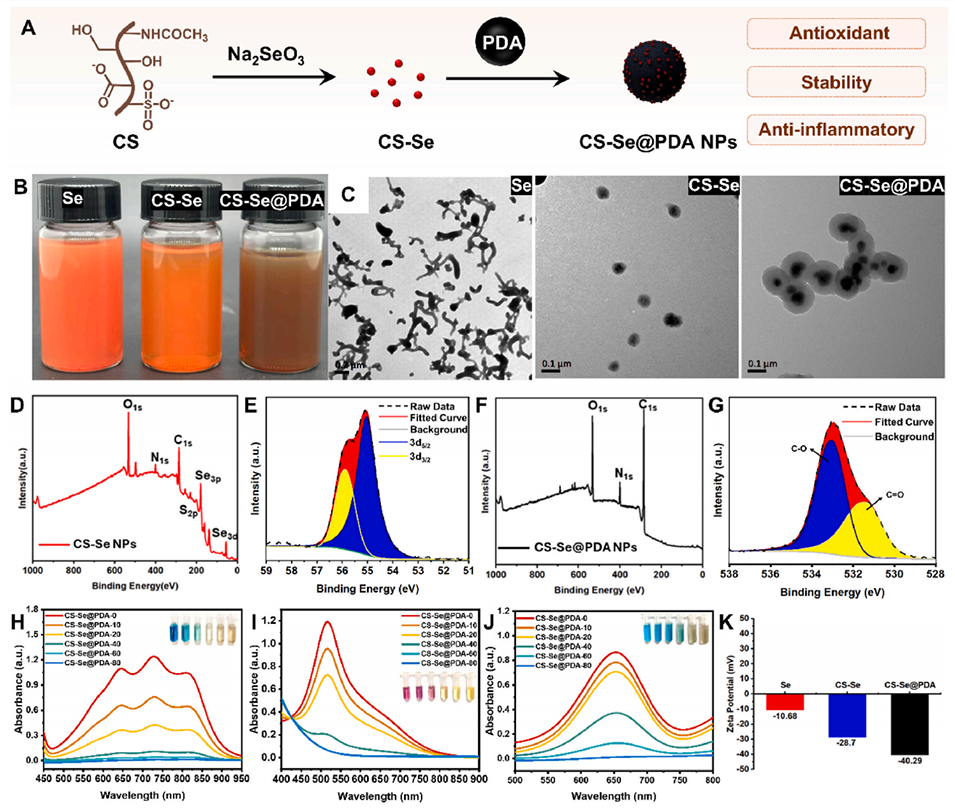
图 2. CS-Se@PDA 纳米颗粒的理化特性表征。(A)CS-Se@PDA 纳米颗粒的合成过程。(B)硒(Se)、CS-Se 及 CS-Se@PDA 纳米颗粒的光学图像。(C)Se、CS-Se 及 CS-Se@PDA 纳米颗粒的透射电镜(TEM)图像,显示经 CS 和 PDA 修饰后,颗粒从聚集的棒状转变为分散良好的球形。CS-Se 纳米颗粒的 X 射线光电子能谱(XPS)全谱(D),显示出 C 1s、N 1s、O 1s、S 2p 和 Se 3d 轨道的特征峰。CS-Se 纳米颗粒的高分辨率 Se 3d 谱(E),证实元素硒(Se⁰)的存在。CS-Se@PDA 纳米颗粒的 XPS 全谱(F),显示 C、N、O 的主要特征峰,而 PDA 层掩盖了 Se 和 S 的信号。高分辨率 O 1s 谱(G),表明与 C=O 相比,儿茶酚相关的 C-O 键大量存在,与 PDA 表面覆盖一致。(H-K)CS-Se 和 CS-Se@PDA 纳米颗粒对 ABTS⁺・(H)、DPPH・(I)和・OH(J)清除的紫外 - 可见吸收光谱,显示 PDA 修饰后抗氧化活性增强。Se、CS-Se 和 CS-Se@PDA 纳米颗粒的 zeta 电位测量(K),表明经 CS 和 PDA 功能化后胶体稳定性提高。
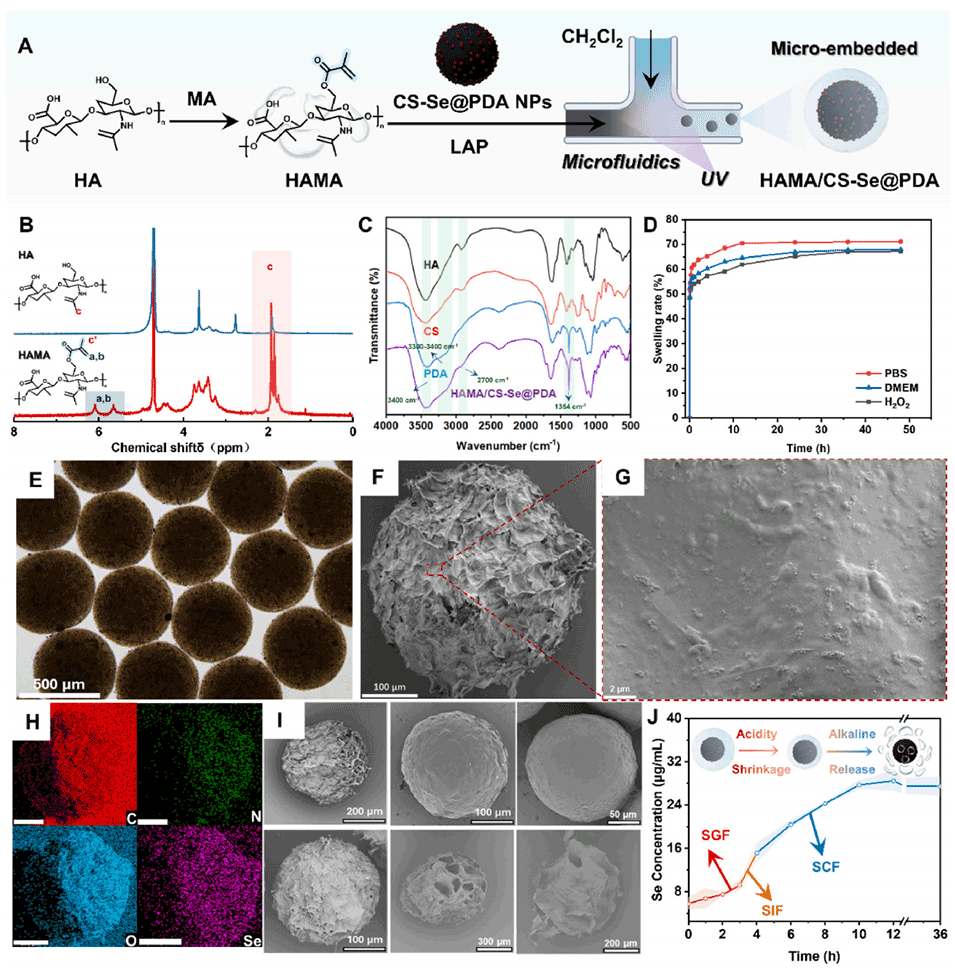
图 3. HAMA/CS-Se@PDA 水凝胶微球的制备及理化特性表征。(A)HAMA/CS-Se@PDA 的合成过程。(B)透明质酸(HA)和甲基丙烯酸酯化透明质酸(HAMA)的 ¹H 核磁共振(NMR)谱,显示甲基丙烯酸酯化后出现乙烯基质子和甲基峰。(C)硫酸软骨素(CS)、聚多巴胺(PDA)、HAMA 及 HAMA/CS-Se@PDA 微球的傅里叶变换红外(FTIR)光谱,识别特征官能团振动。(D)HAMA 水凝胶在 PBS(pH 7.4)中 24 小时的溶胀曲线。(E)HAMA/CS-Se@PDA 微球的光学显微镜图像,显示均匀的球形形态。(F)冷冻干燥微球的扫描电镜(SEM)图像,显示致密的球形结构。(G)高倍 SEM 图像,突出表面锚定的纳米颗粒。(H)微球的能量色散 X 射线光谱(EDS) ,显示 C、N、O、S 和 Se 元素的均匀分布(比例尺:100 μm)。(I)经模拟胃液(SGF)处理不同时间点(0、2、4、6、8、10 小时)的微球 SEM 图像,显示表面形态变化。(J)通过电感耦合等离子体质谱(ICP-MS)测定的微球在模拟胃液(SGF)、模拟肠液(SIF)和模拟结肠液(SCF)pH 条件下的硒释放曲线。
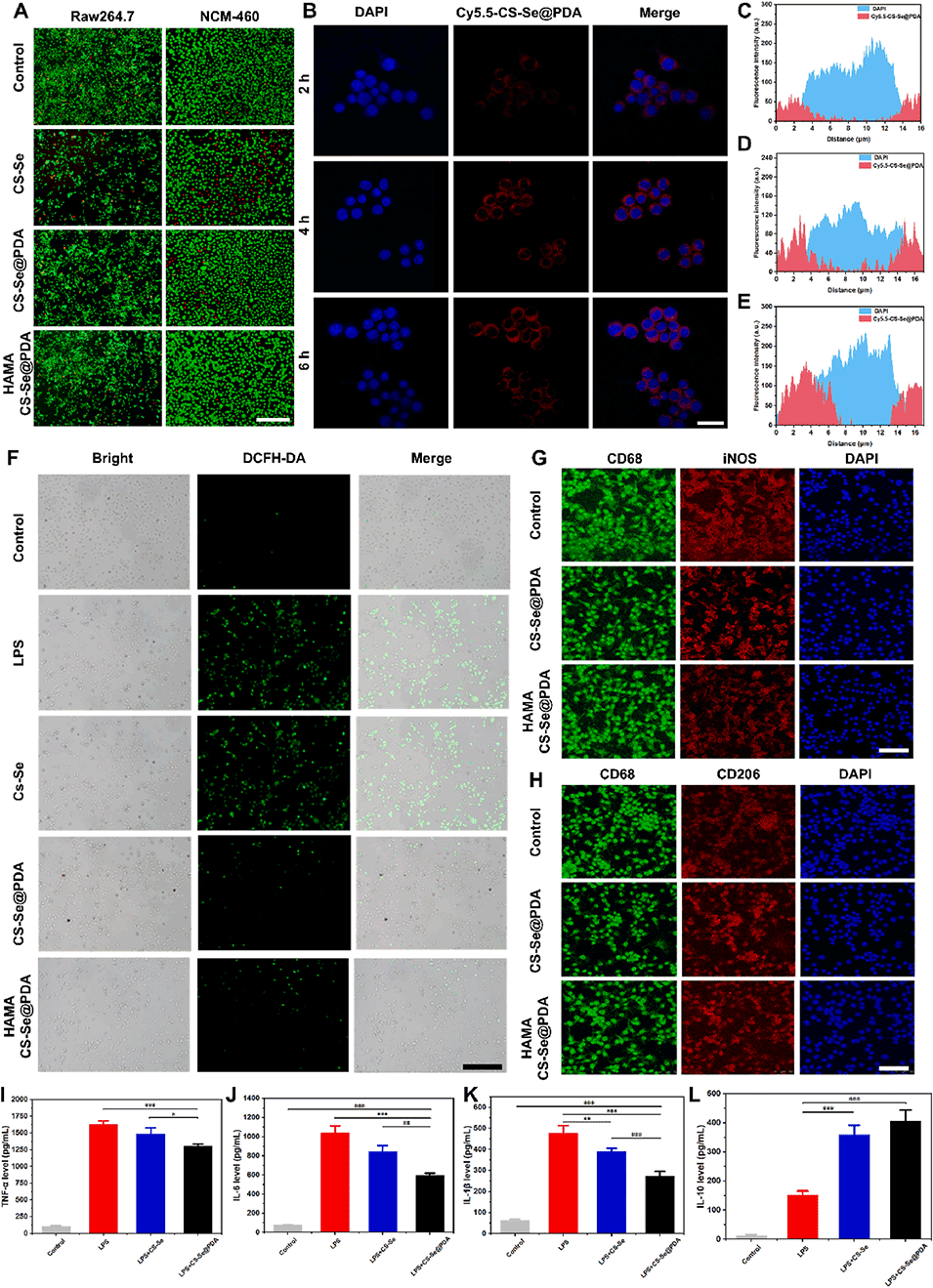
图 4. CS-Se@PDA 纳米颗粒和 HAMA/CS-Se@PDA 微球的体外生物相容性、细胞摄取及免疫调节评估。(A)NCM-460 和 RAW264.7 细胞与 CS-Se 纳米颗粒、CS-Se@PDA 纳米颗粒及 HAMA/CS-Se@PDA 微球共孵育 24 小时后的钙黄绿素 - AM / 碘化丙啶(Calcein AM/PI)染色,通过 Calcein-AM/PI 荧光观察。比例尺:100 μm。(B)共聚焦荧光图像显示 RAW264.7 细胞在孵育 2、4 和 6 小时后对 Cy5.5 标记的 CS-Se@PDA 纳米颗粒(红色)的时间依赖性摄取。比例尺:50 μm。(C-E)各时间点的相应半定量荧光强度分析,C)2 小时,D)4 小时,E)6 小时。(F)经脂多糖(LPS)刺激的 RAW264.7 细胞在经 CS-Se 纳米颗粒、CS-Se@PDA 纳米颗粒或 HAMA/CS-Se@PDA 微球处理后的细胞内活性氧(ROS)水平,采用 DCFH-DA 探针评估。比例尺:100 μm。(G、H)巨噬细胞极化标志物的免疫荧光染色:M1 表型的 CD68(绿色)和 iNOS(红色)(G);M2 表型的 CD68(绿色)和 CD206(红色)(H)。比例尺:100 μm。(I-L)LPS 刺激后细胞上清液中促炎和抗炎细胞因子的酶联免疫吸附测定(ELISA)定量:肿瘤坏死因子 -α(TNF-α)(I)、白细胞介素 - 6(IL-6)(J)、白细胞介素 - 1β(IL-1β)(K)和白细胞介素 - 10(IL-10)(L)。*p < 0.05,**p < 0.01,***p < 0.001。
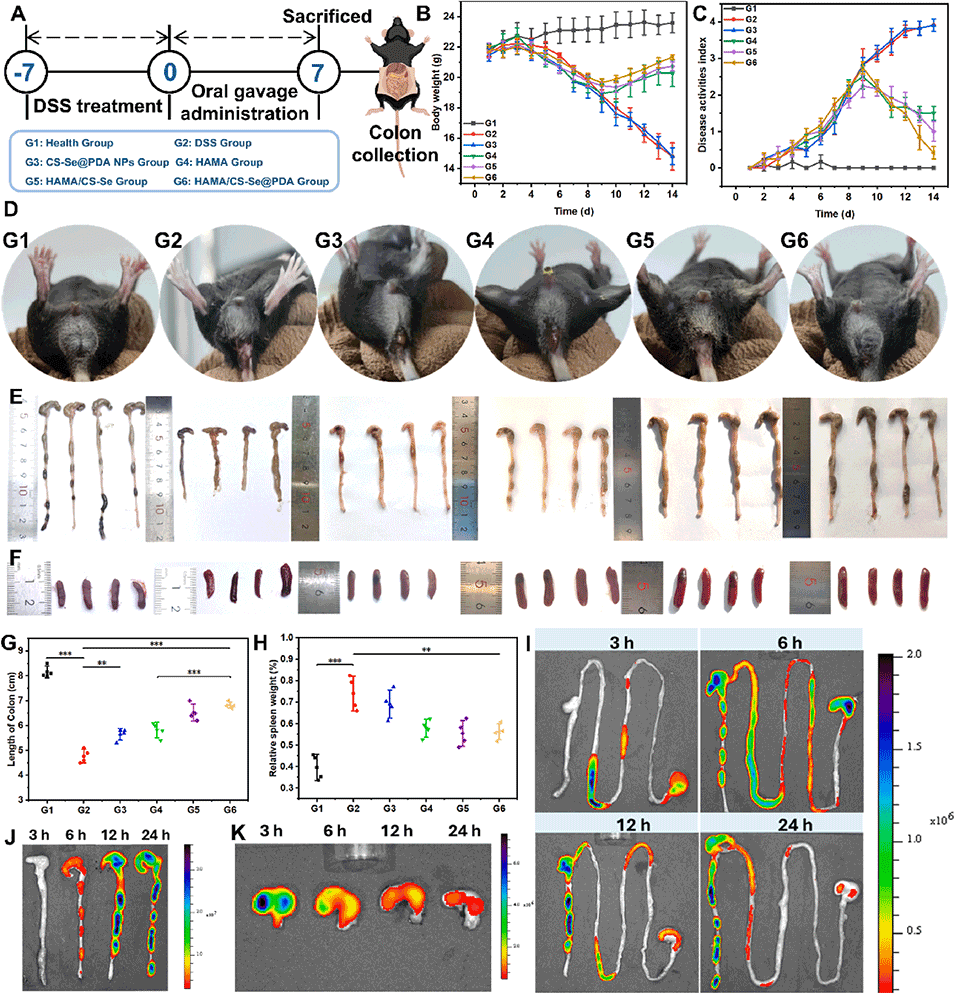
图 5. HAMA/CS-Se@PDA 水凝胶微球在葡聚糖硫酸钠(DSS)诱导的急性结肠炎小鼠模型中的体内治疗效果和结肠滞留性。(A)结肠炎诱导和口服治疗方案的时间线示意图。(B)实验期间小鼠的体重变化。(C)反映结肠炎临床严重程度的疾病活动指数(DAI)评分。(D)7 天 DSS 给药后小鼠肛周区域的代表性图像。(E)治疗后结肠组织的大体形态外观。(F)第 15 天收获的脾脏代表性图像。(G)各组结肠长度的定量分析。(H)归一化至体重的相对脾脏重量。(I)灌胃 Cy5.5 标记微球后 3、6、12 和 24 小时胃肠道的离体近红外荧光图像。(J)结肠段中 Cy5.5 荧光强度的定量分析。(K)胃段中 Cy5.5 荧光强度的定量分析。**p < 0.01,***p < 0.001。
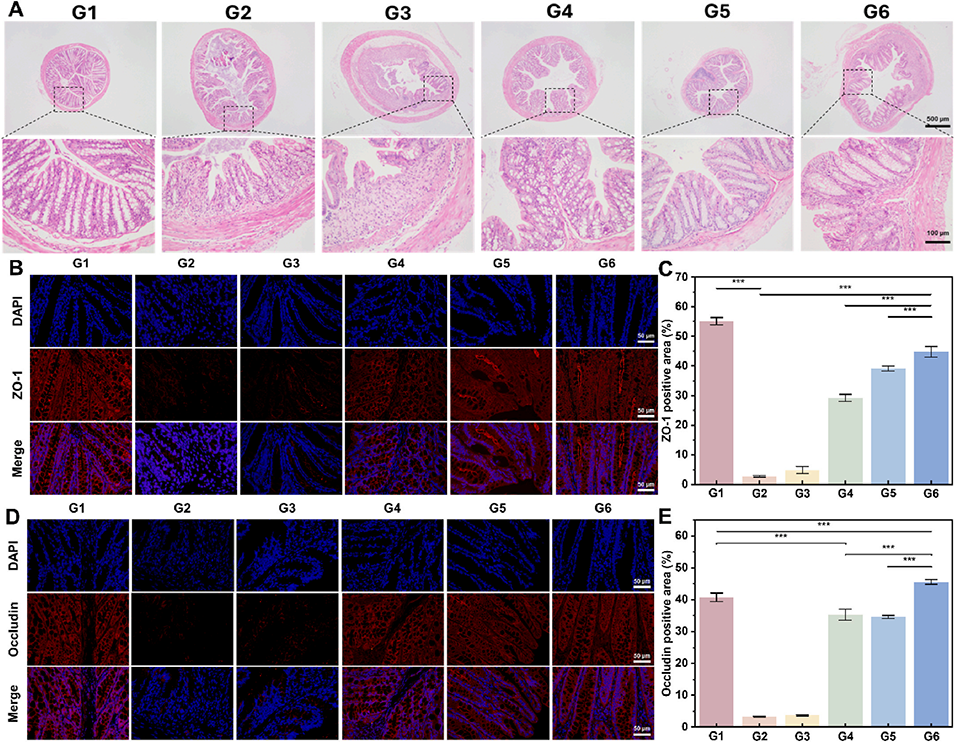
图 6. HAMA/CS-Se@PDA 水凝胶微球在 DSS 诱导的急性结肠炎小鼠中的治疗评估。(A)各组结肠组织的代表性苏木精 - 伊红(H&E)染色切片,显示炎症严重程度和组织结构。(B)结肠组织中 ZO-1 蛋白的免疫荧光染色,指示上皮紧密连接完整性。(C)ZO-1 荧光强度的定量分析。(D)结肠组织中闭合蛋白(Occludin)的免疫荧光染色。(E)Occludin 荧光强度的定量分析。**p < 0.01,***p < 0.001。
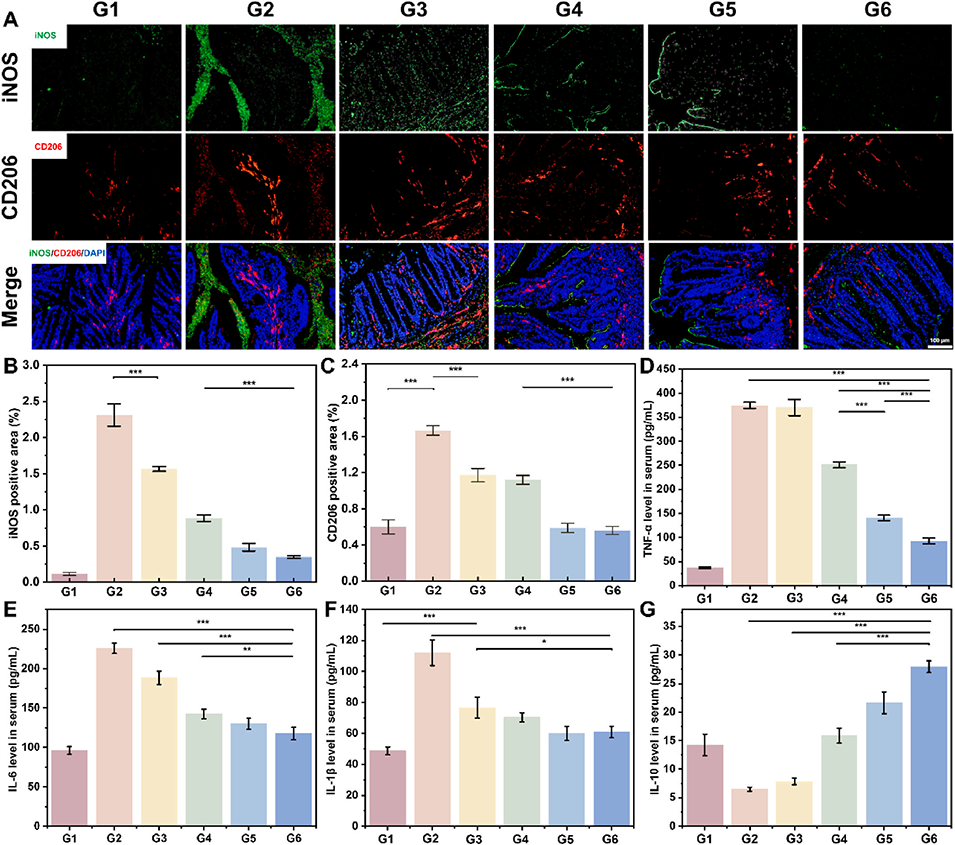
图 7. HAMA/CS-Se@PDA 微球在 DSS 诱导的急性结肠炎小鼠中的体内免疫调节评估。(A)结肠组织中巨噬细胞极化标志物的免疫荧光染色,显示 M1 表型(iNOS,红色)和 M2 表型(CD206,绿色)。(B)M1 标志物(iNOS)荧光区域的半定量分析。(C)M2 标志物(CD206)荧光区域的半定量分析。(D-G)治疗后小鼠血清中炎症细胞因子水平的定量分析,包括肿瘤坏死因子 -α(TNF-α)(D)、白细胞介素 - 6(IL-6)(E)、白细胞介素 - 1β(IL-1β)(F)和抗炎细胞因子白细胞介素 - 10(IL-10)(G),通过 ELISA 测定。*p < 0.05,**p < 0.01,***p < 0.001。
论文链接:https://doi.org/10.1016/j.mtbio.2025.102182
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














