
导读:
栓塞治疗通过将栓塞材料注入血管阻断肿瘤血供或控制出血,其疗效依赖于栓塞材料的性能。现有制备PVA微球的方法(如乳化交联、喷雾干燥、冻融法等)存在尺寸不均、能耗高、周期长、难以控制弹性等问题。鉴于此,四川大学褚良银教授、巨晓洁教授等人开发出一种基于液滴微流控的新策略,制备具有可控尺寸、弹性及良好性能的单分散PVA微球,用于栓塞治疗。相关研究以“Controllable Fabrication of Monodisperse Poly(vinyl alcohol) Microspheres with Droplet Microfluidics for Embolization”为题目,发表在期刊《Industrial & Engineering Chemistry Research》上。
本文要点:
1、本研究开发了一种基于液滴微流控的新策略,用于简便制备单分散聚乙烯醇(PVA)微球,其尺寸和弹性可控,适用于栓塞治疗。
2、先以PVA和硼酸的水溶液为分散相,制备单分散乳液液滴作为模板,再通过在下游接收溶液中添加NaOH,触发液滴内PVA与硼酸的化学交联。
3、交联速度和程度可通过调节NaOH浓度、接收溶液高度及转速控制;液滴模板和交联后PVA微球的尺寸,可通过调整微流控装置特征尺寸及两相流速精确控制;微球的弹性、溶胀及载药性能,可通过调节分散相中PVA与硼酸的比例调控。
4、体外芯片实验显示其栓塞性能优异,该策略为制备用于栓塞治疗的PVA微球提供了简便高效的途径。
交联过程中NaOH浓度、接收溶液高度及转速为何需严格优化?其对微球结构与性能的具体影响是什么?
这三个参数直接决定PVA与硼酸的交联效率和微球完整性。NaOH浓度过低会导致交联不完全,微球分散性差;过高则因过度交联导致表面塌陷,球形度下降(3%为最优)。
接收溶液高度不足会使液滴停留时间短,交联不充分;高度达9cm时可确保完全交联。
接收溶液转速较低会导致液滴聚集融合,较高则增强NaOH扩散,提升分散性与球形度(785 rad/s为最优)。三者协同优化是保障微球结构均一、性能稳定的关键。
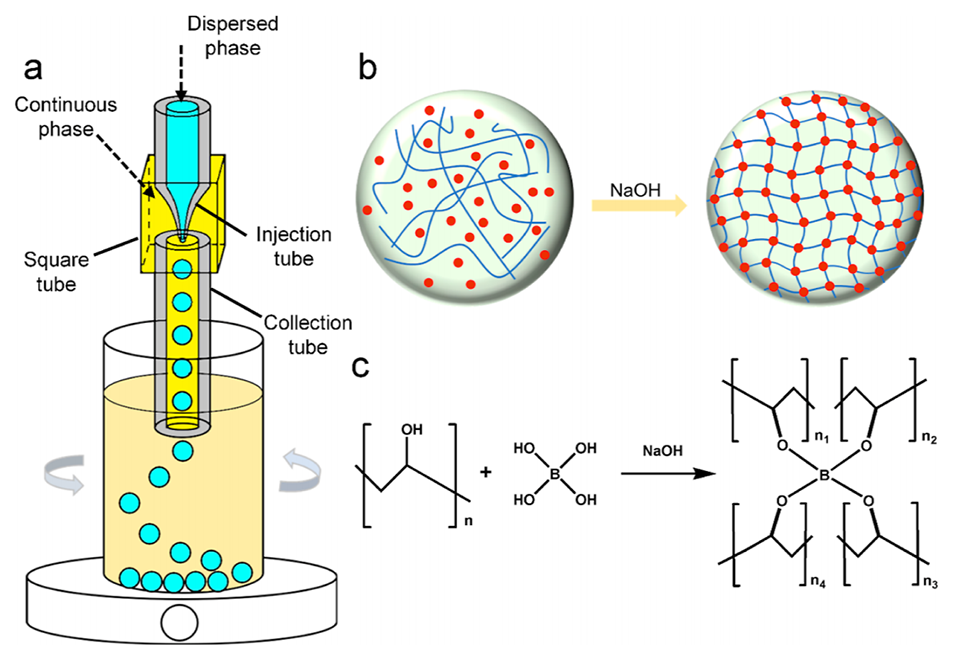
图 1. 用于制备单分散PVA微球的微流控装置及交联原理示意图。(a) 用于生成PVA微球的微流控装置。(b) 添加NaOH触发模板液滴内聚乙烯醇化学交联的示意图。(c) 分子层面上PVA与硼酸之间化学交联的原理。
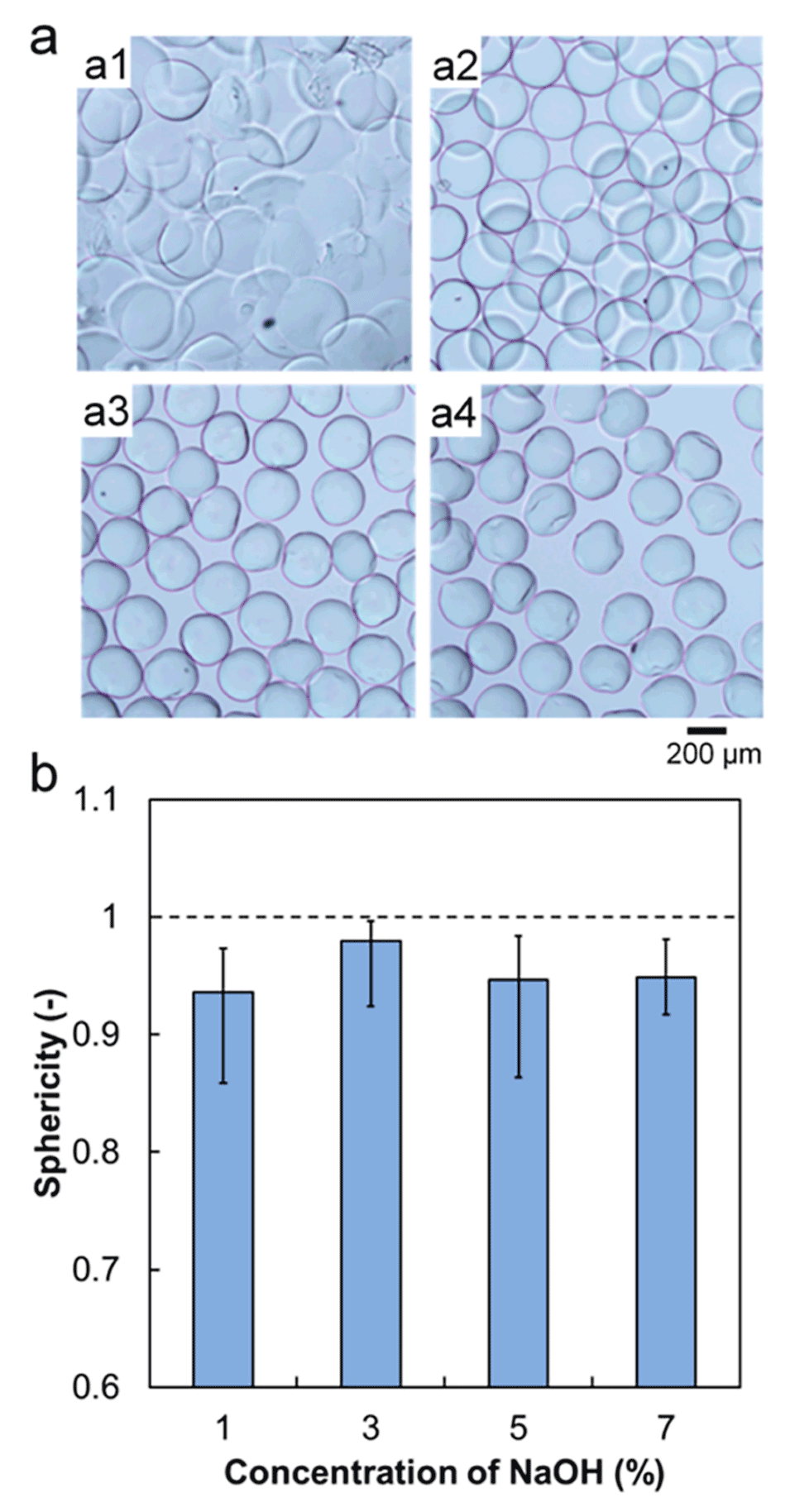
图 2. 接收溶液中NaOH浓度对PVA微球结构的影响。(a) NaOH浓度为1%(a1)、3%(a2)、5%(a3)、7%(a4)时制备的交联PVA微球的光学显微照片。(b) 不同NaOH浓度下制备的PVA微球的球形度,图中数据为平均值,误差棒代表数据与平均值的最大和最小偏差。接收溶液高度为9 cm,接收溶液转速为0.785 rad/s。
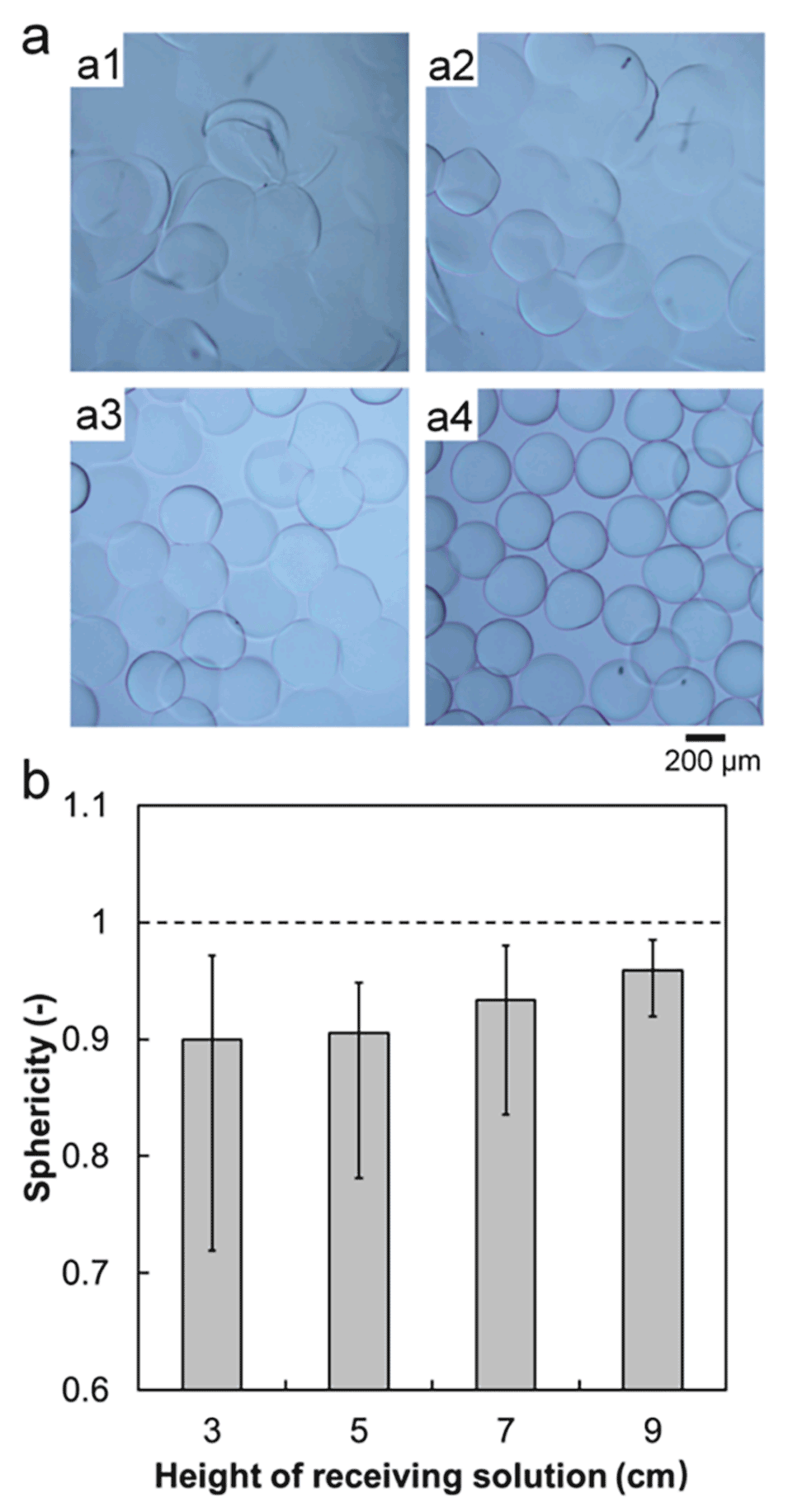
图 3. 接收溶液高度对PVA微球结构的影响。(a) 接收溶液高度为3 cm(a1)、5 cm(a2)、7 cm(a3)、9 cm(a4)时制备的交联PVA微球的光学显微照片。(b) 不同接收溶液高度下制备的PVA微球的球形度,图中数据为平均值,误差棒代表数据与平均值的最大和最小偏差。接收溶液中NaOH浓度为3%,接收溶液转速为0.785 rad/s。
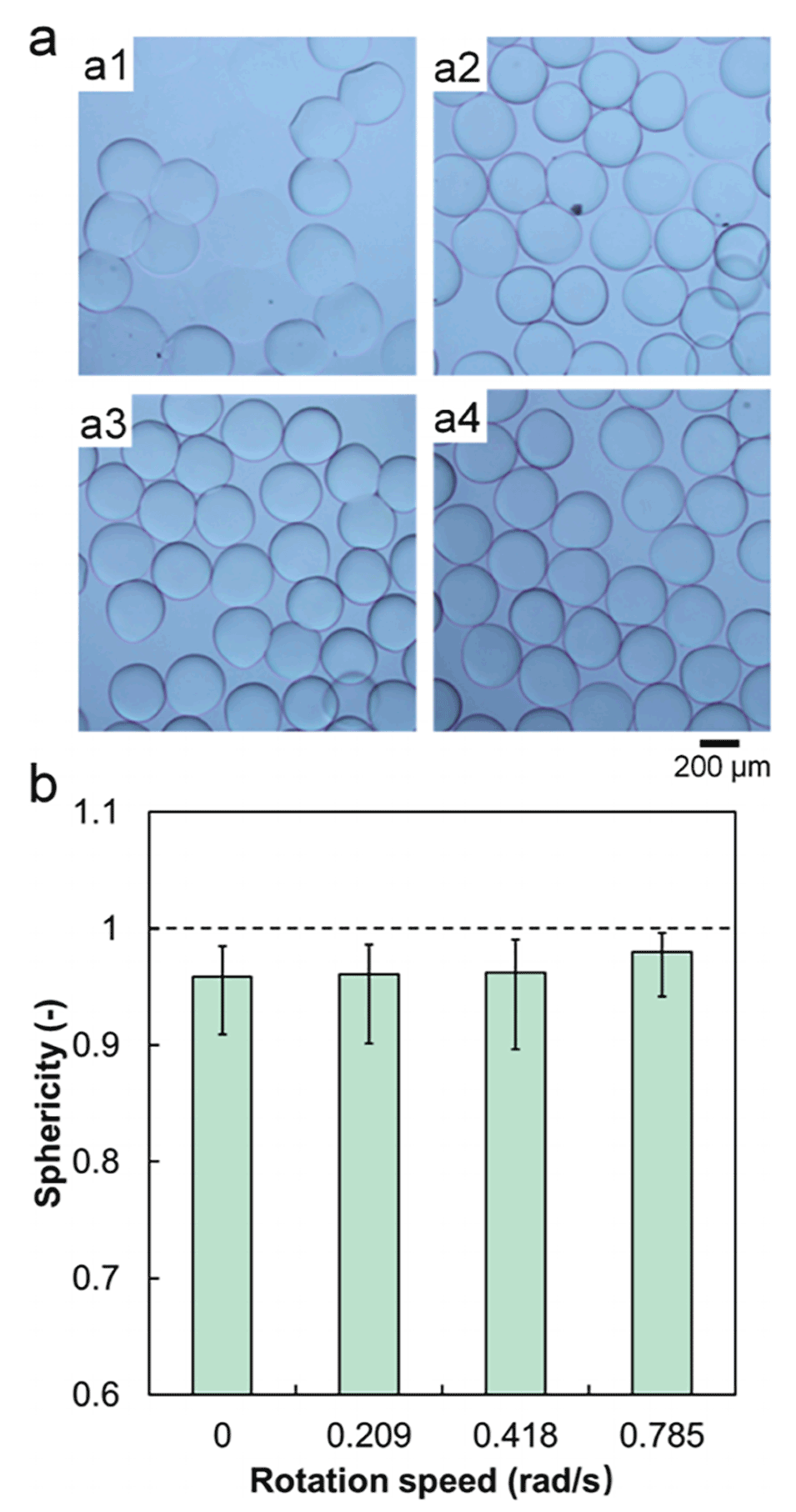
图 4. 接收溶液转速对PVA微球结构的影响。(a) 接收溶液转速为0 rad/s(a1)、0.209 rad/s(a2)、0.418 rad/s(a3)、0.785 rad/s(a4)时制备的交联PVA微球的光学显微照片。(b) 不同接收溶液转速下制备的PVA微球的球形度,图中数据为平均值,误差棒代表数据与平均值的最大和最小偏差。接收溶液中NaOH浓度为3%,接收溶液高度为9 cm。
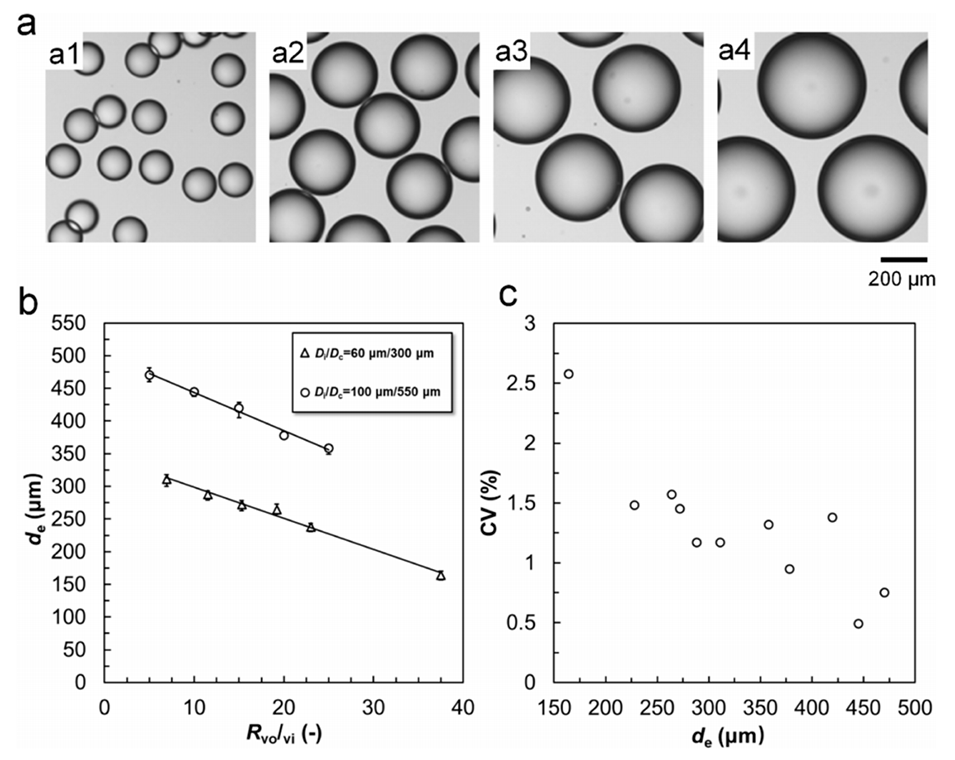
图 5. 微流控装置特征尺寸及内外流体流速对模板液滴尺寸的影响。(a) 平均直径为158 μm(a1)、288 μm(a2)、378 μm(a3)、470 μm(a4)的单分散模板液滴的光学显微照片。(b) 外流体与内流体流速比(Rvo/vi)及微流控装置尺寸(Di/Dc)对模板液滴尺寸的影响,图中数据为平均值,误差棒代表数据与平均值的最大和最小偏差。(c) 不同平均尺寸(de)模板液滴的变异系数(CV)。
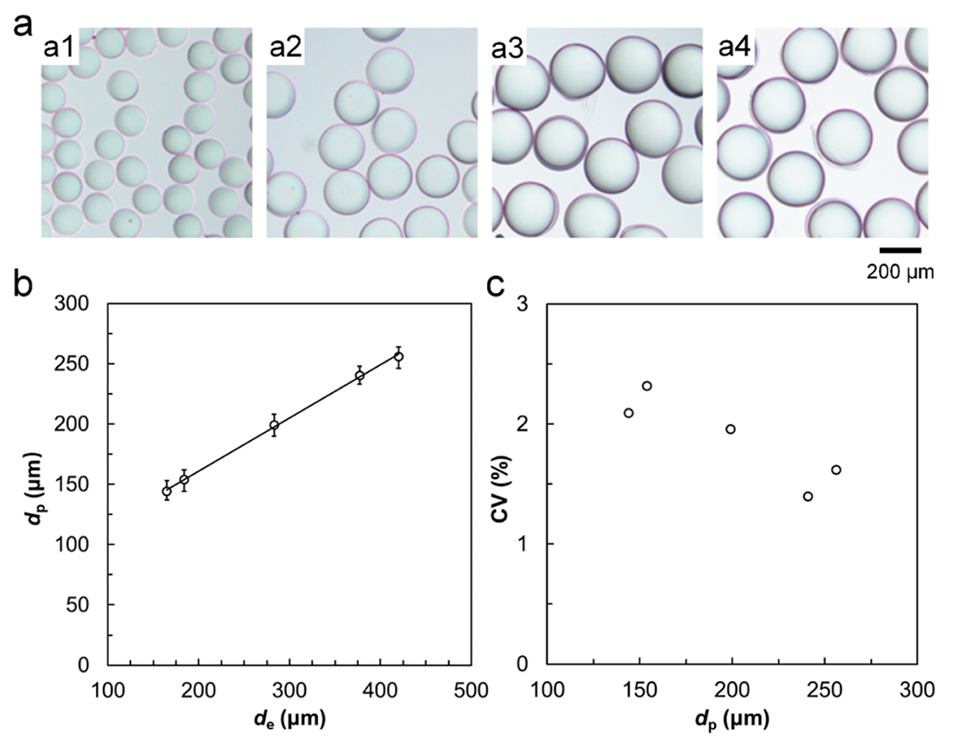
图 6. PVA液滴模板尺寸对交联PVA微球尺寸的影响。(a) 平均直径为144 μm(a1)、195 μm(a2)、240 μm(a3)、256 μm(a4)的交联单分散PVA微球的光学显微照片。(b) 液滴模板尺寸(de)对交联PVA微球尺寸(dp)的影响,图中数据为平均值,误差棒代表数据与平均值的最大和最小偏差。(c) 不同平均尺寸(dp)交联PVA微球的变异系数(CV)。
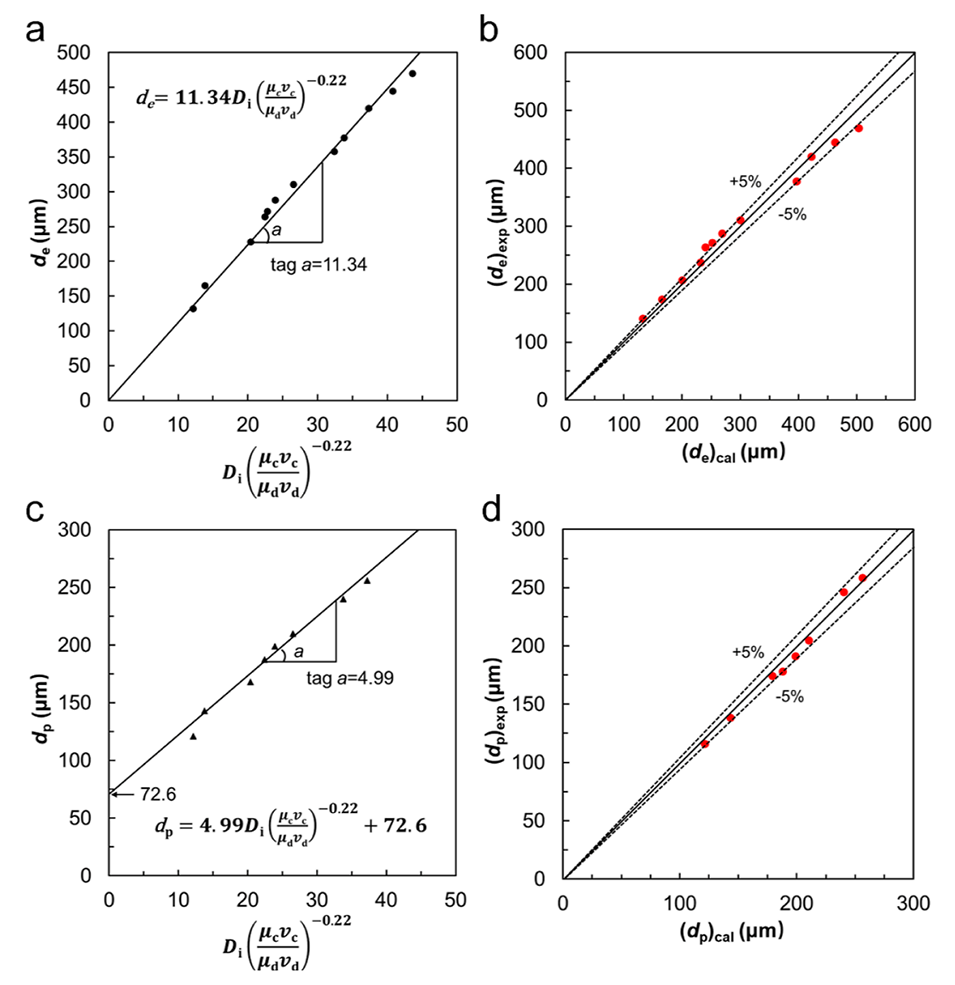
图 7. 连续相和分散相流体的黏度、流速以及注射管锥形孔内径对PVA液滴模板和交联PVA微球尺寸的影响。(a, b) 连续相和分散相流体的黏度、流速以及注射管锥形孔内径对模板液滴尺寸的影响(a),以及模板液滴计算尺寸与实验尺寸的误差分析(b)。(c, d) 连续相和分散相流体的黏度、流速以及注射管锥形孔内径对交联PVA微球尺寸的影响(c),以及交联PVA微球计算尺寸与实验尺寸的误差分析(d)。

图 8. (a) PVA微球的扫描电镜图像。(b, c) PVA微球横截面的扫描电镜图像,其中(c)是(b)的放大图像。(d-h) 交联PVA微球的元素分析,其中(d)为扫描电镜图像,(e-g) 为硼、碳、氧元素的EDS元素映射图像,(h) 为元素的能谱图。
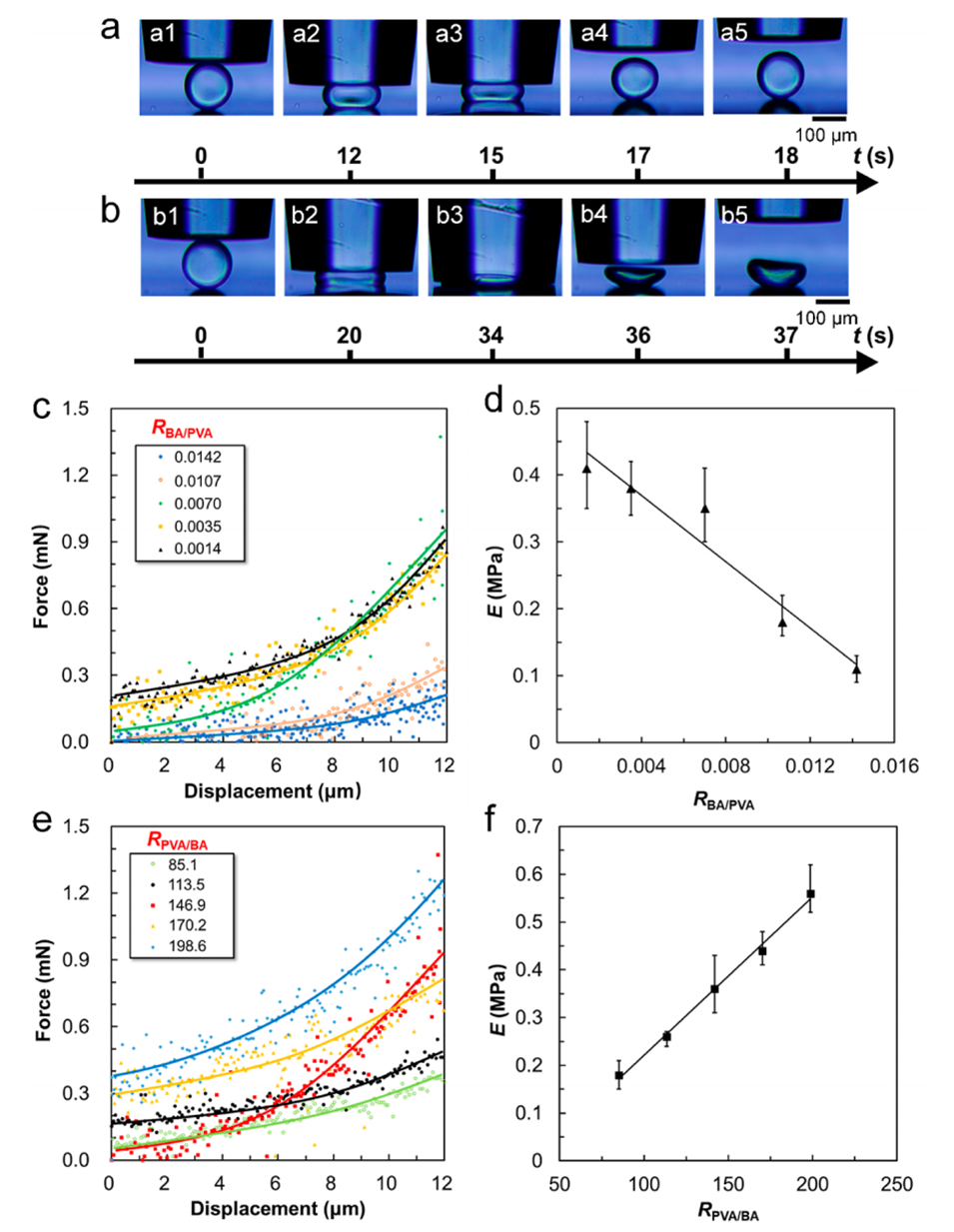
图 9. PVA与硼酸的比例(RBA/PVA)对交联PVA微球弹性性能的影响。
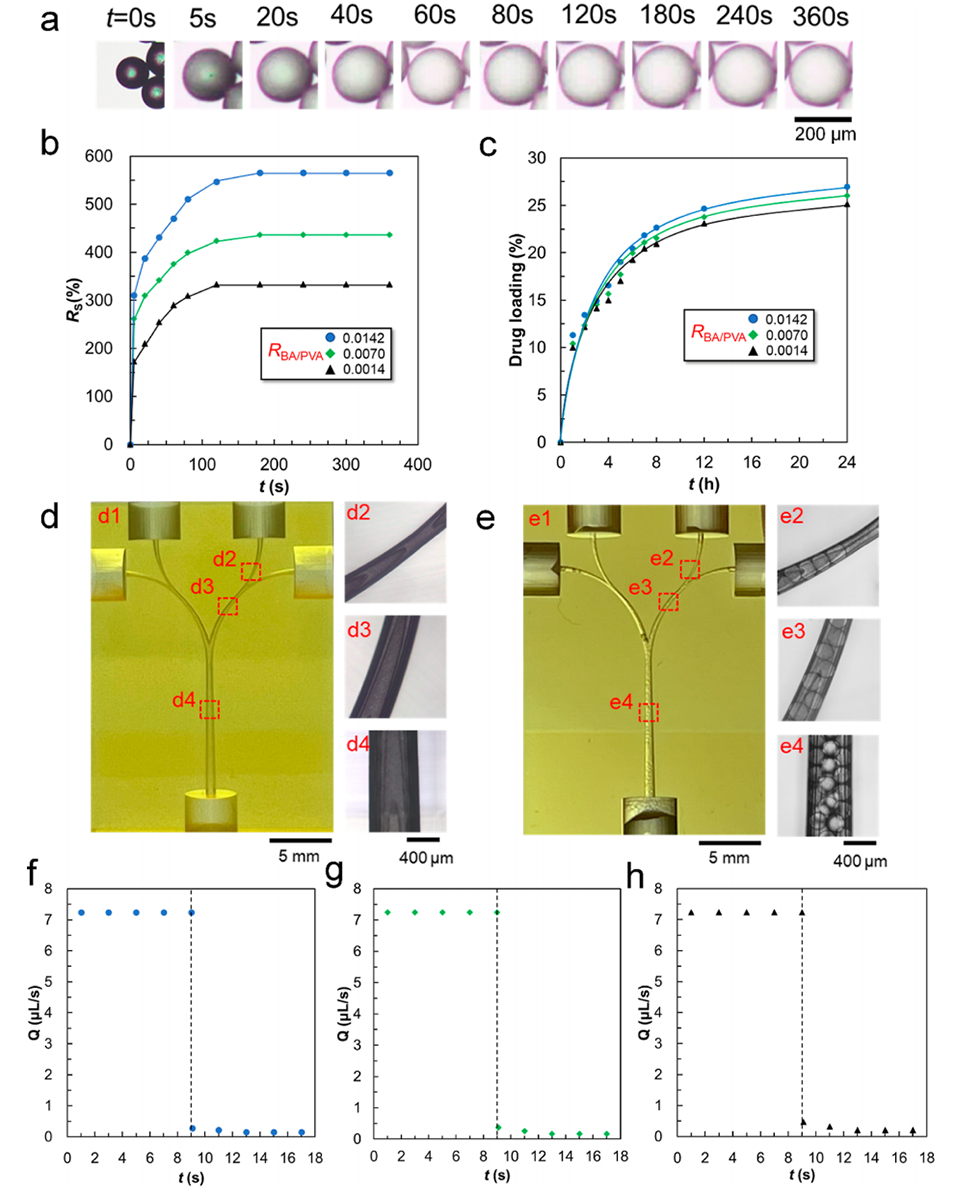
图 10. (a) PVA微球在水中不同时间间隔的溶胀过程光学显微照片。(b) RBA/PVA值对PVA微球在水中溶胀率的影响。(c) RBA/PVA值对以阿霉素为模型药物的PVA微球载药量的影响。(d) 体外栓塞芯片的光学显微镜图像(d1)和显微照片(d2-d4),该芯片由三部分尺寸逐渐减小的微通道组成,包括一个主干微通道(d4)、两个中间分支微通道(d3)和四个末端微通道(d2)。(e) 向微通道中注入PVA微球后体外栓塞芯片的光学显微镜图像(e1)和显微照片(e2-e4),其中三部分微通道均充满了PVA微球(e2-e4)。在芯片最小的末端微通道(e2)中,PVA微球被挤压变形,实现完全栓塞。(f-h) RPB/PVA值分别为0.0142(f)、0.0070(g)、0.0014(h)的PVA微球注入前后体外栓塞芯片微通道的水通量。
论文链接:https://doi.org/10.1021/acs.iecr.2c02173
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














