
导读:
液滴微流控技术(DBM)已成为从单细胞分析和药物筛选到诊断和组织工程等广泛生化应用的强大工具。近期,有研究人员发表综述,系统介绍了微流控中液滴生成和操控的被动与主动策略,涵盖从液滴生成的多种几何结构与驱动方式,到捕获、分选技术的原理与应用,还探讨了当前面临的挑战及未来发展方向。相关研究成果以“Droplet Generation and Manipulation in Microfluidics: A Comprehensive Overview of Passive and Active Strategies”为题目,发表在期刊《Biosensors》上。
本文要点:
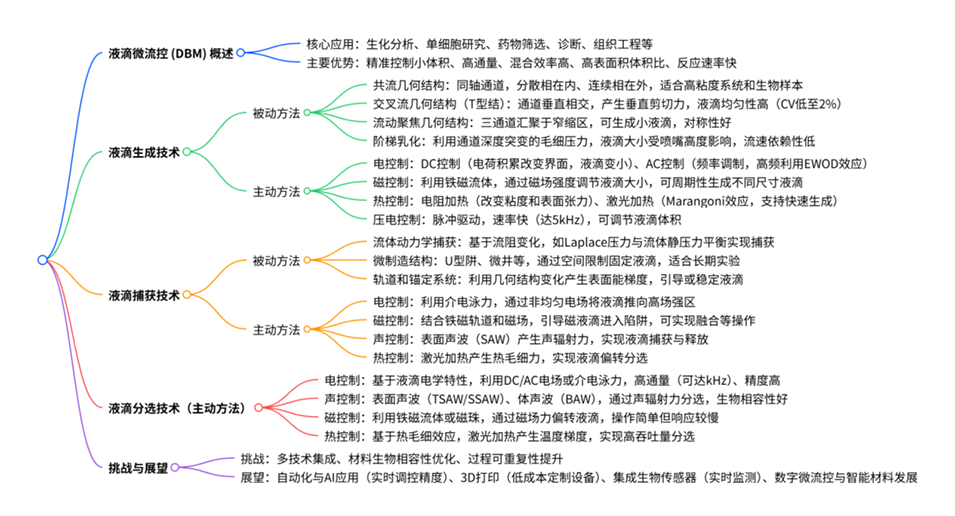
1、本综述全面概述了液滴微流控技术(DBM)中液滴生成、捕获和分选的被动与主动策略及其最新进展。
2、在液滴生成方面,被动方法依靠流体动力学不稳定性和毛细作用,如共流、交叉流(T型结)、流动聚焦和阶梯乳化等几何结构,虽简单且易与紧凑型设备集成,但可调性较差;主动方法则利用电场、磁场、热场或机械力等外部场实现按需控制,精度和通量更高,不过需额外设备。
3、液滴捕获技术中,被动方法基于流体动力学阻力、几何约束等,如流体动力学捕获、U型微结构、轨道和锚定系统等,具有简单、低成本等特点;主动方法借助外部物理场,如电场、磁场、声波等,可实现更精准灵活的操控。
4、液滴分选聚焦于主动技术,包括利用电场、声场、磁场和热场等,能根据液滴的大小、内容物等特性进行高效分选,在高通量分析等领域作用显著。
5、此外,还探讨了各类方法的设计灵活性、可扩展性和生物相容性等,指出当前存在的集成、生物相容性、可重复性等挑战,并展望了自动化、人工智能、3D打印等技术在该领域的应用前景。
一张图读懂全文
液滴捕获与分选的“集成化”难点在哪里?
文中提到,液滴操纵的核心价值在于“从生成到分析的全流程可控”,但捕获(如U型阱、声捕获)与分选(如电分选、磁分选)的集成仍面临挑战:
1、力场干扰:例如主动捕获采用的电场可能干扰后续电分选的信号,导致分选精度下降;
2、流体动力学匹配:捕获模块的低流速需求与分选模块的高吞吐量存在矛盾(如被动流体动力学捕获需稳定低流速,而分选常需高速流维持效率);
3、体积限制:微流控芯片尺寸有限,多模块集成可能导致液路复杂度过高,增加死体积和污染风险。
潜在解决思路:
采用“模块化设计”,通过阀门切换液路(如文中提到的长尾夹调控流体动力学阻力),减少不同模块的直接干扰;
优先选择兼容力场,例如声捕获(SAW)与声分选(BAW)均基于声学原理,可减少跨场干扰,且生物相容性一致。
集成的最终目标是实现“生成-捕获-分析-分选”闭环,例如在肿瘤药物筛选中,可通过被动捕获固定细胞液滴,结合声学分选快速分离响应阳性的液滴,提升实验效率。
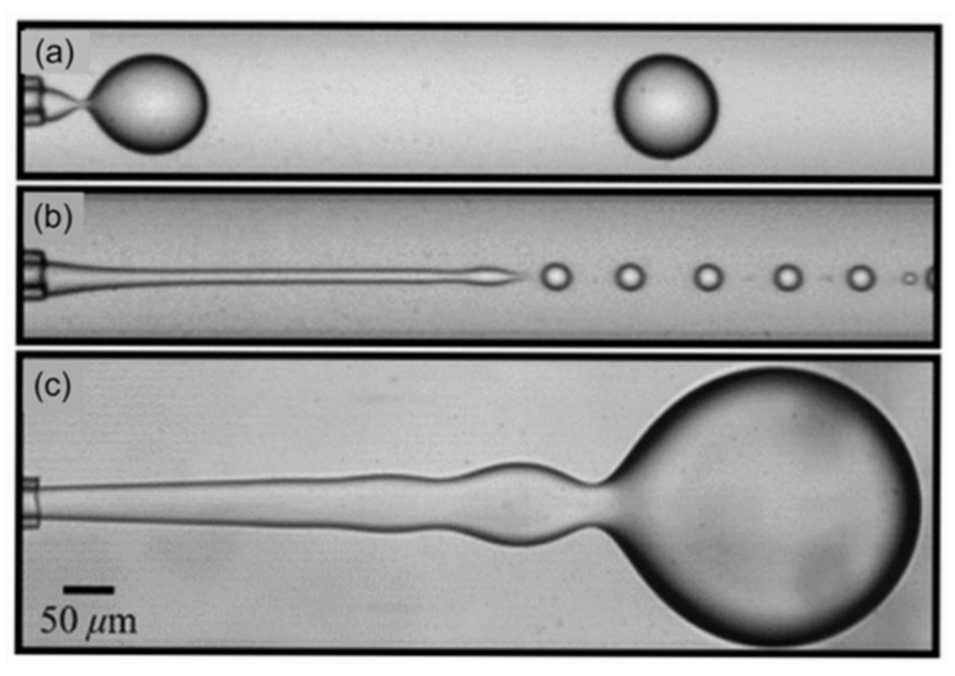
图 1:展示共流方法中三种液滴生成状态:(a)滴落状态、(b)窄喷射状态、(c)宽喷射状态,呈现不同流态下的液滴形成特征。
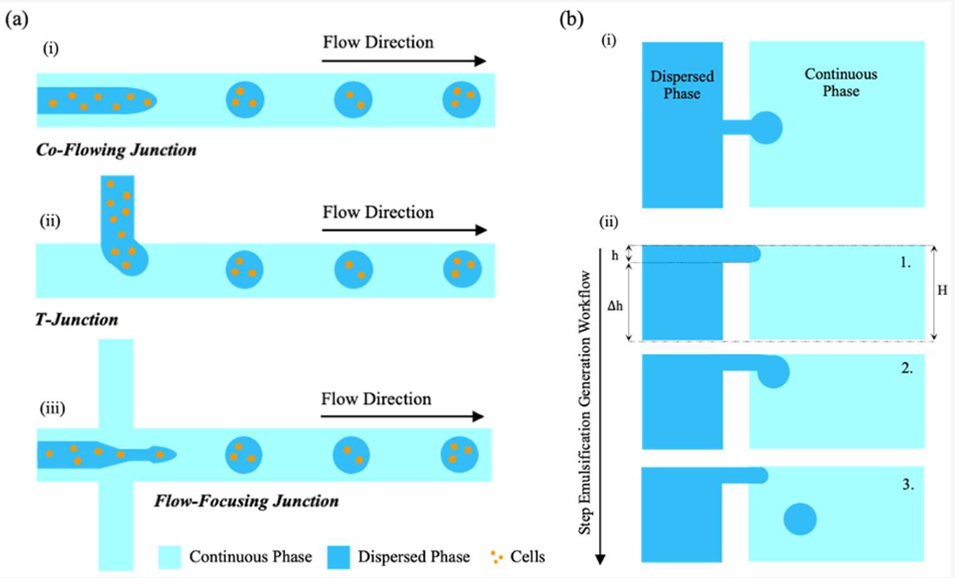
图 2:细胞负载微胶囊生成与阶梯乳化机制。(a)基于液滴的微流控生成细胞负载水凝胶微胶囊的三种基本装置示意图:(i)同轴装置、(ii)T 型结装置、(iii)流动聚焦结装置;(b)阶梯乳化机制示意图:(i)微流控结构俯视图(分散相经浅喷嘴流入连续相填充的深储层)、(ii)侧视图(液滴形成的横截面序列)。
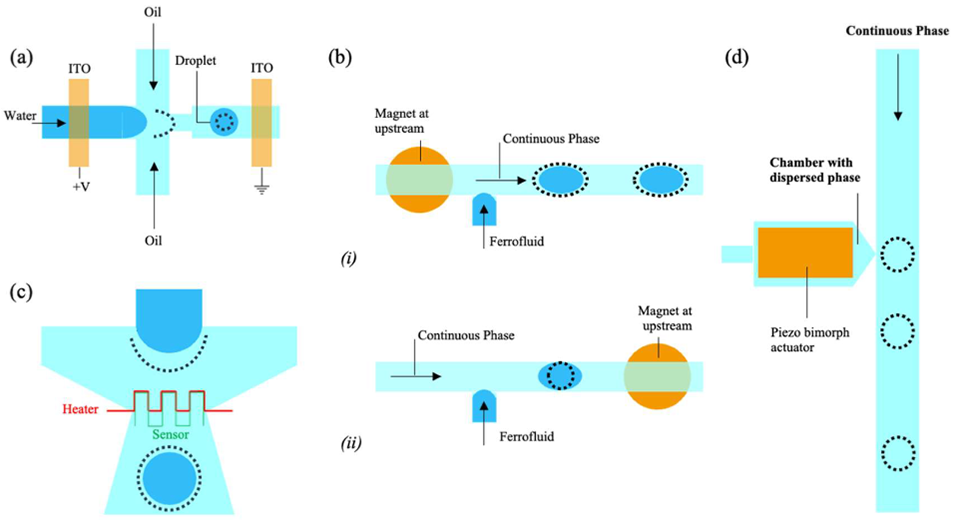
图 3:主动法液滴生成示意图。(a)施加直流电压生成液滴的示意图;(b)带铁磁流体和磁铁的 T 型结装置(i)磁铁在上游位置、(ii)磁铁在下游位置;(c)研究液滴形成过程温度依赖性的微流控装置示意图;(d)按需分配液滴的微流控芯片:压电致动器将水性液滴释放到含不互溶流体的垂直通道中。
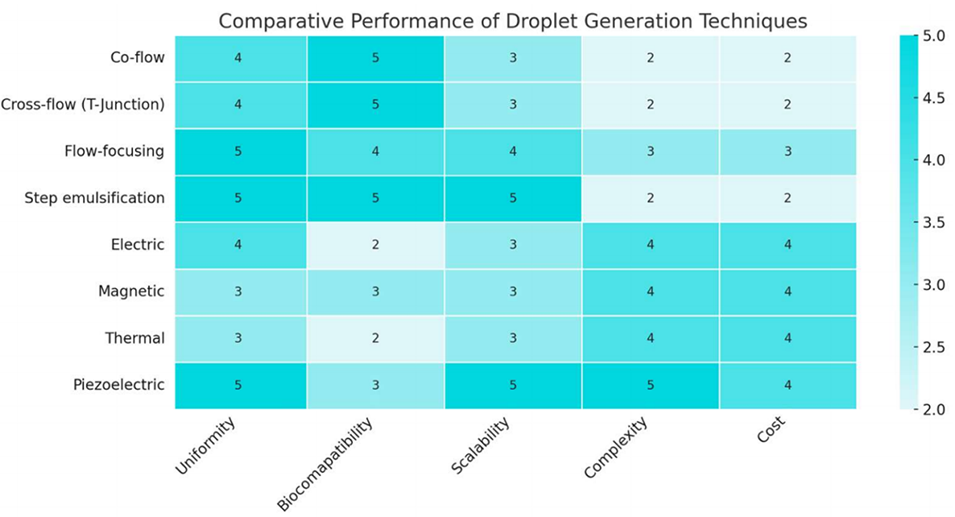
图 4:液滴生成技术性能比较热图。基于五个性能指标(液滴均匀性、生物相容性、可扩展性/通量、系统复杂度、成本)对液滴生成技术进行定性评分(1 分最差至 5 分最优),对比被动方法(共流、交叉流/ T 型结、流动聚焦、阶梯乳化)和主动方法(电、磁、热、压电),展示各方法的优势与权衡,为特定应用选择提供参考。
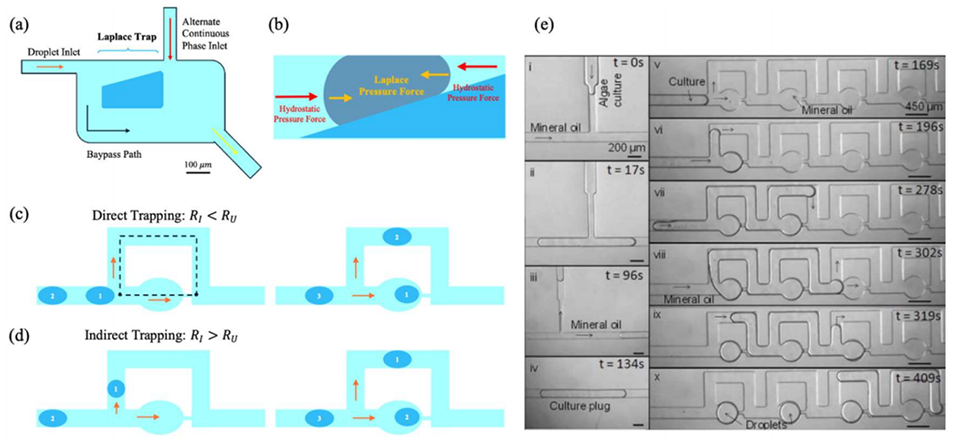
图 5:压力变化与旁路通道的捕获过程。(a)Laplace 陷阱的主要特征;(b)力平衡示意图(液滴界面的 Laplace 压力(黄色)与微通道中连续相的静水压力(红色),箭头大小表示力的大小);(c)直接捕获法(Rl <Ru)的液滴捕获;(d)间接捕获法(Rl> Ru)的液滴捕获;(e)时间标记图像展示单个藻类培养栓(i–iv)和液滴阵列(v–x)的形成过程。
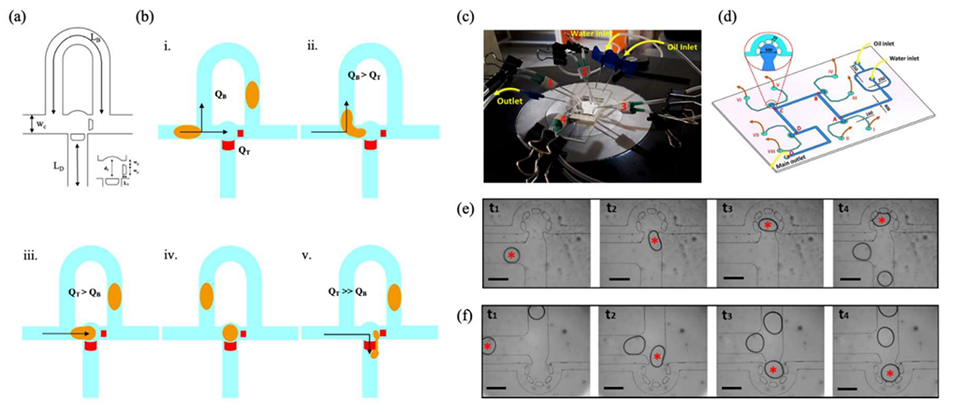
图 6:流体动力学阻力变化的捕获过程。(a)用于捕获设计的微通道尺寸;(b)液滴捕获场景:(i)流速 QB 和 QT;(ii)液滴进入旁路通道而非陷阱;(iii,iv)液滴进入陷阱;(v)液滴进入陷阱并推入稀释流;(c)实验装置(PVC 管上的长尾夹用于开关与陷阱连接的侧通道);(d)通过流体动力学阻力调节实现按需液滴捕获的微流控装置示意图(液滴经流动聚焦结生成,打开对应长尾夹时被导入侧陷阱,关闭则固定);(e,f)微流控装置中不同陷阱按需捕获液滴的序列图像(红色星号标记被捕获液滴)。
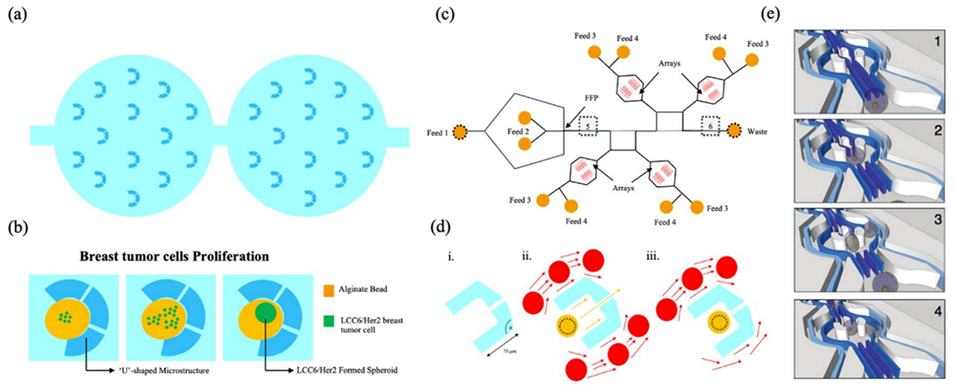
图 7:U 型微结构的捕获过程。(a)微流控芯片微筛中捕获的藻酸盐珠(每个珠加载时含约 100 个细胞);(b)LCC6/Her2 乳腺癌细胞在藻酸盐珠中增殖形成多细胞球体的示意图;(c)用于液滴生成、捕获、培养、监测和释放的四陷阱阵列微流控装置示意图(液滴在流动聚焦点形成,稳定后经 Feed 3 抽去油相导入陷阱阵列);(d)液滴捕获阵列:(i)单个陷阱设计(尾部设有 110°角,提升液滴回收率至 90% 以上);(ii)液滴接近陷阱的流动剖面;(iii)液滴被捕获时的流动剖面(其他液滴绕过已占用陷阱,确保单液滴捕获);(e)时间分辨的捕获机制草图(深蓝色表示通道中部流速快,浅蓝色表示壁面流速慢)。
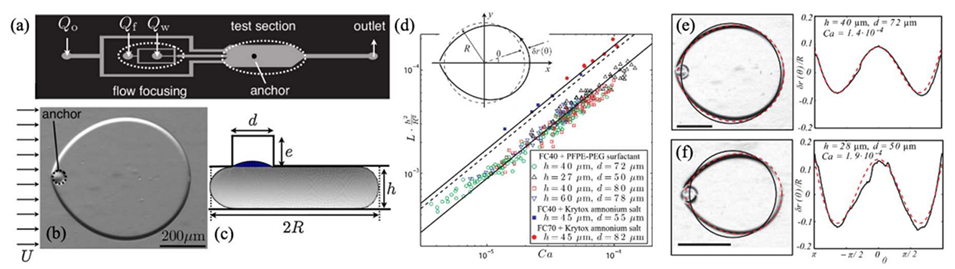
图 8:轨道与锚定系统的捕获。(a)含流动聚焦器(生成油包水)和单个锚定装置的微通道示意图;(b)锚定液滴在外部平均流 U 作用下保持位置的俯视图;(c)微通道中锚定液滴(外半径 R)的 Surface Evolver 渲染图(锚定装置直径 d、深度 e,通道高度 h);(d)静态半径 R 下变形 δr (θ) 的极坐标草图;(e,f)左侧:油流中锚定液滴变形的图像(虚线为方程 11 的预测,实线为半径 R 的等效圆);右侧:显微镜图像提取的 δr (θ)/R(实线)与方程 11 的理论曲线(虚线,以 9 为系数)的对比。
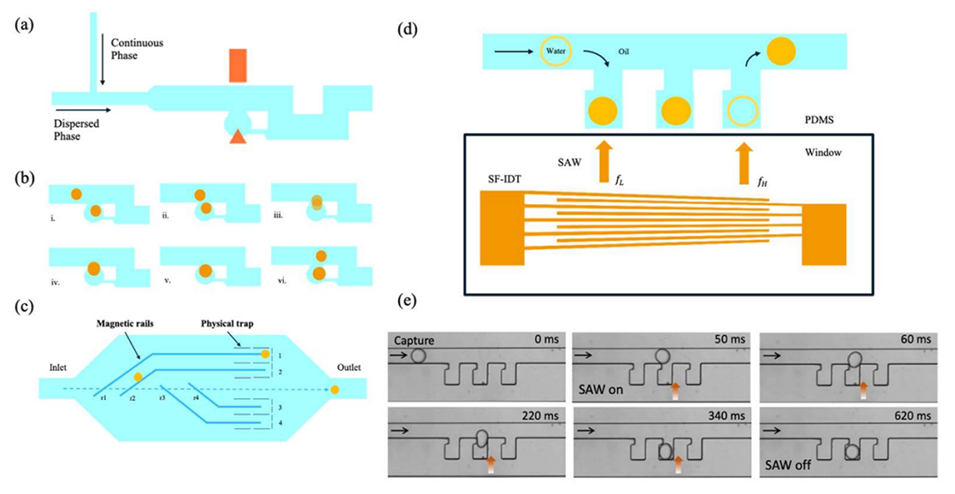
图 9:主动捕获技术示例。(a)含通道、微孔和电极的微流控平台结构示意图(阴影区域为嵌入的电极);(b)捕获液滴与经过的液滴的融合过程(i–iii)、融合液滴再次被捕获(iv–vi)、关闭电场后无融合发生(6);(c)结合磁轨道(蓝色)和物理陷阱(灰色)的微流控装置示意图(磁液滴(橙色)在磁场激活时沿轨道进入陷阱,磁场关闭后仍被保留,可实现精准按需路径规划、捕获、释放和融合);(d)声微流控液滴捕获释放装置示意图(含 PDMS 通道和带斜叉指换能器(SF-IDT)的压电基底,通过声辐射力(ARF)捕获/释放液滴,调谐驱动频率可调整 SAW 光束位置);(e)SF-IDT 的液滴捕获释放实验图像(橙色箭头表示 SAW 激活)。
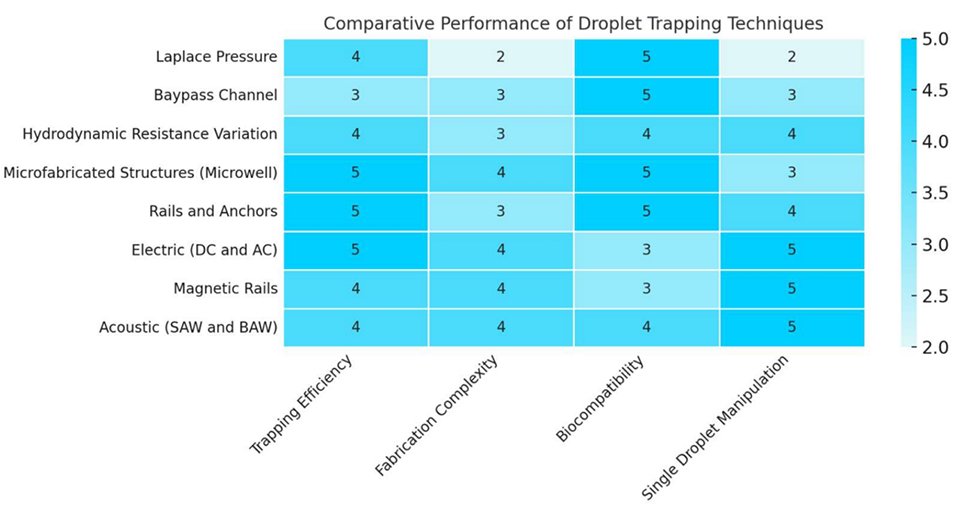
图 10:液滴捕获技术比较评估。基于四个评估标准(捕获效率、制造复杂度、生物相容性、单液滴操控能力)对液滴捕获技术评分(1 分最差至 5 分最优),对比被动方法(Laplace 压力陷阱、旁路通道结构、流体动力学阻力调节、微孔结构)和主动技术(电(DC 和 AC)、磁轨道、声(SAW 和 BAW)系统),反映代表性研究的综合性能。
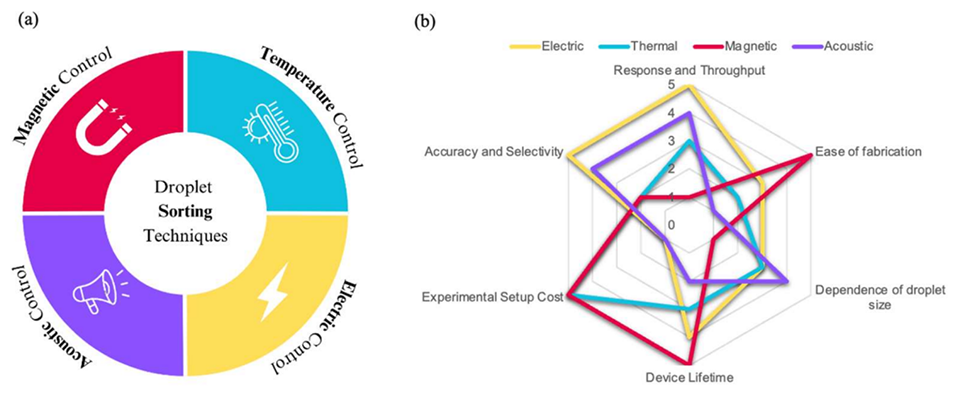
图 11:主动分选技术示例。(a)主要分选策略及其分类概述;(b)基于六个性能指标(i)响应时间与通量、(ii)制造难易度、(iii)设备成本、(iv)准确性与选择性、(v)装置寿命、(vi)对液滴大小的依赖性,对不同液滴分选方法的评分对比(1 分至 5 分,5 分为最优)。
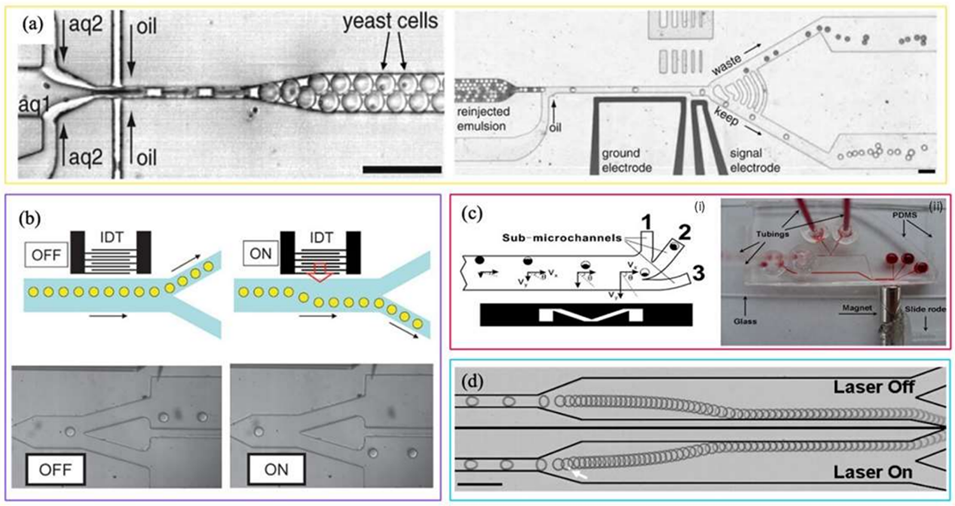
图 12:主动分选技术示例。(a)超高通量微流控筛选平台的模块;(b)混合 PDMS-SAW 芯片示意图:液滴生成单元和与 SAW 装置耦合的分支 PDMS 通道(SAW 关闭时液滴因低流阻流入上通道,开启时 IDT 的声流将液滴导向下通道);(c)(i)液滴速度分量示意图(Vx 为 x 方向速度,Vy 为 y 方向速度);(ii)微通道中超顺磁液滴偏转的示意图(磁力与阻力沿 y 轴反向作用,靠近磁铁处更强的磁力使纳米颗粒向下移动,形成液滴顶部白色(水)、底部橙色(纳米颗粒)的分层);(d)局部热毛细驱动的液滴切换连续帧叠加图(箭头表示通过水-染料溶液的荧光观察到的激光位置)。
论文链接:https://doi.org/10.3390/bios15060345
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














