均匀微液滴在药物递送、生物分析、材料合成等领域应用广泛,其精准制备对实验结果与技术转化至关重要。传统微流控液滴生成方法多依赖复杂设备控制两相流体剪切力,需精确调节流速、粘度等参数,操作繁琐且设备成本高,限制了其普及性。
同时,现有方法常需表面活性剂稳定液滴,可能干扰生物分子活性或细胞功能,在生物医学领域应用受限。因此,开发无需复杂设备、无需表面活性剂且能稳定生成均匀微液滴的简便方法,成为该领域亟待解决的关键问题。

近期,有研究人员开发了一种利用聚二甲基硅氧烷(PDMS)微流控通道的脱水驱动相分离特性,一步生成均匀细胞大小微液滴的简便方法,该方法通过PDMS的吸水作用使聚乙二醇(PEG)和葡聚糖(DEX)的均相混合物发生相分离,可成功包裹多种生物材料。相关研究以“A Facile Platform for One‐Step Generation of Uniform Microdroplets through Dehydration‐Driven Phase Separation in Microfluidics”为题目,发表在期刊《Small Methods》上。
本文要点:
1、本文介绍了一种利用聚二甲基硅氧烷(PDMS)微流控芯片的脱水驱动相分离特性,一步生成均匀微液滴的新方法。
2、该方法将低于相分离临界浓度的聚乙二醇(PEG)和葡聚糖(DEX)均相混合物注入PDMS微通道,借助PDMS固有的吸水特性,使混合液逐渐脱水,聚合物浓度升高,从而引发微相分离,在富PEG的连续相中生成线性排列的富DEX液滴。
3、延时观察表明,这种由脱水驱动的过程是渐进且可控的,能够产生尺寸均匀的液滴。
4、此外,该方法能成功包裹大肠杆菌、DNA、抗体和纳米颗粒等多种物质,在药物递送、人工细胞工程等领域具有广泛应用前景。
5、实验还探究了不同浓度混合溶液的相行为、通道尺寸对液滴大小的影响,通过数值建模分析了液滴形成机制,并讨论了该方法的优势(如无需复杂设备和精确流量控制、生物相容性好等)、稳定性及潜在应用拓展方向。
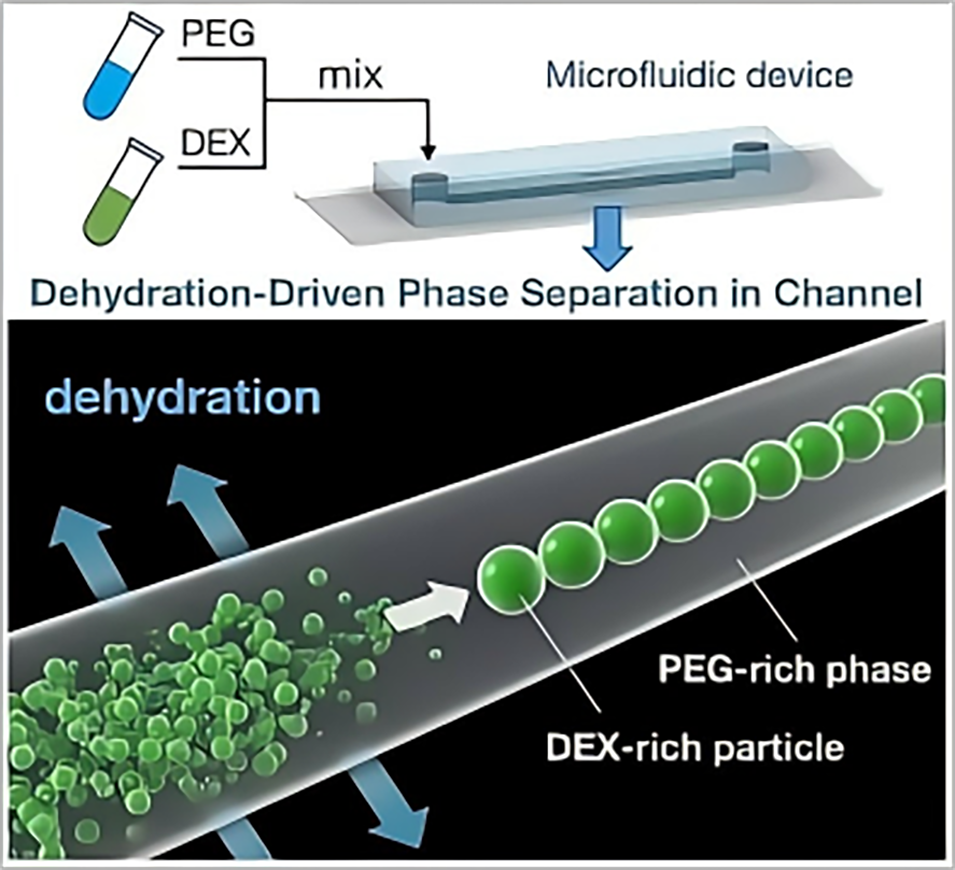
液滴在微流控芯片中的生成机制主要基于PDMS微通道的脱水驱动相分离作用,具体过程如下:
1、初始溶液注入:将低于相分离临界浓度的聚乙二醇(PEG)和葡聚糖(DEX)均相混合物注入PDMS微通道。此时,PEG和DEX均匀分散在溶液中,整个体系处于热力学稳定的均一状态,尚未发生相分离。
2、PDMS脱水作用:PDMS因固有吸水特性逐渐吸收混合溶液中的水分,导致聚合物(PEG和DEX)浓度不断升高。这类似于在一个封闭环境中,水分通过PDMS材料的孔隙逐渐散失,使得聚合物在剩余溶液中的占比不断增加。
3、相分离触发:随着脱水的持续进行,聚合物浓度逐渐超过相分离的临界浓度。当浓度越过相图中的双结点线时,体系的热力学稳定性被打破,微相分离过程开始发生。原本均匀分散的分子开始自发聚集,形成不同的相区。
4、均匀液滴形成:相分离一旦发生,体系会自发地进行能量最低化调整。在微通道的限制作用下,富含DEX的区域逐渐聚集形成液滴,这些液滴呈线性排列,分散在富含PEG的连续相中。由于通道尺寸的均匀性以及脱水过程的渐进性和可控性,液滴能够均匀成核和生长。
该方法无需外部驱动力和复杂的流量控制,依靠PDMS的吸水特性和体系自身的相分离趋势实现液滴的自组织生成。为深入解析这一原理,研究团队通过数值模拟与荧光显微镜实时观测等技术,对液滴生成过程的关键特征(如脱水速率、相分离时机、液滴尺寸均匀性及线性排列规律)进行了验证,结果与理论机制高度吻合。
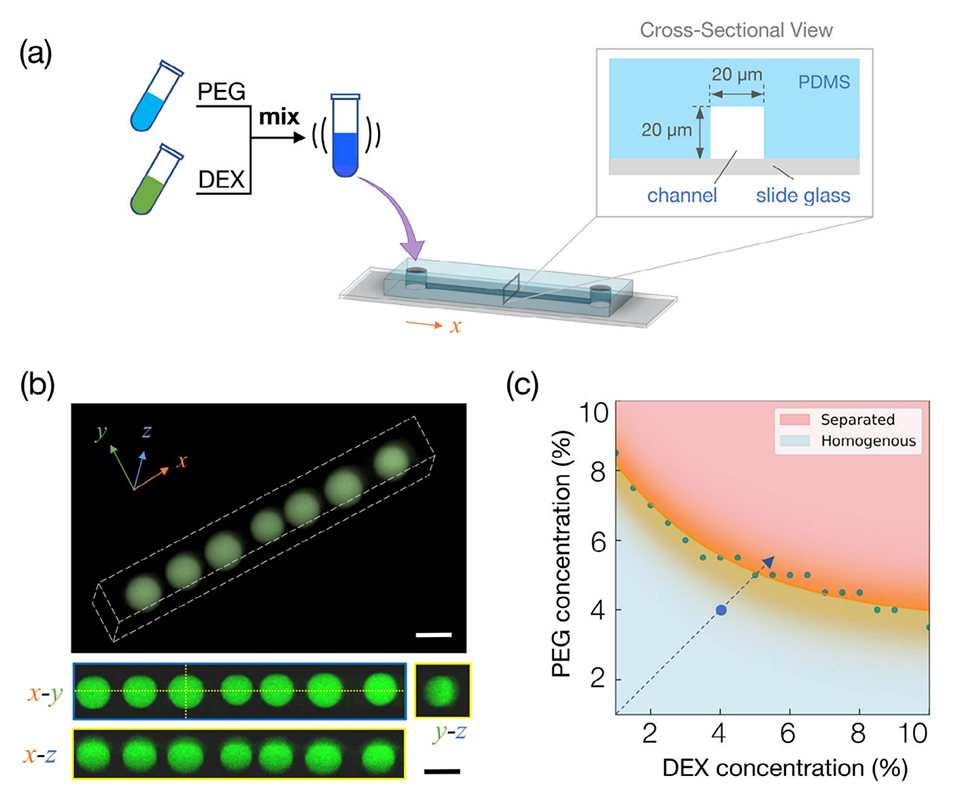
图 1. 在通道材料 PDMS 固有吸水作用下,微流控通道内线性排列的水包水微液滴的自组织形成。a) 实验装置示意图。将 4%:4%(w/v)的聚乙二醇/葡聚糖(PEG/DEX)均相水溶液注入线性微流控通道(插图:通道几何结构,宽度和高度均为 20μm,长度为 30mm)。b) 沿微流控通道形成的富葡聚糖液滴的共聚焦显微镜图像。顶部图像为液滴形成后 20μm 微流控通道的 3D 重建图,虚线标记微通道边界;底部图像为沿 x-z 和 y-z 平面(黄色虚线)的通道横截面,显示液滴呈均匀球形(直径≈20μm)。通过在 PEG/DEX 溶液中添加异硫氰酸荧光素标记的葡聚糖(FITC-DEX)实现可视化。比例尺为 20μm。c) PEG/DEX 两水相系统的相图。橙色曲线为基于先前文献(Tsumoto 等人,2015)的双结点边界,绿色数据点源自该文献,蓝色圆点表示本微流控实验中使用的初始组分(4% PEG、4% DEX),蓝色虚线示意脱水导致聚合物浓度升高并最终引发相分离的过程。

图 2. 浓度依赖性和自发液滴形成的显微镜观察。a) 机械搅拌后静置条件下 PEG/DEX 水溶液的相行为。5%:5%(w/v)的 PEG/DEX 溶液发生相分离(i),而 4%:4%(w/v)的溶液未观察到明显分离(ii)。每个比色皿宽度为 1cm。b) 自发形成液滴的显微镜图像。明场图像显示注入 4%:4%(w/v)PEG/DEX 混合物(i)和 5%:5%(w/v)PEG/DEX 混合物(ii)(均用纯水配制)的结果。4%:4% 混合物中可观察到尺寸均一的富葡聚糖液滴(直径≈20μm)。图像拍摄于注入机械混合溶液后 15 分钟。c) 4%:4%(w/v)PEG/DEX 混合物在微流控通道中缓慢流动(≈5μm・min-1)时的延时荧光显微镜图像,时间点为注入后 Δt=2.5、4、6、8、10 和 14 分钟。液滴随时间推移逐渐形成,最终呈现单排尺寸均一的液滴(直径≈20μm)。通过在 PEG/DEX 溶液中添加 FITC-DEX 实现可视化。比例尺为 20μm。所示图像对应微通道的中间部分。
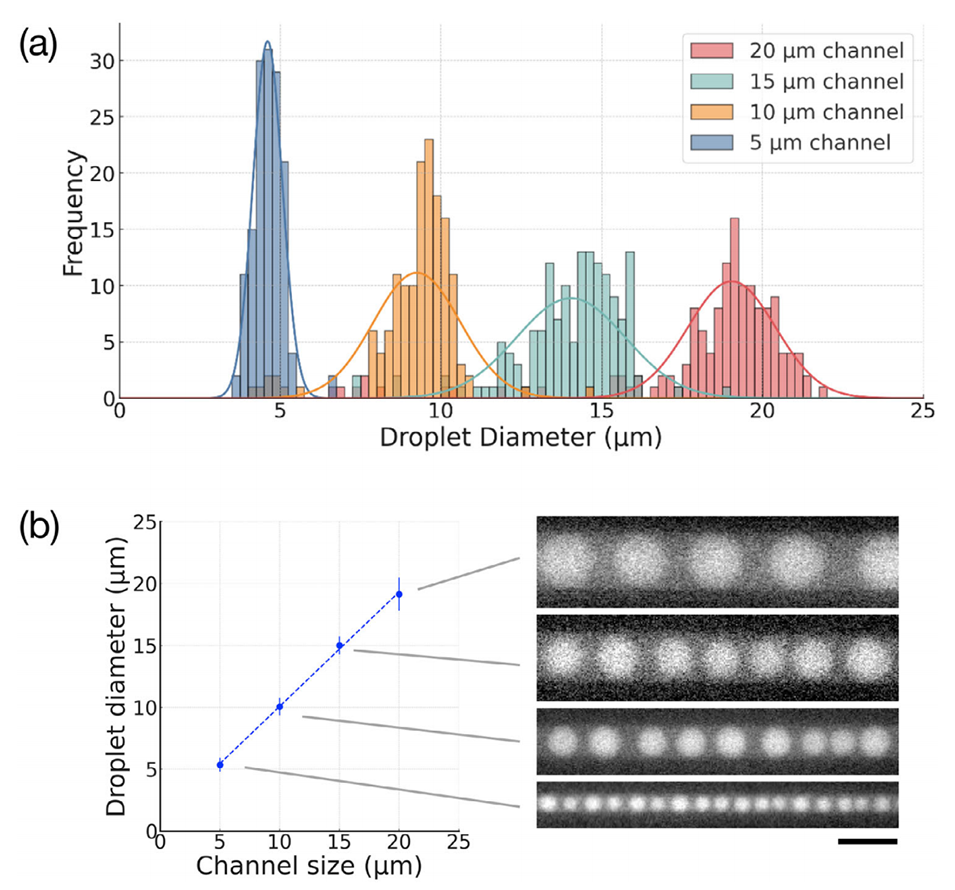
图 3. 通道尺寸对液滴直径的调控。a) 5、10、15 和 20μm 宽的 PDMS 微通道中生成液滴的直径直方图及相应的高斯拟合。每种条件下采用特定的 PEG/DEX 浓度(分别为 1%、2%、3% 和 4%)以优化相分离时间。b) 通道尺寸与液滴平均直径的关系。误差棒表示标准差(每个条件 n=140 个液滴)。右侧为各通道中液滴的代表性荧光图像。比例尺为 20μm。
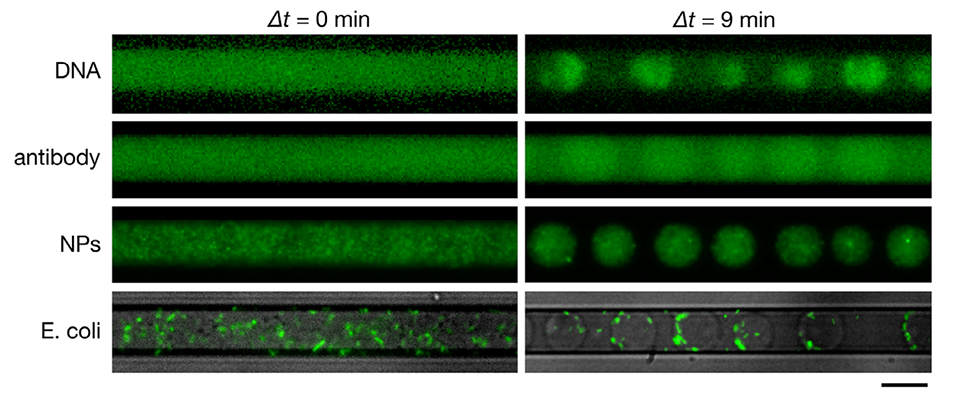
图 4. 富葡聚糖液滴对多种物质的包裹。微流控通道中由 4%:4%(w/v)PEG/DEX 混合物(用 1×PBS 配制)形成的富葡聚糖液滴的荧光显微镜图像,液滴内包裹的物质包括:经 YOYO-1 染色的 T4 噬菌体 DNA(166kbp,≈56μm)、Alexa Fluor 488 标记的抗小鼠 IgG 抗体、200nm 羧基修饰荧光聚苯乙烯微球(纳米颗粒,NPs),以及表达绿色荧光蛋白(GFP)的大肠杆菌(明场与荧光图像叠加)。左列和右列图像分别为 PEG/DEX 混合物注入后即刻的初始状态,以及注入后 9 分钟液滴分离的状态。比例尺为 20μm。
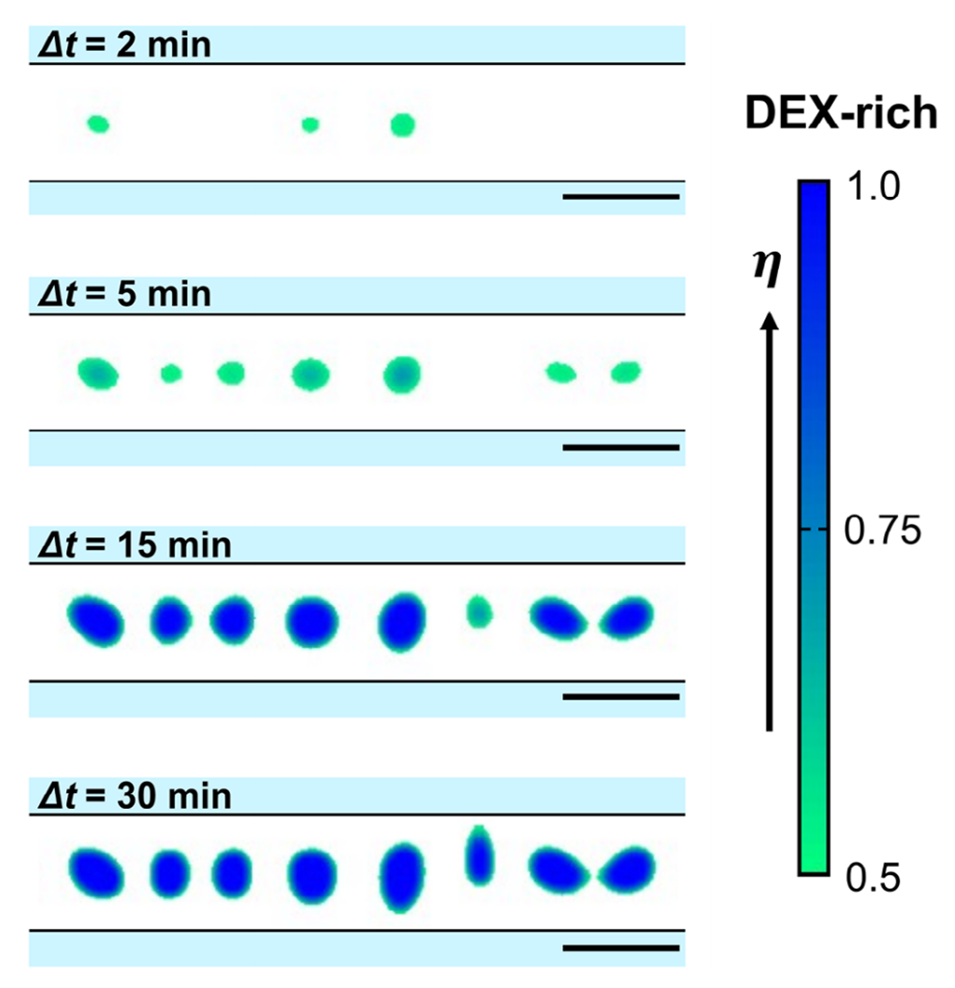
图 5. 微通道内 PEG/DEX 混合物相分离时间演化的数值模拟结果(Δt=2、5、15 和 30 分钟)。数值计算基于模型方程(方程 1-3)进行。实验中微相分离似乎在溶液注入通道的过程中发生,因此数值计算的时间参数设为 Δt = t - 800s,其中 t=0 对应模拟起始时间。颜色图表示 PEG 与 DEX 的比例(η=[0.5,1]),η=1.0 对应 100% DEX(不含 PEG)。比例尺为 20μm。
论文链接:https://doi.org/10.1002/smtd.202500387
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














