传统微流控芯片通常依靠笨重的外部泵或电源来驱动流体流动,这限制了其便携性及在现场应用中的适用性。相比之下,离心微流控技术借助芯片旋转产生的离心力来驱动流体操纵,能够实现阀门控制、混合、分配和定量等自动化过程。这些功能在生化分析等领域有着广泛的应用。离心微流控系统操作简便、自动化程度高,且能够进行并行检测,可提供从样本到结果的一站式解决方案,从而为现场生化分析提供了可靠的技术支持。

近期,集美大学杨绍辉教授、杜志昌副教授等人发表综述,聚焦离心微流控技术,介绍了其发展、意义及基本力学原理,分类阐述了该技术实现的流体控制功能,并深入分析了其在现场生化分析、材料制备、分离等应用领域的最新进展。此外,还探讨了该技术的优缺点、芯片制造策略及未来发展趋势。相关研究成果以“Research advances in centrifugal microfluidics and its applications”为题发表于期刊《Microchemical Journal》。
本文要点:
1、本文综述了离心微流控技术的发展和意义,概述了所涉及的基本力学原理,并对该技术实现的流体控制功能进行了分类。
2、深入分析了该技术在现场生化分析(例如病原体检测)、材料制备(例如纳米颗粒合成)和分离(例如微塑料分离)等应用领域的最新进展。
3、最后,讨论了离心微流控技术的优势和局限性,总结了芯片的制造技术,并展望了其未来发展趋势(如生物降解材料、自动化检测和应用领域的拓展等)。
一张图读懂全文

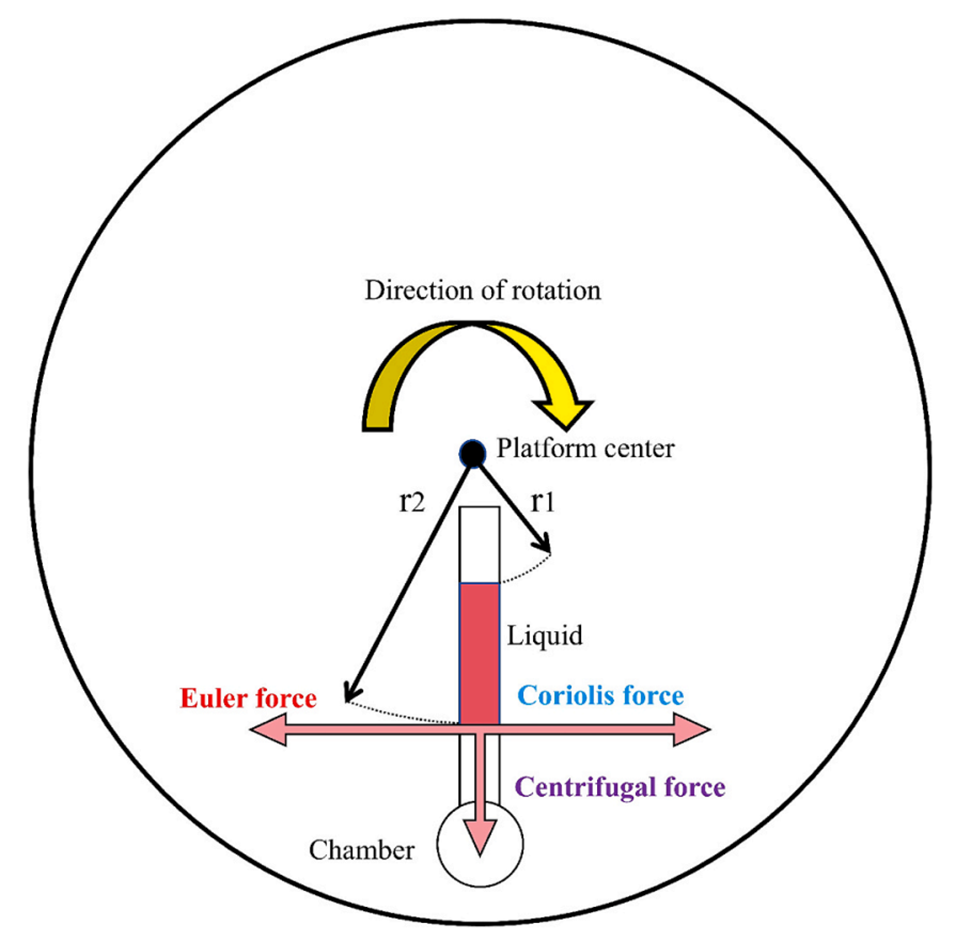
图 1. 离心微流控芯片的典型圆盘结构及作用于液体的三种虚拟力:离心力、科里奥利力和欧拉力。
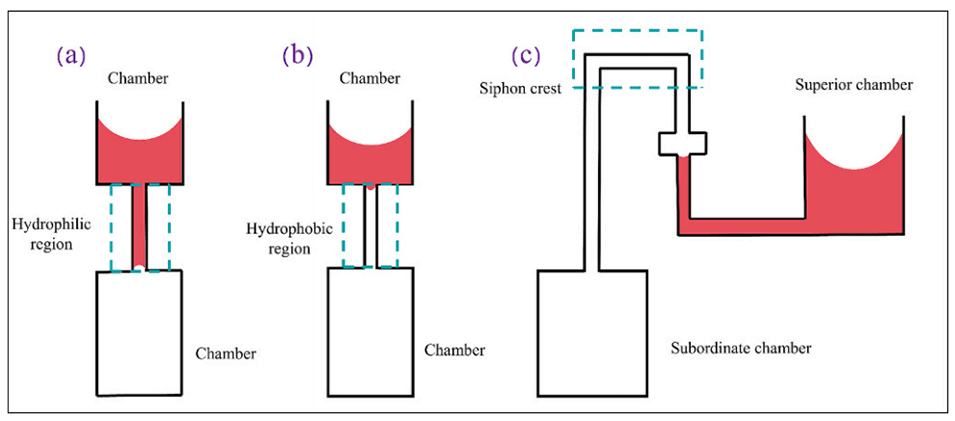
图 2. 三种常见的被动阀:(a)毛细管阀;(b)疏水阀;(c)虹吸阀。
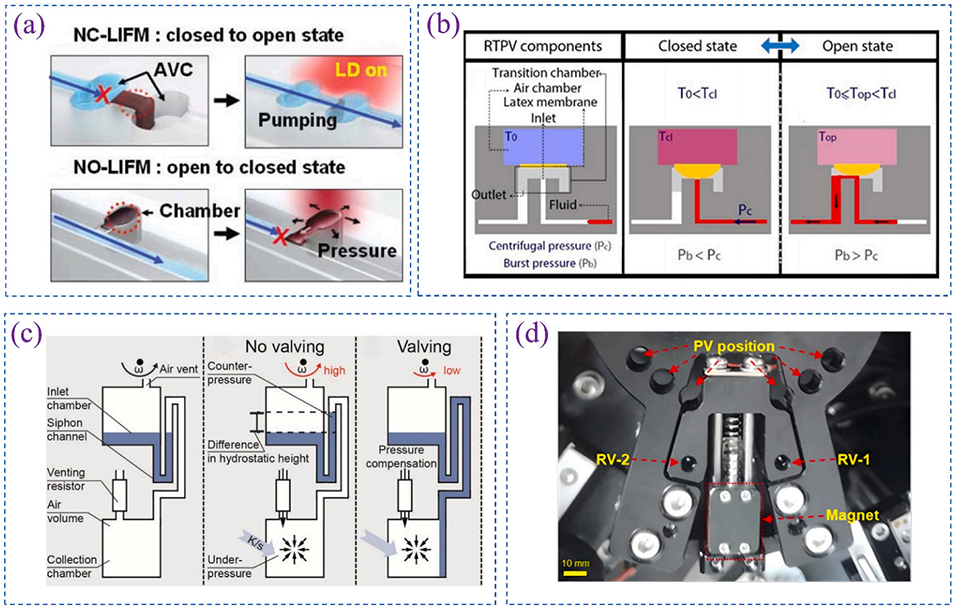
图 3. 四种不同类型的主动阀:(a)石蜡阀;(b)热气动阀;(c)温度变化率驱动阀;(d)集成离心穿刺阀、可重复使用阀及磁珠控制阀等。
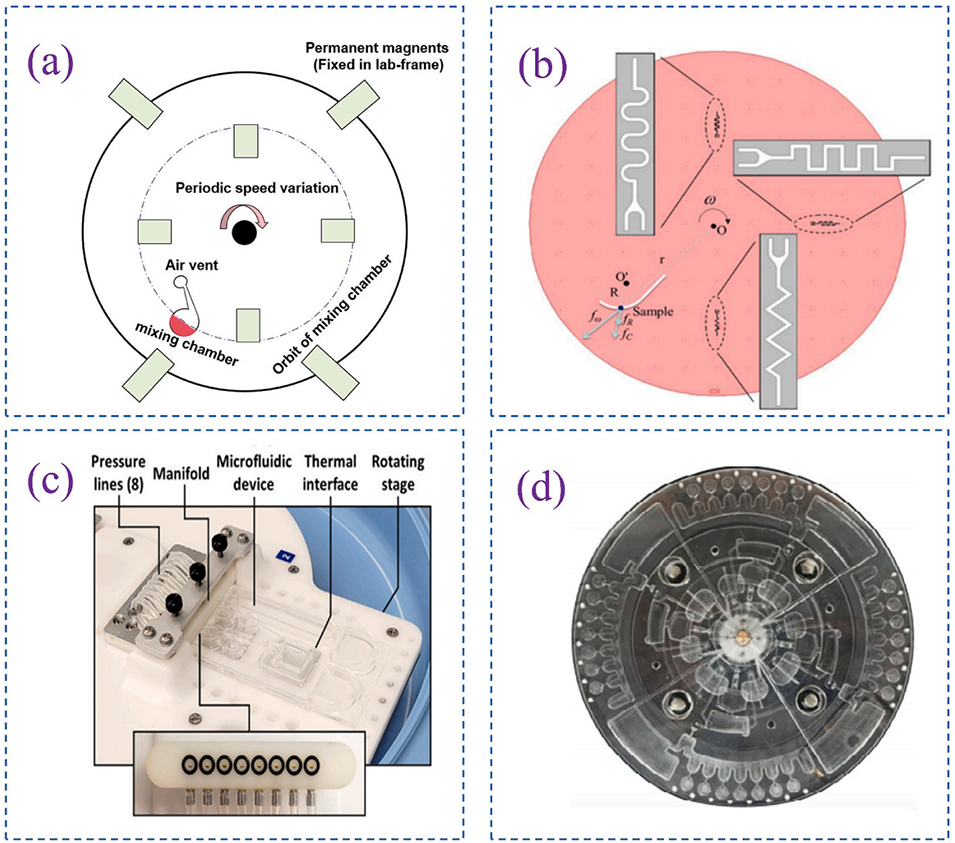
图 4. 四种快速混合方法:(a)通过周期性改变转速产生连续角加速度,进而生成欧拉力;(b)研究方形、弯曲和锯齿形通道的混合性能;(c)通过驱动压力在底部产生气泡,实现芯片主反应腔体内的液体混合;(d)结合离心力和电磁场控制,使液体与磁珠混合。
图4展示的四种混合方法在效率和兼容性上有何侧重?如何匹配不同生化反应需求?
四种混合方法的设计围绕提高微尺度下的混合效率(克服层流限制),但适用场景不同:
欧拉力混合(图a):通过转速周期性变化产生湍流,适合快速混合(秒级)且无需额外结构,兼容大多数液体样本,但可能因剧烈扰动破坏敏感生物样本(如活细胞)。
通道几何结构优化(图b):方形通道通过科里奥利力增强横向对流,混合效率优于弯曲或锯齿形通道,适合对剪切力敏感的反应(如酶促反应),但对通道加工精度要求高。
气泡扰动混合(图c):通过压力产生气泡搅拌,适合高粘度样本(如血液),但气泡可能干扰光学检测(如荧光信号),需搭配脱气设计。
磁珠辅助混合(图d):结合离心力与电磁场,磁珠的机械搅拌可强化混合,同时实现目标物(如核酸)的捕获,适合集成化检测(如 CRISPR-Cas13a 平台),但需额外磁场设备。
简言之,常规生化反应可选用欧拉力或通道几何法,高粘度样本适合气泡法,而需同步捕获目标物时则选择磁珠法。
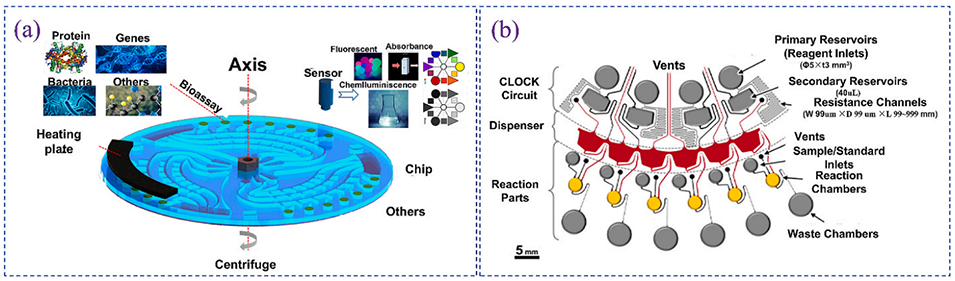
图 5. 用于高通量试剂分配的离心微流控芯片:(a)可实现多种试剂快速分配的床旁检测用离心微流控芯片;(b)离心驱动的多重酶联免疫吸附测定(ELISA)芯片,可自动分配多个样本。
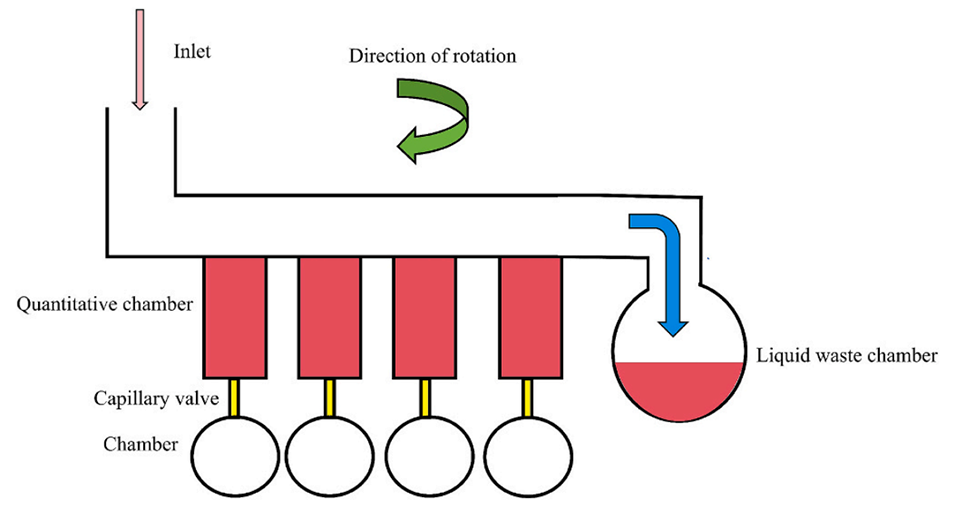
图 6. 典型的离心定量结构。
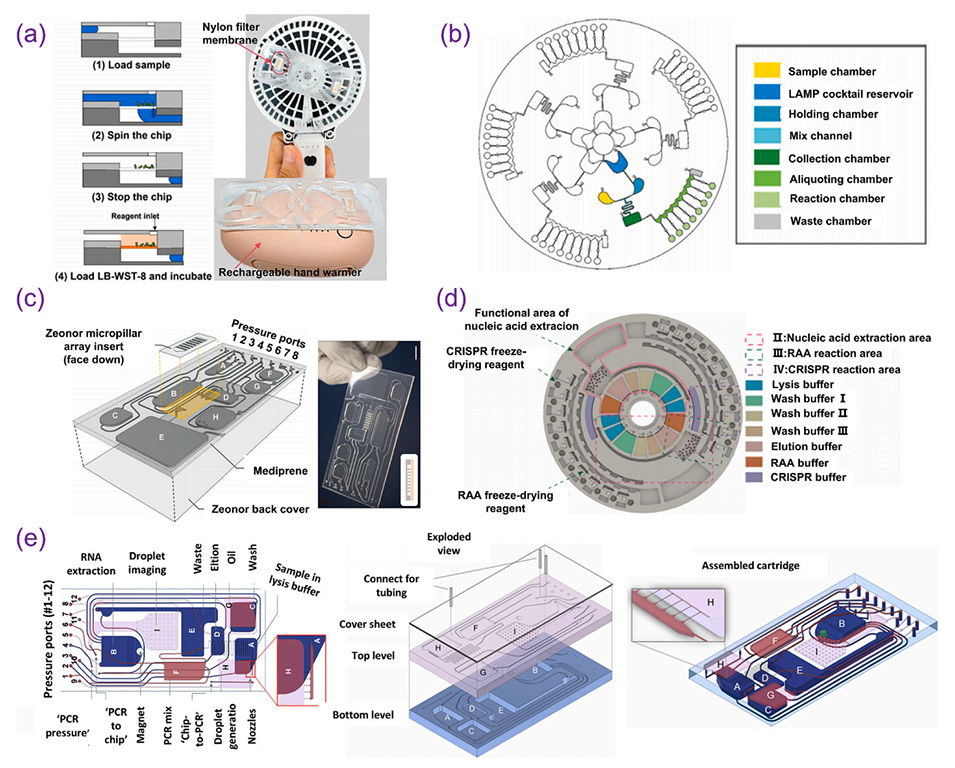
图 7. 离心微流控技术在生化检测中的应用:(a)用于水体细菌检测的离心微流控芯片;(b)用于五种高危型人乳头瘤病毒基因诊断的集成离心微流控系统;(c)用于食源性病原体识别与检测的离心微流控检测平台;(d)基于 CRISPR-Cas13a 的全集成离心微流控多重核酸检测平台;(e)用于样本到结果的病毒载量定量分析的集成离心微流控液滴数字 PCR(ddPCR)平台。
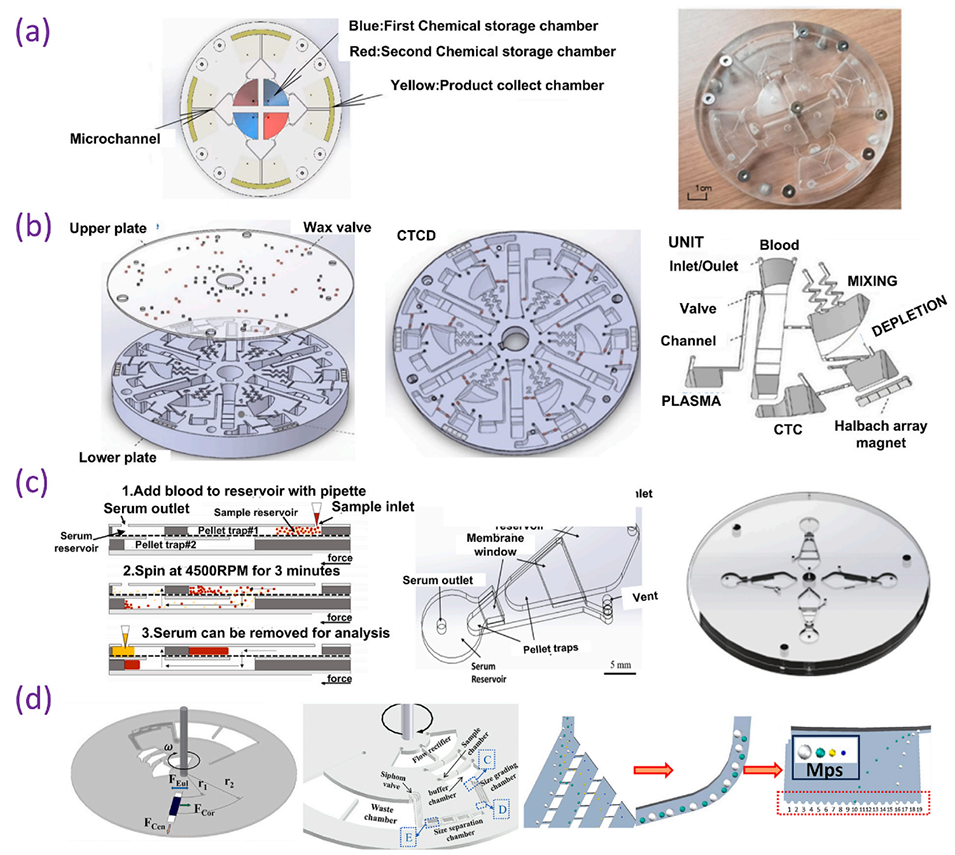
图 8. 用于材料合成与分离的离心微流控芯片:(a)利用离心微流控技术合成三氧化二镍纳米颗粒的新方法;(b)用于循环肿瘤细胞(CTCs)高效分离和全自动分析的连续离心微流控系统(CCM);(c)用于从全血中分离血清并保留两亲性生物标志物的新型离心微流控芯片;(d)用于微塑料(MPs)分离和检测的多级离心微流控芯片。
论文链接:https://doi.org/10.1016/j.microc.2025.113589
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














