尺寸大于400μm且缺乏微血管网络的组织无法在体外长时间存活。微流控技术的发展为体外构建微血管模型提供了一种高效的研究工具。然而,传统的单层微流控芯片面临空间布局的限制,无法在单个芯片内提供多样化的流体环境。

近期,上海大学机电工程与自动化学院岳涛副教授、刘娜副教授以及未来技术学院王越等人开发了一种基于聚碳酸酯多孔膜的三层微流控芯片,通过在单芯片上设计三角形、矩形和倒三角形组织腔室,实现了多种剪切应力环境下的血管化组织培养。该芯片成功构建了可稳定维持超10天的微血管网络,并通过灌注实验与流体模拟验证了间隙流方向和剪切应力对血管生长的关键调控作用。相关研究以“A Vascularized Multilayer Chip Reveals Shear Stress-Induced Angiogenesis in Diverse Fluid Conditions”为题目,发表在期刊《Cyborg and Bionic Systems》上。
本文要点:
1、本研究开发了一种新型三层微流控芯片,该芯片采用聚碳酸酯(PC)多孔膜分离培养液通道与组织腔,具有可灵活设计的多组织腔。
2、PC多孔膜在垂直方向上充当毛细管,可实现精确的水凝胶图案化,并成功构建适合微血管组织生长的微流体环境。
3、该芯片能在单个芯片上构建三角形、矩形和倒三角形等不同形状的微血管网络并培养超过10天,且培养12天的微血管网络成功灌注70kDa荧光素异硫氰酸酯,表明其具有良好的屏障特性。
4、通过COMSOL模拟证明了组织腔形状与剪切应力的相关性,血管化实验初步验证了组织液流动方向及剪切应力对微血管生长的重要影响。
5、该设计适用于在单个微流控芯片上培养多种血管化器官组织,以及研究不同流体因素对微血管生长的影响,为生物医学工程提供了平台基础。
该三层芯片的核心创新之一是采用聚碳酸酯(PC)多孔膜分离培养介质通道与组织腔,其材料与孔径选择直接影响芯片功能。从技术角度看,需满足三个关键要求:
物质交换效率:本研究选择20μm孔径的PC膜,既保证了培养介质中的营养成分、生长因子能通过孔隙进入组织腔(支持血管细胞存活),又能通过膜的毛细作用限制水凝胶泄漏(避免堵塞通道)。
力学兼容性:PC材料具有一定刚性,与PDMS(聚二甲基硅氧烷)基底经氧等离子体处理后可稳定键合,确保芯片密封性。
生理模拟相关性:孔隙尺寸需匹配微血管生长的空间需求(如内皮细胞迁移穿过膜的能力),20μm孔径既允许细胞垂直迁移(如图4B所示内皮细胞通过膜向介质通道生长),又避免了过大孔隙导致的水凝胶流失。
三层结构通过“介质通道-多孔膜-组织腔”的垂直分离,解决了传统芯片的核心局限:
流体参数调控的灵活性:单层芯片中介质通道与组织腔同层,剪切应力仅能通过水平方向的微柱结构传递,方向单一;三层结构中,垂直方向的多孔膜允许介质同时产生水平间质流(组织腔内)和垂直渗透(穿过膜),更接近体内血管的复杂流体微环境。
模拟精度提升:传统双层芯片虽分离通道与组织腔,但压力差固定,难以灵活调整。而三层结构通过调整介质入口/出口的高度差,可精确调控压力梯度,结合COMSOL的3D建模,实现了流体参数(流速、剪切应力)的高精度模拟。
实验可重复性增强:单层芯片注入细胞-水凝胶混合物时,易通过微柱间隙泄漏至介质通道;三层结构中,多孔膜的毛细作用可稳定限制水凝胶在组织腔内,减少实验误差,提升数据可重现性。
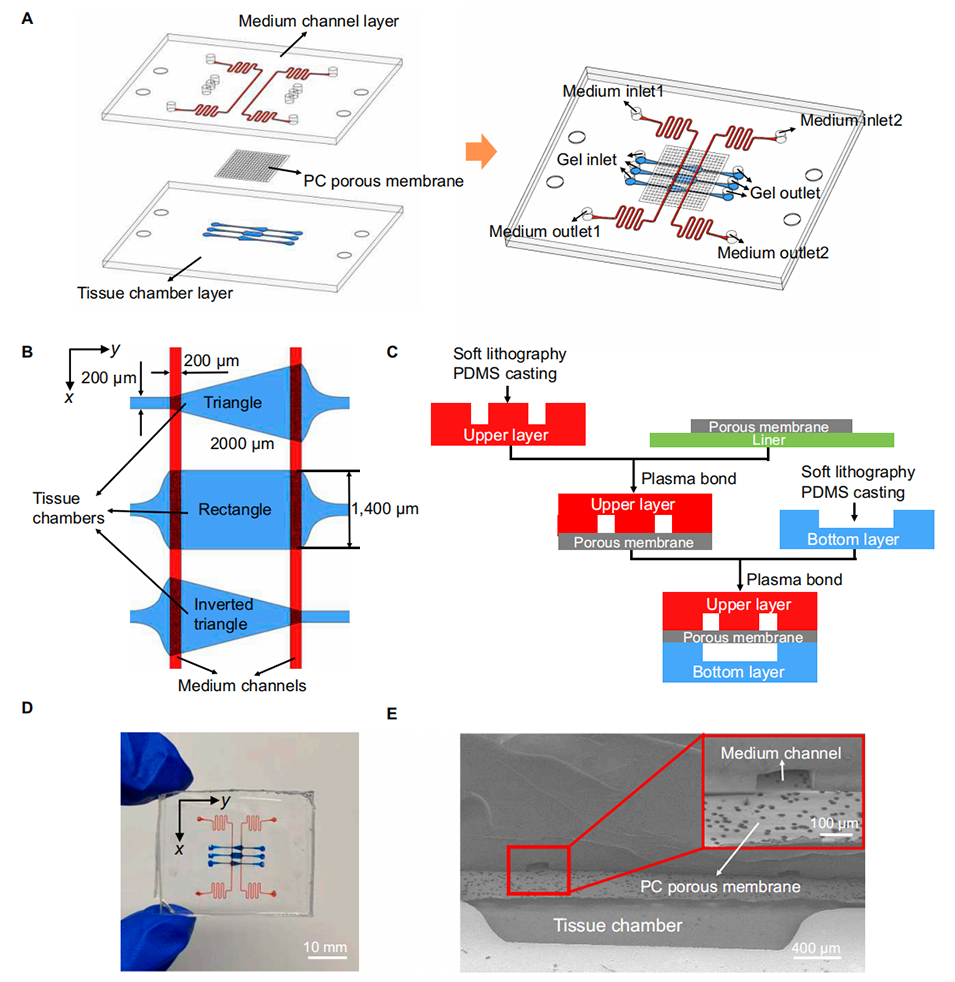
图 1. 多层微流控芯片的设计与制作。(A)多层微流控芯片的分解图与组合图。(B)培养液通道和组织腔的详细尺寸图。(C)通过多次键合制作的多层微流控芯片。(D)多层微流控芯片的实物图,其中红色表示培养液通道,蓝色表示组织腔。(E)培养液通道-多孔膜-组织腔的扫描电子显微镜(SEM)图像。
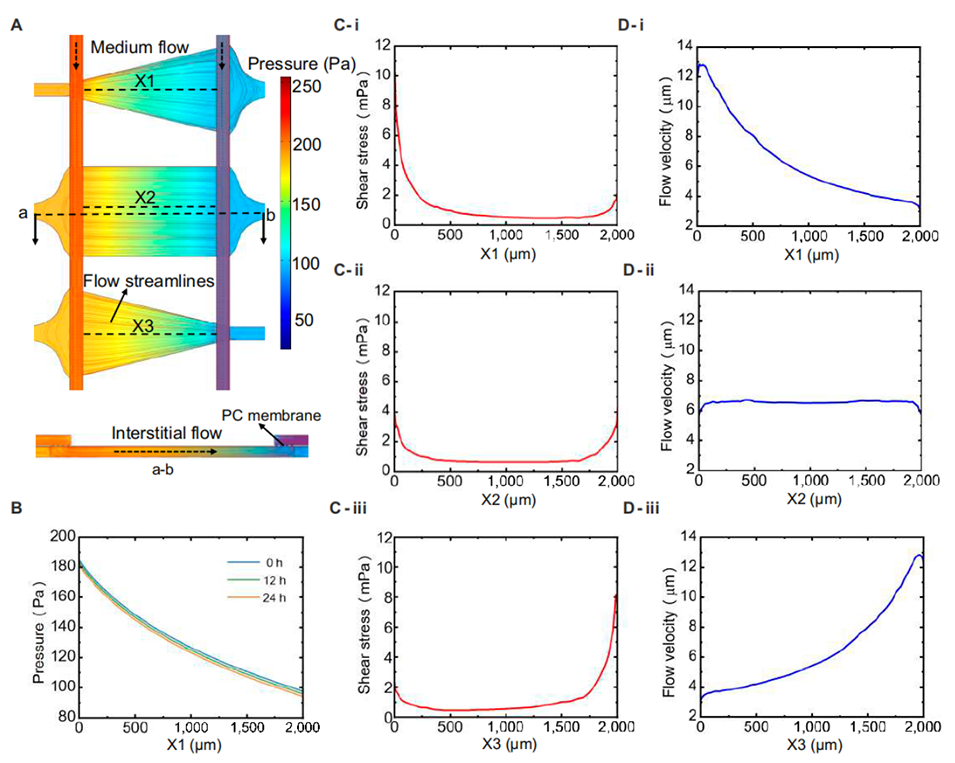
图 2. 组织腔内流体分布的模拟。(A)三种形状组织腔(三角形、矩形和倒三角形组织腔)的压力梯度分布和流动方向。(B)流体交换期间(t=0、12 和 24 小时)的压力梯度分布模拟结果。(C)沿(i)X1、(ii)X2 和(iii)X3 剖面线的剪切应力模拟结果。(D)沿(i)X1、(ii)X2 和(iii)X3 剖面线的流速模拟结果。
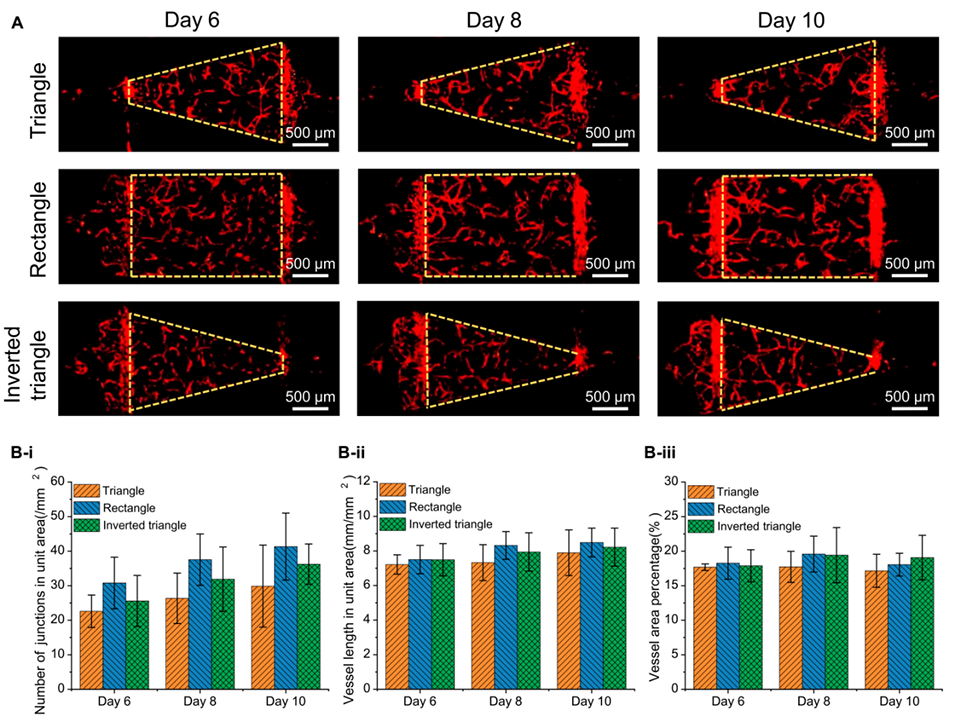
图 3. 多层微流控芯片中多形状微血管网络的生成。(A)在三种形状的组织腔(三角形、矩形和倒三角形组织腔)中,从第 6 天到第 10 天生成的微血管网络。(B)三种腔室在第 6 天、第 8 天和第 10 天的(i)单位面积连接点数、(ii)单位面积血管长度和(iii)血管面积百分比的定量分析(平均值±标准差,n=4)。
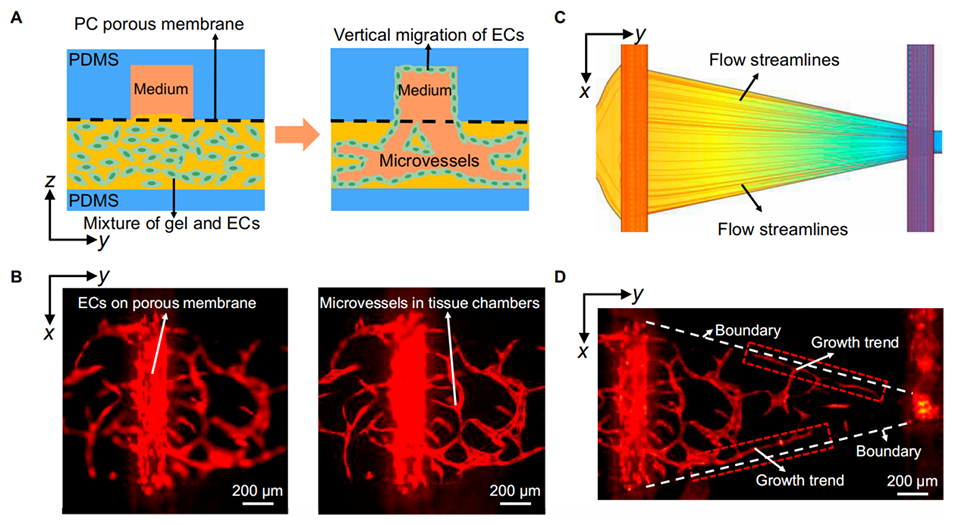
图 4. 流体刺激导致内皮细胞垂直迁移并影响微血管生长方向。(A)内皮细胞垂直迁移的示意图。(B)在培养液生长因子梯度刺激下,内皮细胞垂直迁移并生长到培养通道中。(C)倒三角形组织腔的模拟流线图。(D)微血管网络在流线影响下沿组织腔边界生长。
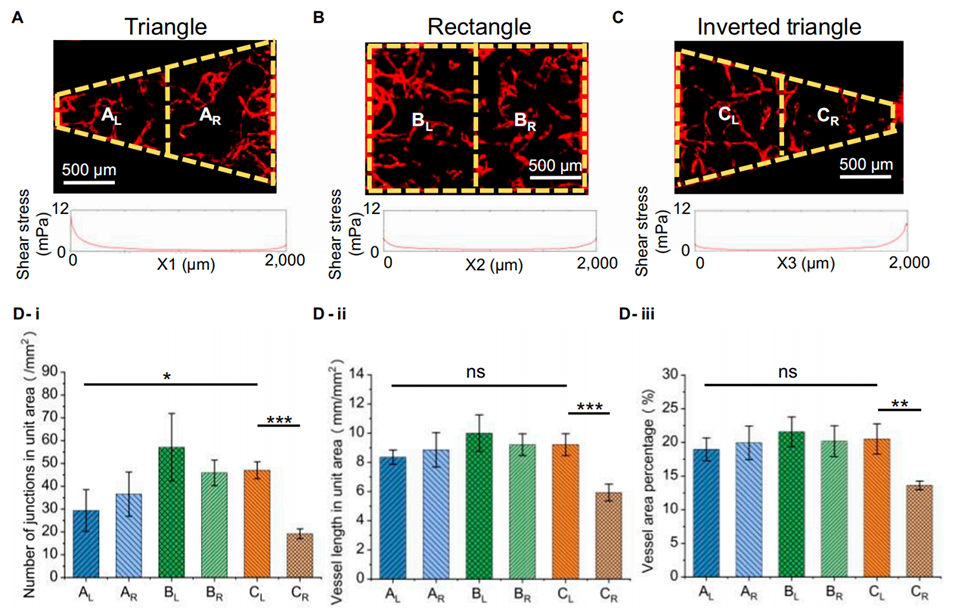
图 5. 三种形状腔室左右半区微血管参数的定量分析。(A)三角形组织腔左半区(AL)和右半区(AR)的示意图。(B)矩形腔室左半区(BL)和右半区(BR)的示意图。(C)倒三角形腔室左半区(CL)和右半区(CR)的示意图。(D)各区域的(i)单位面积连接点数、(ii)单位面积血管长度和(iii)血管面积百分比的定量分析(平均值±标准差,n=4)。
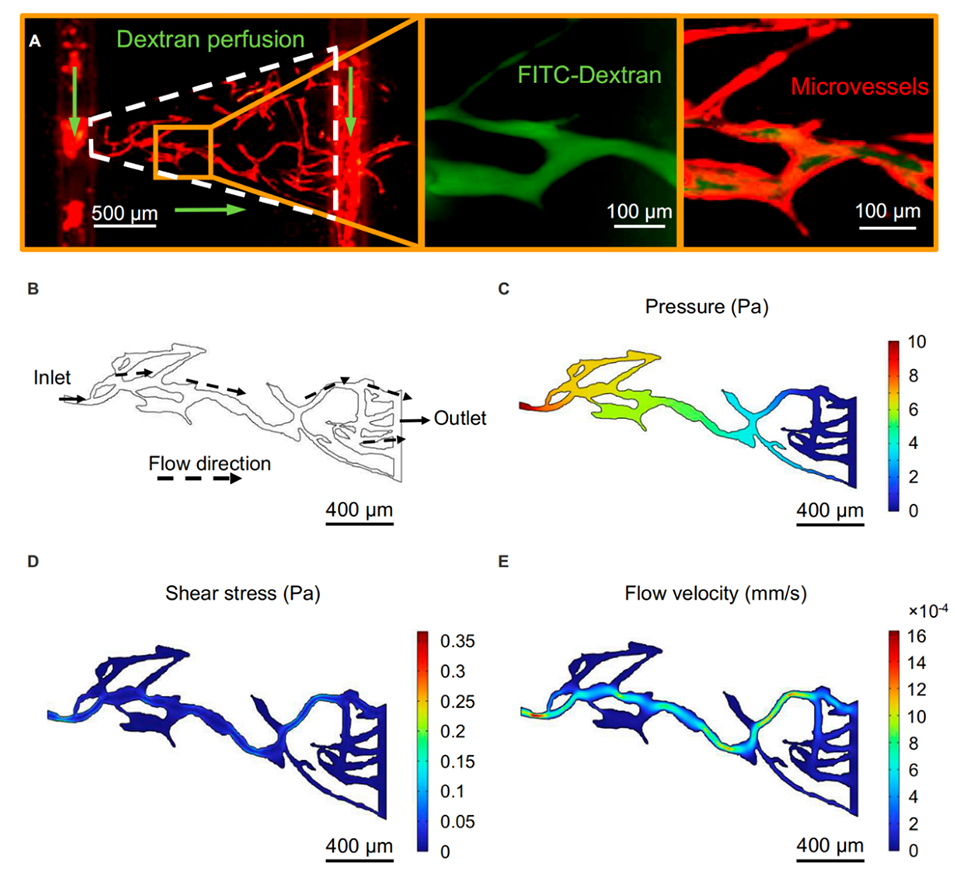
图 6. 微血管中 FITC - 葡聚糖的灌注以及微血管内流体压力、剪切应力和流速分布的模拟结果。(A)FITC - 葡聚糖成功灌注微血管且无明显泄漏。(B)通过图像处理提取的微血管轮廓。(C)微血管内的静水压力分布。(D)微血管内的剪切应力分布。(E)微血管内的流速分布。
论文链接:https://doi.org/10.34133/cbsystems.0207
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














