从基因文库中高通量分选微生物对于各种生物学应用至关重要,但现有方法往往依赖外源标记或批量测量,无法捕捉细胞通讯的复杂动态。群体感应作为一种普遍存在的细胞间通讯机制,为分选提供了通用信号,但它需要细胞近距离接触,而且不同物种共培养还受到种间竞争的限制。

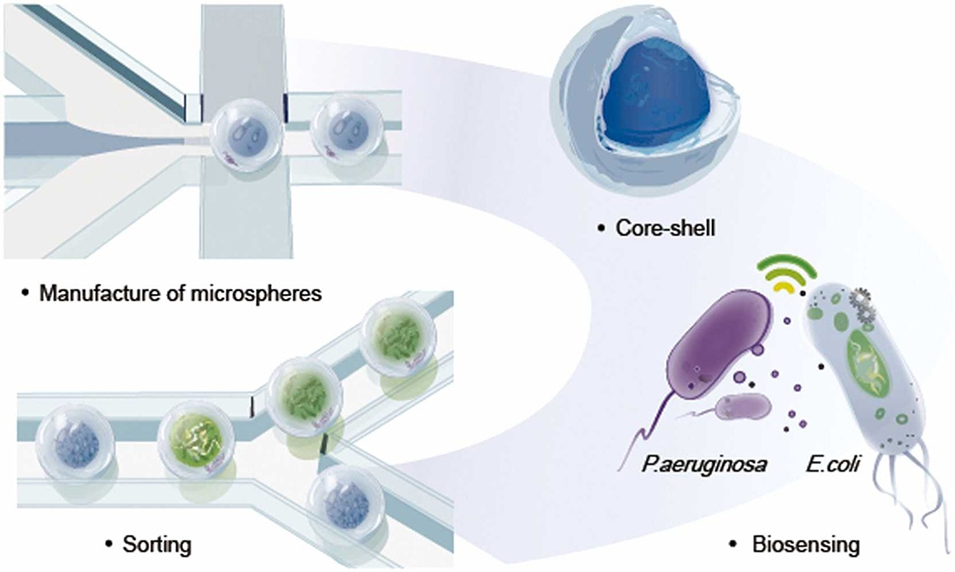
为有效应对这些挑战,南京工业大学余子夷教授团队联合中国药科大学胡驰副教授开发了一种基于核壳微室的微流控平台,该平台通过空间分离微生物物种并支持可控共培养,利用群体感应这一天然生物标志物实现了微生物的精确分选。相关研究以“Core-shell microcompartments in microfluidics enable quorum sensing as a native biomarker for precision microorganism sorting”为题目,发表在期刊《Sensors and Actuators B: Chemical》上。
本文要点:
1、本研究开发了一种基于核壳微室(CSMs)的微流控平台,利用群体感应(QS)作为天然生物标志物实现微生物精准分选。
2、传统分选方法依赖外源标记且难以捕捉细胞间动态通讯,而QS虽具普适性,却受限于细胞近距离接触和种间竞争。
3、通过将微生物(如大肠杆菌、聚球藻、铜绿假单胞菌)分别封装在羧甲基纤维素(CMC)核与甲基丙烯酰化明胶(Gel-MA)壳的微室中,实现了空间隔离下的可控共培养。
4、该设计维持了QS所需微米级距离,同时抑制种间竞争,使信号分子高效跨区传递。
5、结合微流控分选系统,以QS触发的荧光为指标,实现了单细胞菌落的高通量、高精度分选(准确率89%),无需复杂基因修饰。此技术为合成生物学和微生物组研究提供了新工具。
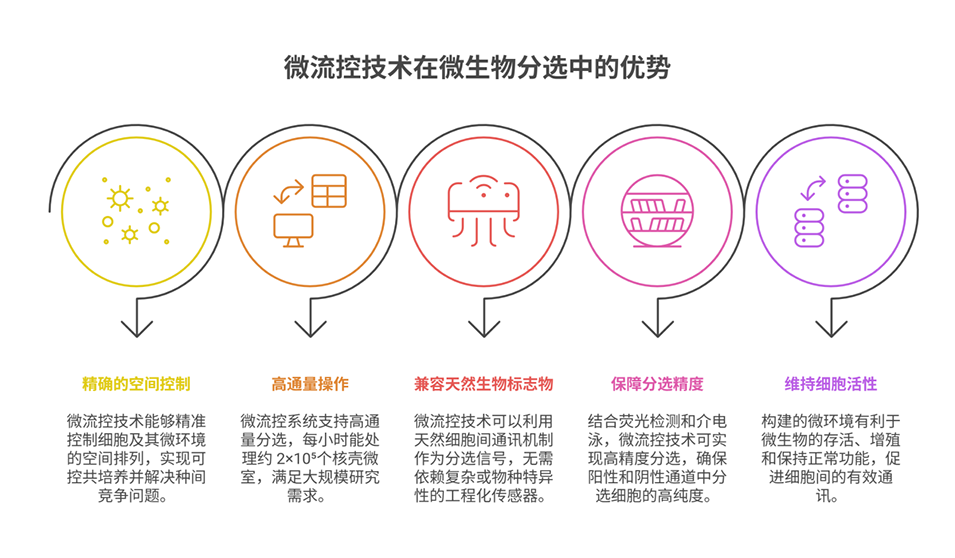
这种基于群体感应(QS)激活的高通量分选方法,其核心原理是通过核壳微室(CSMs)构建可控微环境,利用微生物天然的QS通信机制产生特异性信号,再结合微流控系统实现精准分选。具体如下:
1、核壳微室(CSMs)的空间隔离与通信支持
结构设计:CSMs由CMC核心(羧甲基纤维素,液态)和Gel-MA壳层(甲基丙烯酰化明胶,水凝胶)组成,通过微流控芯片的流动聚焦技术生成单分散微室。两者因亲水性和粘度差异形成双相系统,实现物理隔离但允许小分子信号传递。
功能作用:将不同微生物(如信号发送菌和响应菌)分别封装在核心或壳层中,既满足QS对“近距离接触”的要求(信号分子扩散距离仅数微米),又避免种间直接竞争,为可控共培养和QS通信提供稳定微环境。
2、QS信号的产生与检测
QS信号激活:微生物通过分泌信号分子(如铜绿假单胞菌分泌的3OC12HSL)实现群体感应。在CSMs中,信号分子可跨核心-壳层屏障扩散,与目标菌(如含pLuxR-eGFP质粒的大肠杆菌)的受体(LasR)结合,激活下游启动子(pLuxR),驱动荧光蛋白(eGFP)表达。
信号可视化:通过荧光检测(488nm激光激发,525/39nm滤光片接收)捕捉eGFP荧光,将QS激活状态转化为可量化的光学信号,作为分选的“生物标志物”。
3、微流控系统的高通量分选
信号识别:CSMs流经微流控通道时,荧光信号被光电倍增管(PMT)捕获并转化为电信号,通过软件分析判断是否达到QS激活阈值(如设定25V为阈值)。
电泳操控:基于信号判断结果,对目标CSMs施加非均匀电场,利用介电泳力将其导向“阳性通道”(含QS激活微生物),非目标CSMs则进入“阴性通道”。该系统处理速率可达约2×10⁵个CSMs/小时,且分选纯度(阳性通道荧光微室占比87%)和准确率(89%)较高。
该方法的核心逻辑是:以CSMs解决QS的空间限制和种间竞争问题→以QS天然信号替代外源标记→以微流控荧光检测和电泳操控实现高通量精准分选,最终实现对微生物“功能活性”(而非仅物理属性)的特异性筛选。
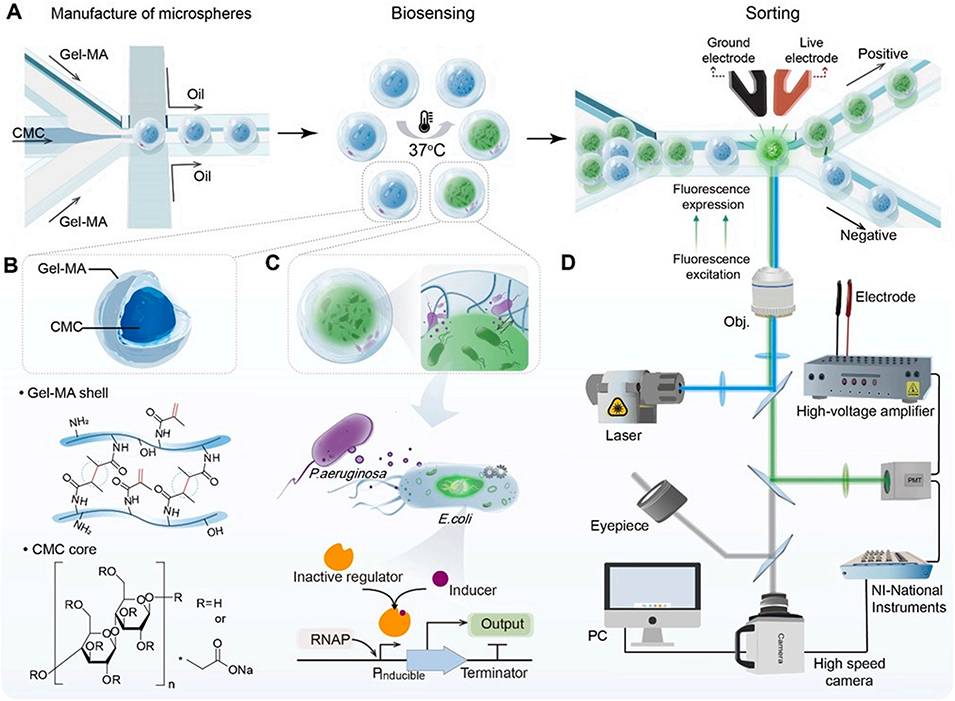
图 1. 利用核壳微室(CSMs)促进群体感应(QS)介导的微生物分选的微流控平台工作流程。(A)工作流程概述。(B)核壳微室的结构,包含羧甲基纤维素(CMC)液态核心和甲基丙烯酰化明胶(Gel-MA)水凝胶壳层。Gel-MA 水凝胶壳层提供结构稳定性,而 CMC 液态核心用于微生物封装。(C)基于群体感应的生物传感,其中自诱导物作为天然生物标志物,触发绿色荧光蛋白(GFP)荧光以实现特定微生物的检测。(D)高通量分选结合荧光信号与电泳操控,实现微生物的精准分离。
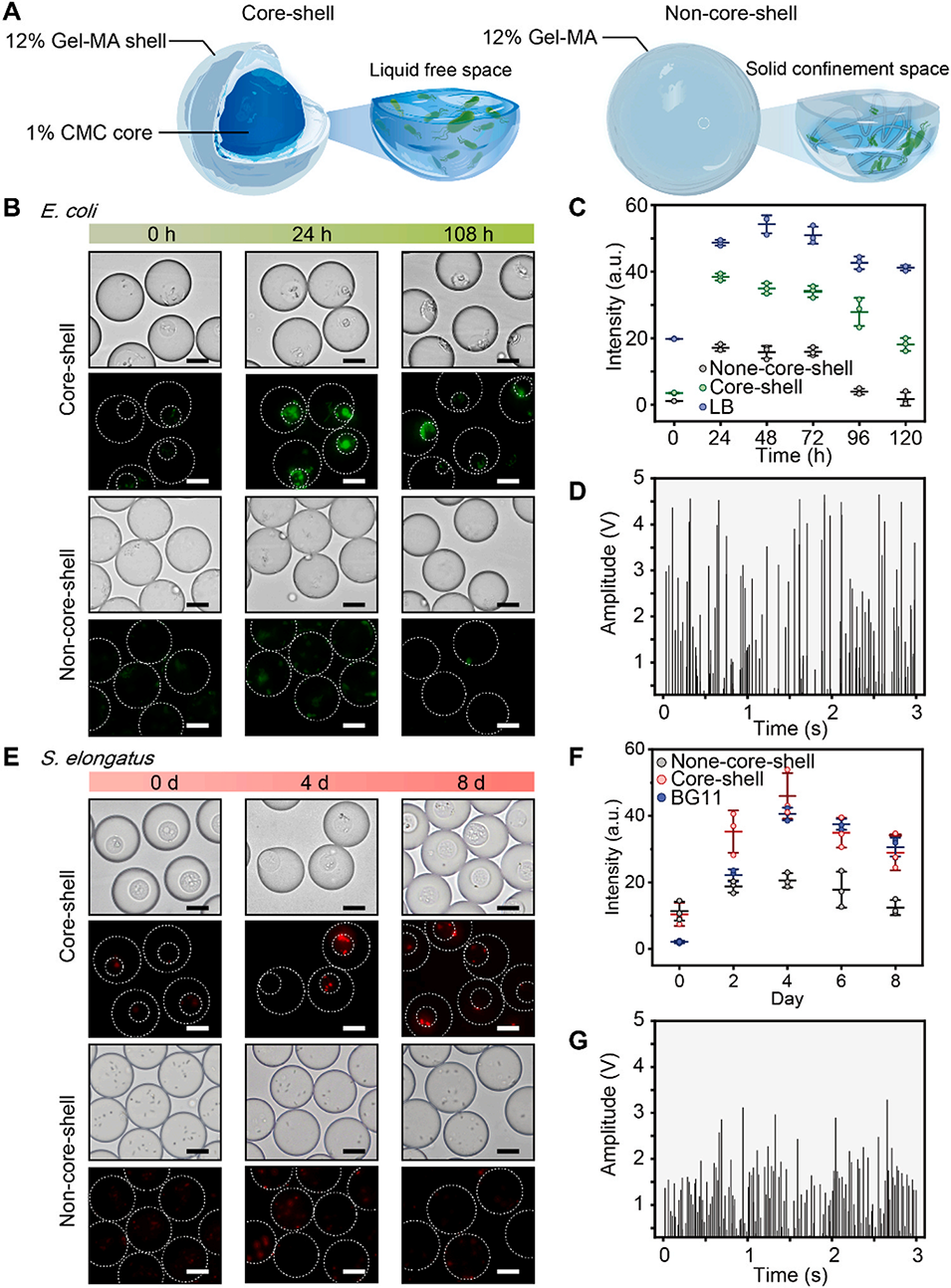
图 2. 核壳微室(CSMs)促进微生物增殖与活性。(A)核壳微室及其纯 Gel-MA 类似物的示意图。(B)大肠杆菌 ATCC 25922-sfGFP 在核壳微室(上)与 Gel-MA 微滴(下)中生长的荧光图像。(C)荧光强度随时间变化的定量分析,表明核壳微室中细胞生长更旺盛。(D)24 小时后的在线微流控荧光检测结果。(E)聚球藻在核壳微室(上排)与 Gel-MA 微滴(下排)中的荧光图像,红色叶绿素自发荧光证实封装成功。(F)不同时间的荧光对比,显示核壳微室对微生物的包裹效果更优。(G)24 小时后的在线荧光检测结果。比例尺,20 微米。
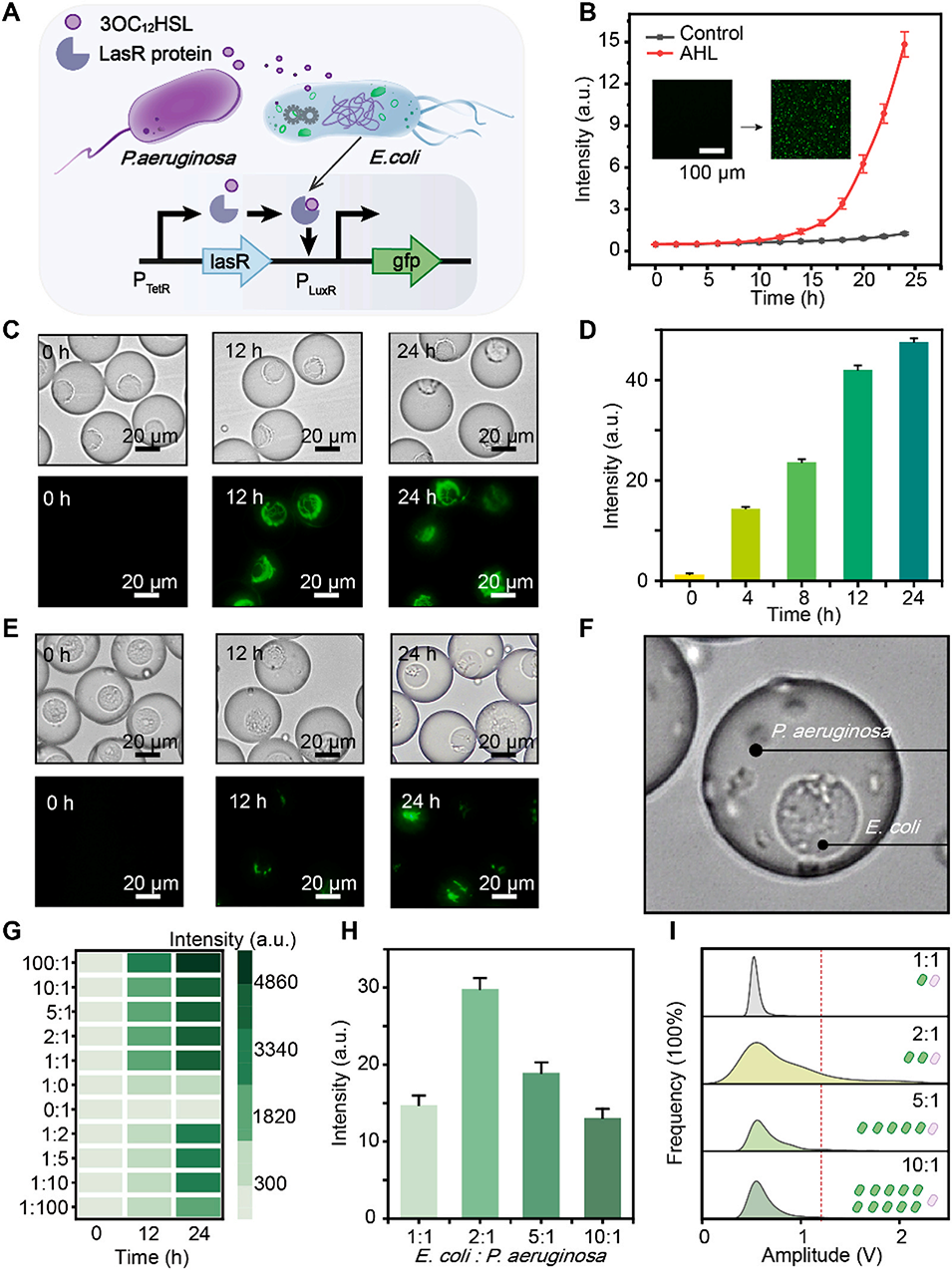
图 3. 大肠杆菌与铜绿假单胞菌之间的群体感应(QS)。(A)携带 pLuxR-eGFP 质粒的大肠杆菌响应铜绿假单胞菌产生的酰基高丝氨酸内酯(AHL)的示意图。(B)大肠杆菌在 bulk 培养基中感知 1μM 3OC12HSL 的荧光随时间变化。(C)未交联核壳微室的明场和荧光图像,其中大肠杆菌嵌入 CMC 核心,1μM 3OC12HSL 存在于 Gel-MA 壳层中。(D)使用 ImageJ 量化的荧光强度随时间变化。(E)交联核壳微室中,大肠杆菌位于核心而铜绿假单胞菌位于壳层,显示孵育过程中荧光的发展;(F)放大图像突出显示物种的空间排列。(G)大肠杆菌与铜绿假单胞菌在 bulk 培养基中不同比例共培养后的荧光情况。(H)在核壳微室中,不同大肠杆菌与铜绿假单胞菌比例下孵育 24 小时后的荧光强度;(I)相应的荧光分布。
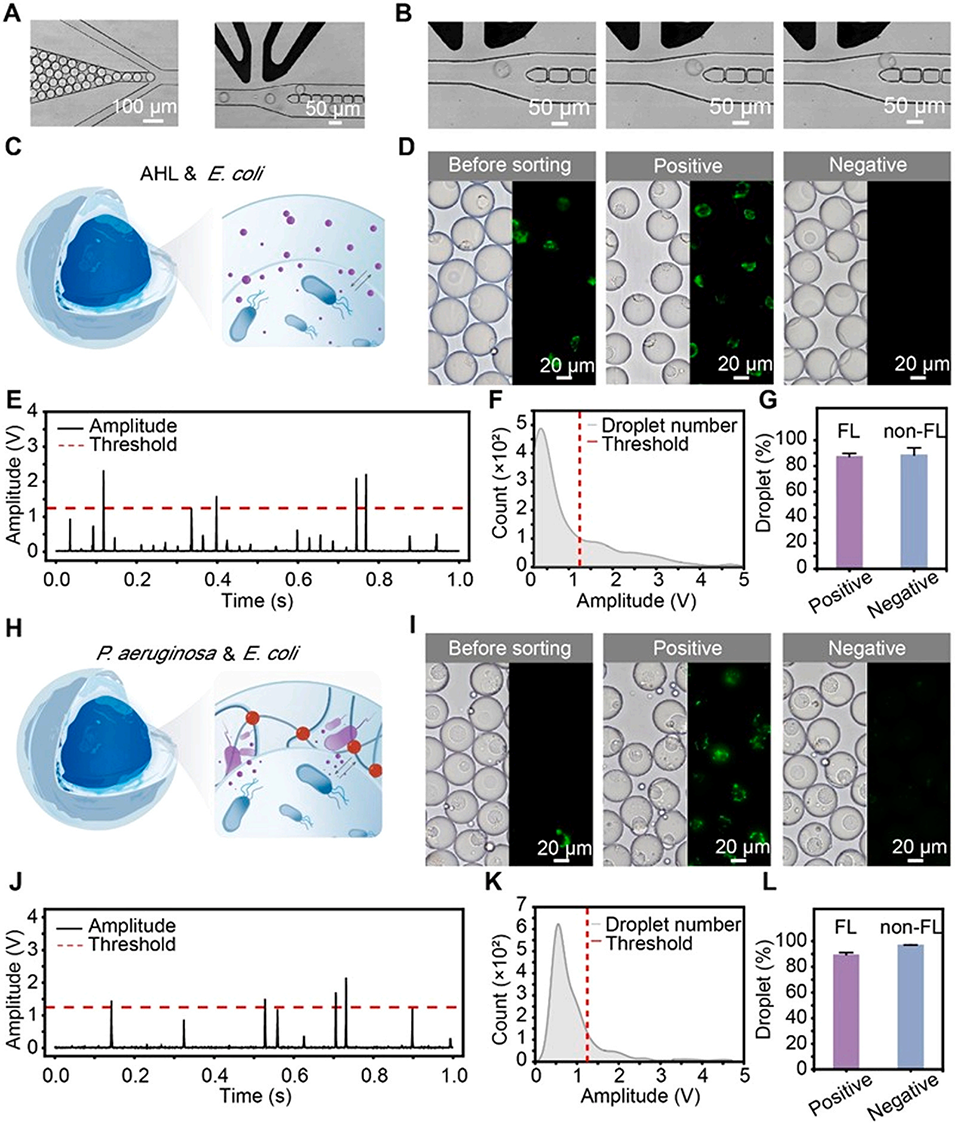
图 4. 基于群体感应(QS)诱导的荧光信号对核壳微室(CSMs)进行微流控分选。(A)分选芯片的显微图像。(B)荧光核壳微室被分选至阳性通道的延时图像。(C-G)未交联系统的示意图、分选前后的显微图像、荧光信号分析、振幅分布以及阳性和阴性通道中荧光(FL)与非荧光(non-FL)核壳微室的数量比例,该系统中 CMC 核心含 pLuxR-eGFP 大肠杆菌(OD600 为 0.60),Gel-MA 壳层含 1μM 3OC12HSL。(H-L)交联核壳微室的相应结果,其中 CMC 核心含 pLuxR-eGFP 大肠杆菌(OD600 为 0.66),Gel-MA 壳层含铜绿假单胞菌(OD600 为 0.37)。
论文链接:https://doi.org/10.1016/j.snb.2025.138060
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














