
导读:
血管组织工程(VTE)旨在通过生物材料、细胞和生长因子构建功能性血管结构以治疗血管疾病。近期,江苏大学药学院徐希明教授、曹霞副教授、王启龙等人通过静电喷雾技术制备了负载外胚间充质干细胞(EMSCs)的GelMA水凝胶微球,该微球具有均匀尺寸、高孔隙率及可控降解性,能有效促进EMSCs黏附、增殖并分化为内皮细胞,在体内外均展现出良好的血管再生能力。相关研究以“Electrospinning of microspheres with ectodermal mesenchymal stem cells for vascular regeneration”为题目,发表在期刊《European Polymer Journal》上。
本文要点:
1、本研究通过静电喷雾技术制备了负载外胚间充质干细胞(EMSCs)的GelMA水凝胶微球。
2、优化电纺参数后,获得了直径约150μm、内部孔径约50μm、孔隙率约45%、降解周期约28天且细胞活性高的均匀微球。
3、体外实验表明,微球支持EMSCs黏附、增殖并诱导其分化为内皮细胞形成血管样结构。
4、体内实验证实,微球可促进新生血管形成和组织整合,提高血管密度。
5、该电纺GelMA微球为VTE提供了有前景的策略,可通过调控微球组成和结构实现EMSCs定向释放和细胞信号转导,改善治疗效果和生物相容性。
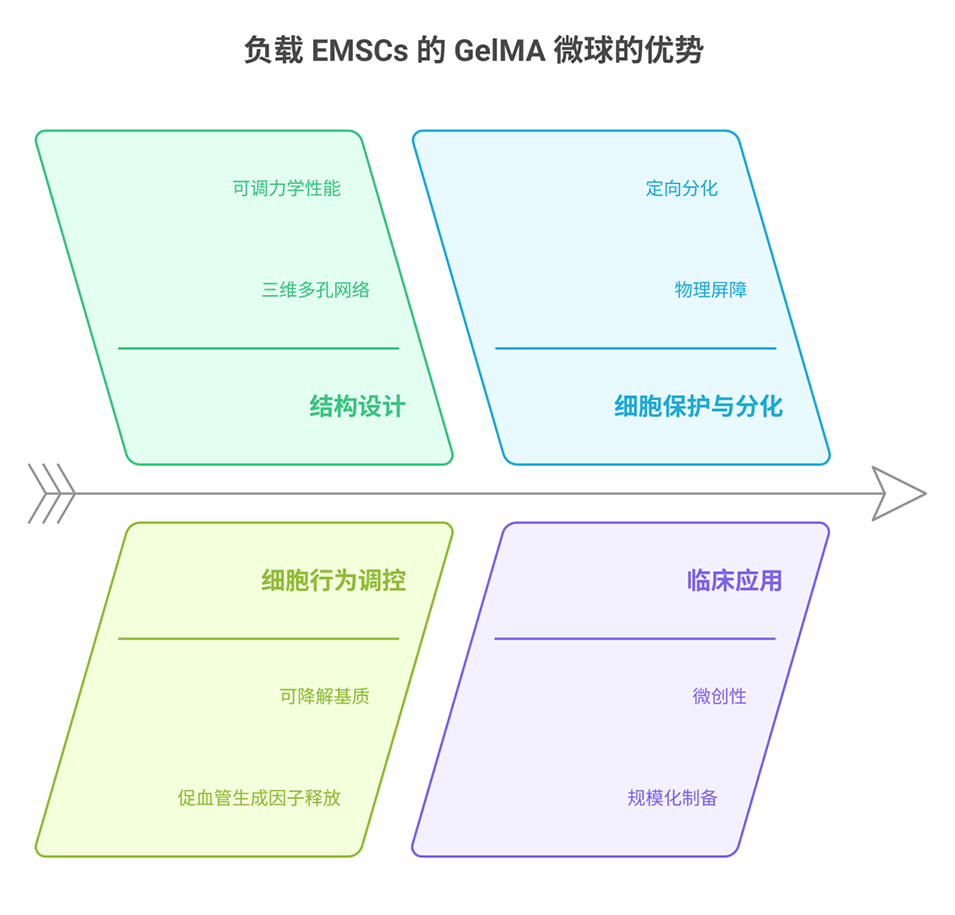
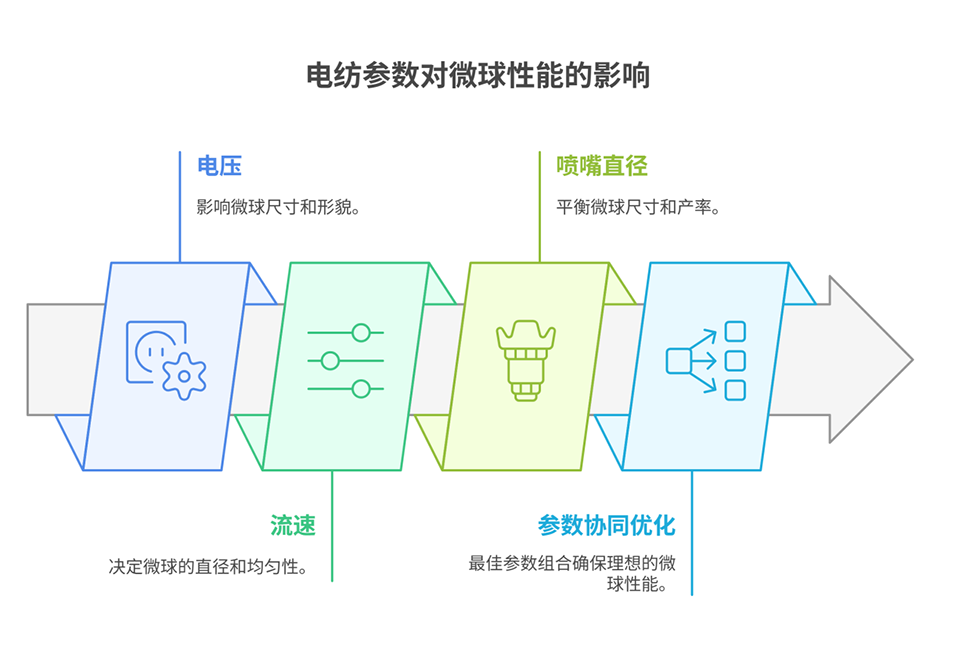
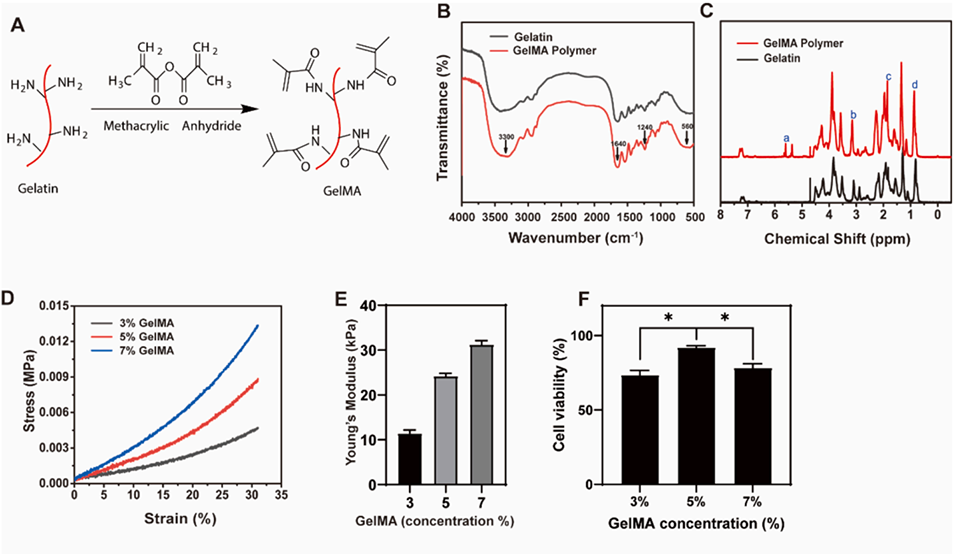
图1. GelMA的表征。A)GelMA的合成。B)GelMA的红外光谱图,证实了甲基丙烯酸酯基团的存在。C)GelMA的核磁共振(NMR)光谱图,用于验证甲基丙烯酰化程度。D)不同浓度GelMA的弹性模量曲线,显示出其机械性能的可调性。E)不同浓度GelMA的杨氏模量。F)不同浓度GelMA的细胞存活率(*: P<0.05)。
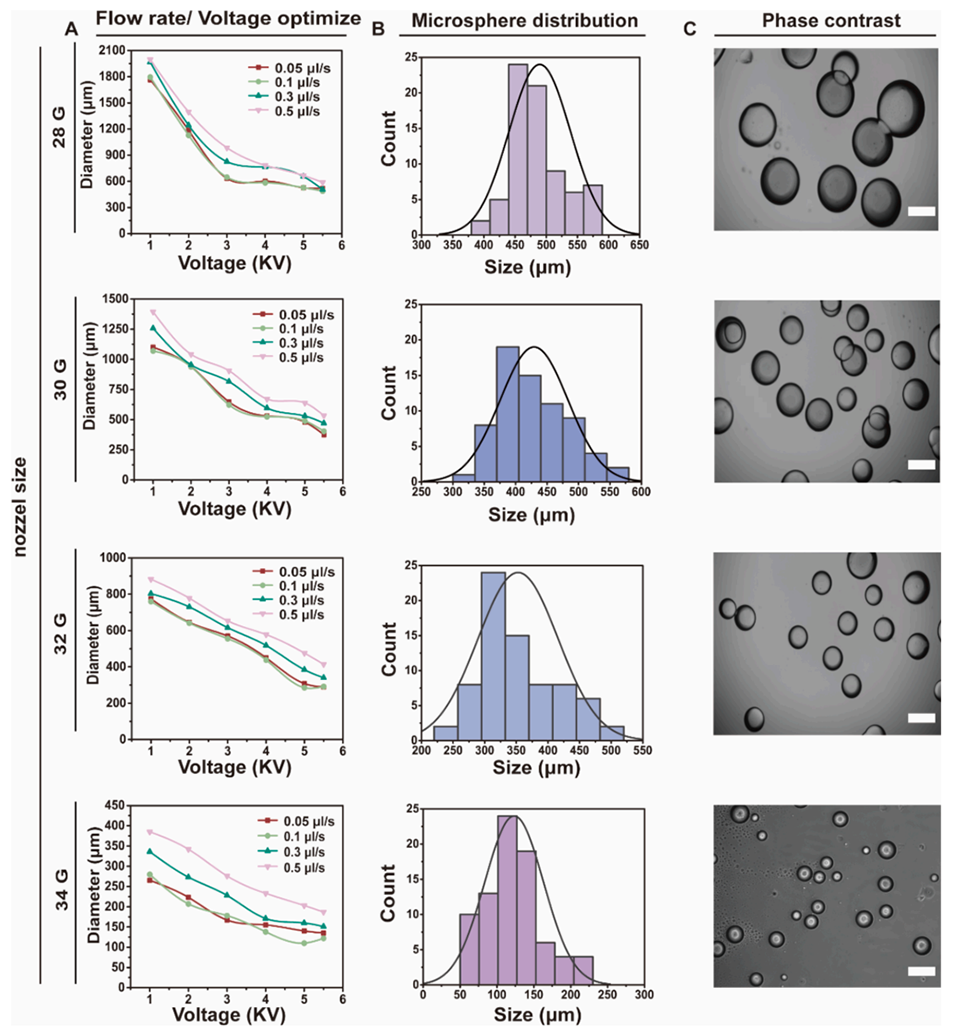
图2.微球直径的打印参数优化。A)电压、流速和喷嘴尺寸对微球直径的影响。B)不同喷嘴下最佳打印参数的粒径分布图。C)不同喷嘴下最佳打印参数的相差显微镜图像,比例尺为300μm。
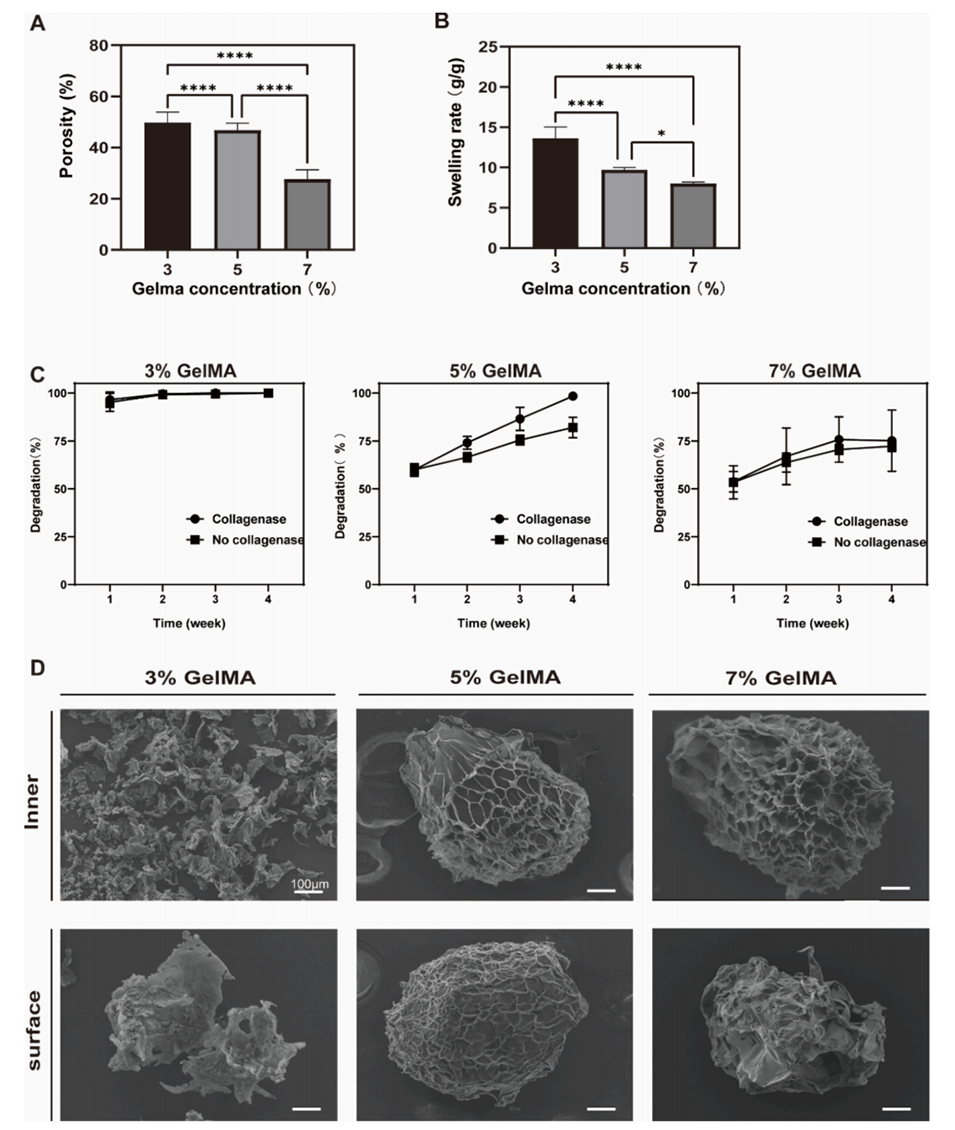
图3.不同浓度GelMA水凝胶的表征。
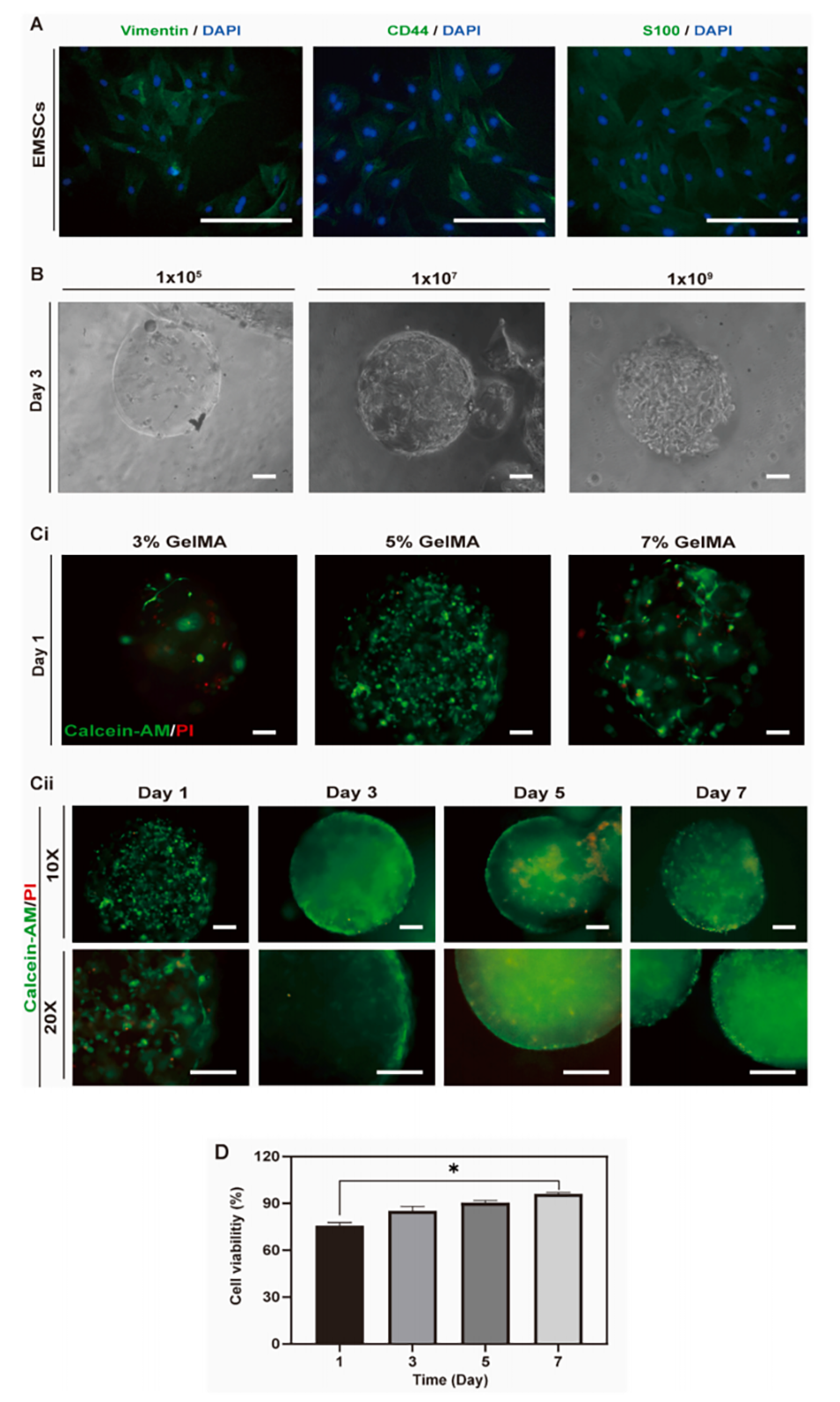
图4. GelMA的生物相容性。
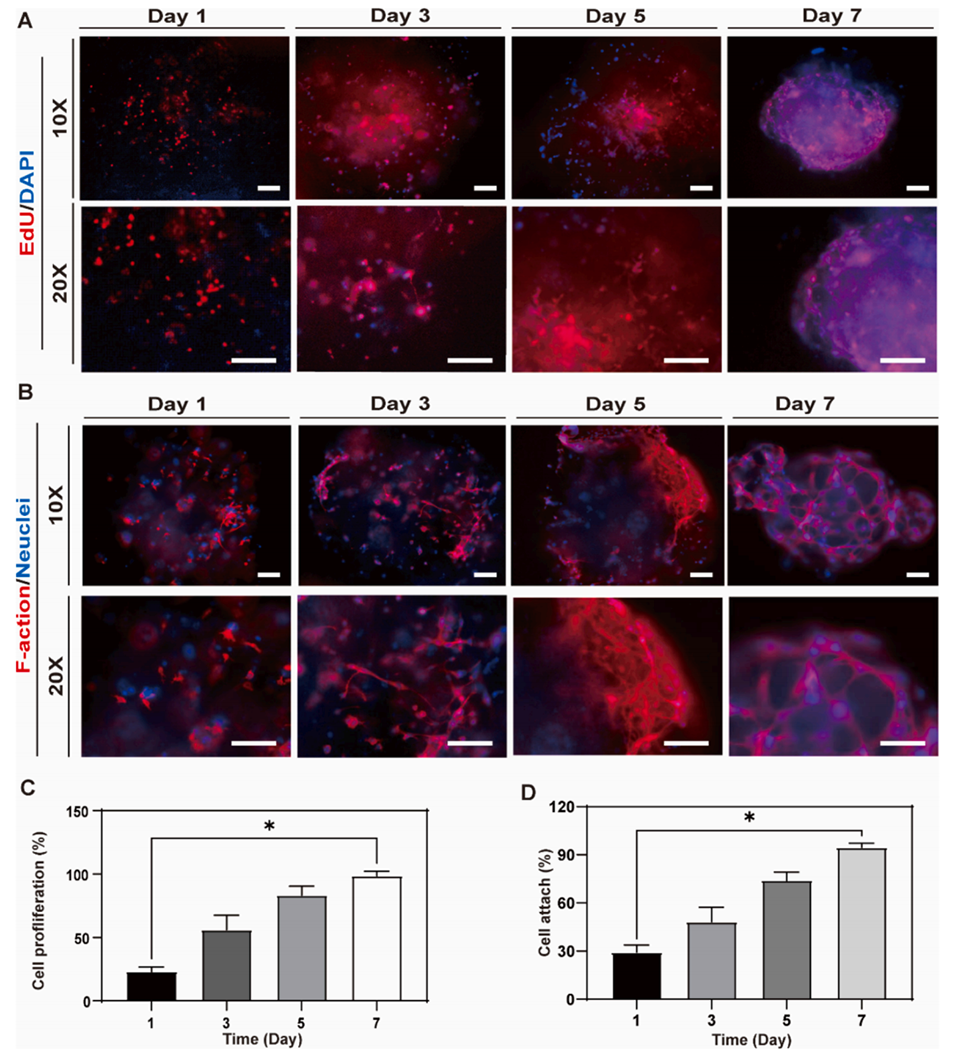
图5. EMSCs在GelMA中的增殖与黏附。
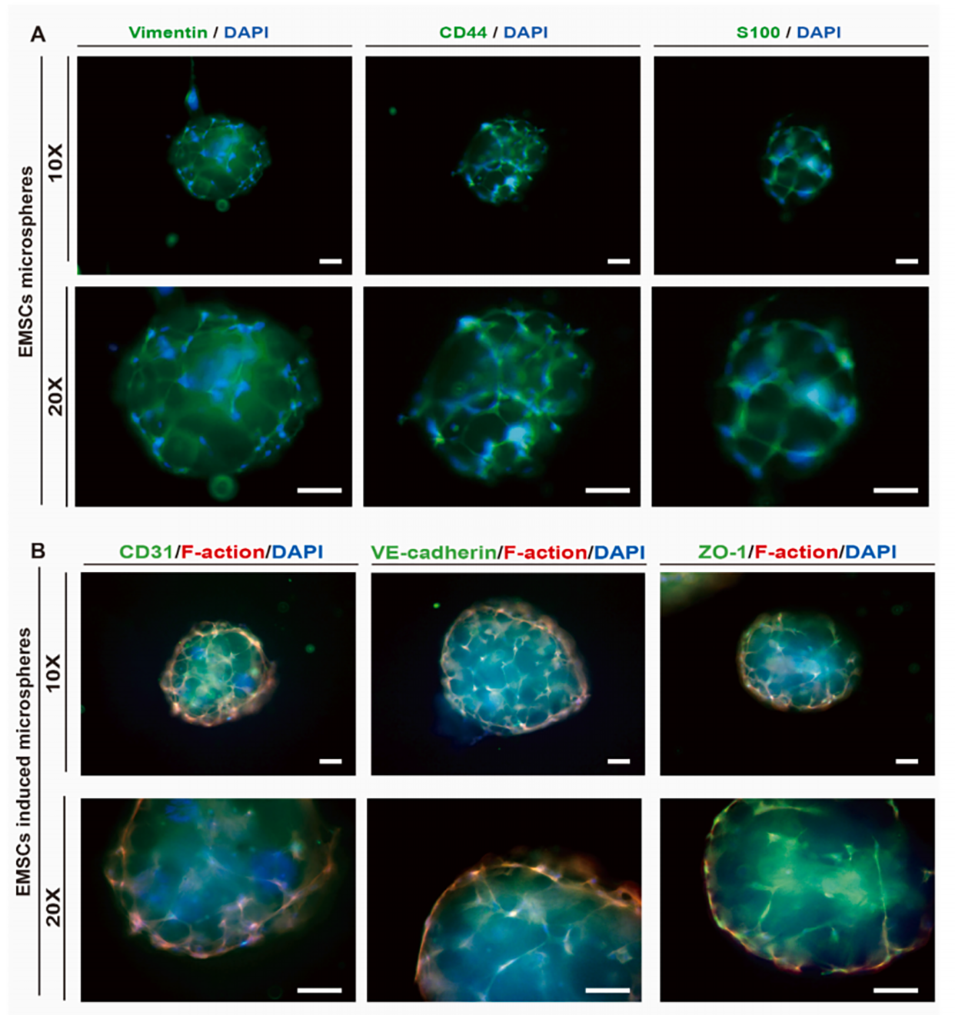
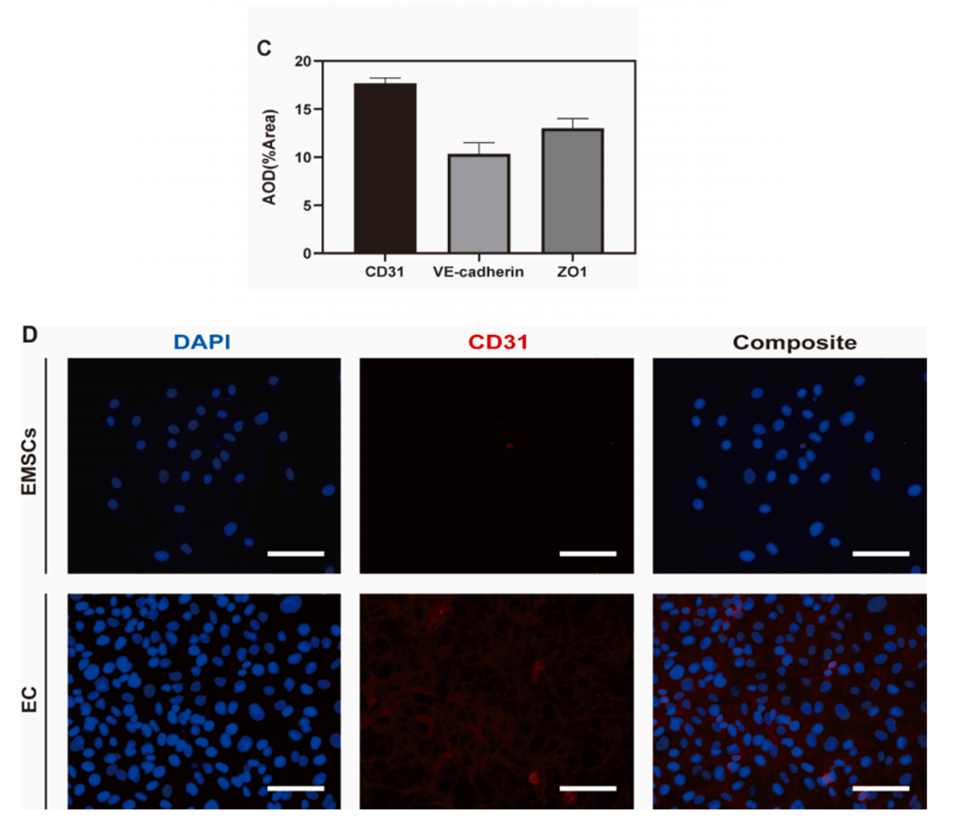
图6.体外诱导EMSCs向内皮细胞(EC)分化。
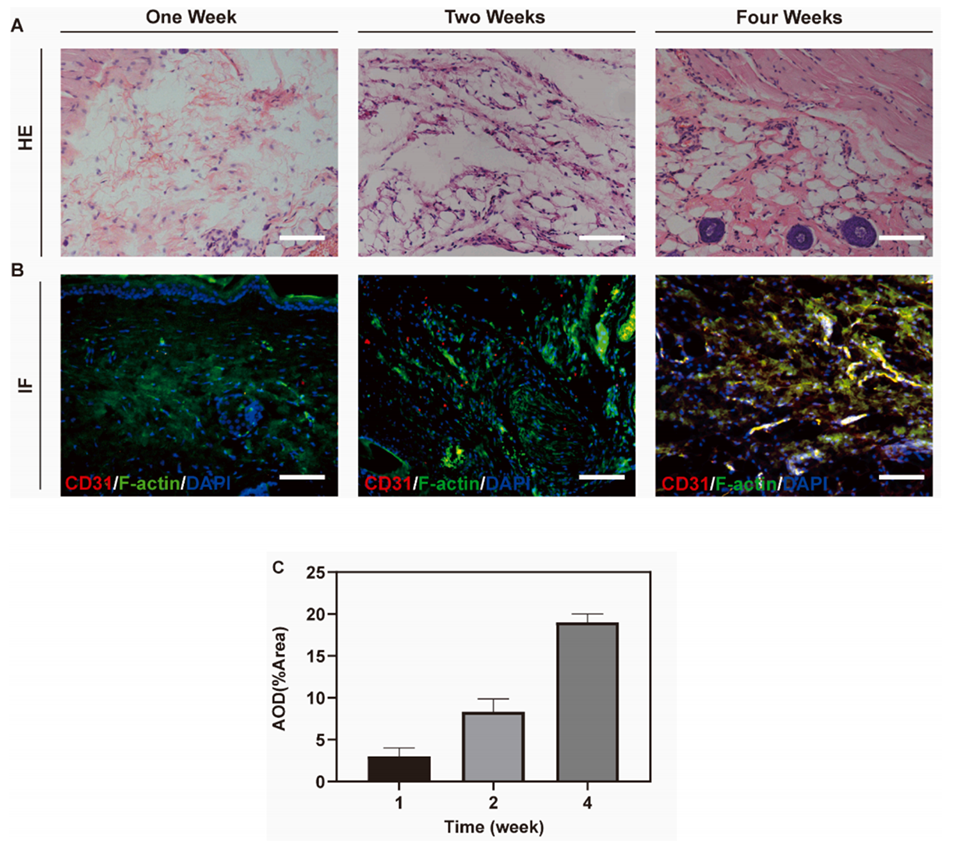
图7.体内诱导EMSCs向内皮细胞(EC)分化。
论文链接:https://doi.org/10.1016/j.eurpolymj.2025.113716














