
导读:
海藻酸盐水凝胶微胶囊在药物输送、细胞治疗等生物医学领域应用广泛,但存在机械稳定性有限等问题。本研究旨在开发一种新型海藻酸盐-甲壳素复合水凝胶微胶囊,通过引入甲壳素纳米纤维和使用不同金属离子(二价钙离子和三价铁离子)交联,改善其性能并探索其在生物医学中的应用潜力。相关研究以“Fabrication of cell-laden hydrogel microcapsules of alginate and chitin fibrils using divalent and trivalent metal ions”为题目,发表在期刊《RSC Advances》上。
本文要点:
1、本文报道了一种基于海藻酸盐/甲壳素纳米纤维(60:40)的复合水凝胶微胶囊,通过静电封装技术结合二价钙离子(Ca²⁺)和三价铁离子(Fe³⁺)交联制备。
2、Fe³⁺交联微胶囊(AF0)及Fe³⁺/Ca²⁺复合交联微胶囊(AFC)的储能模量显著高于Ca²⁺交联样品(AC0),且Fe³⁺通过配位共价键形成三维网络,提升了机械稳定性。
3、AF0和AFC在生理条件下抗溶胀性优异,而AC0在PBS中尺寸明显增大。
4、AF0和AFC微胶囊封装NIH/3T3成纤维细胞5天后细胞活性均>80%,其中AF0因多孔结构和增强的蛋白吸附能力,显著促进细胞增殖和迁移。
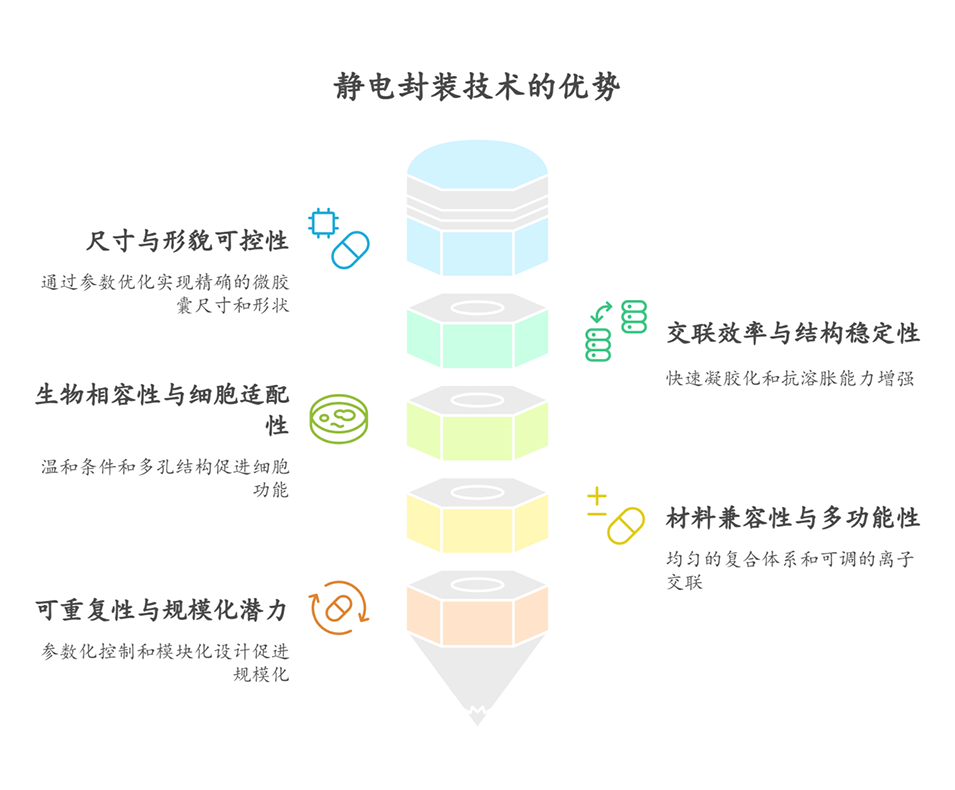
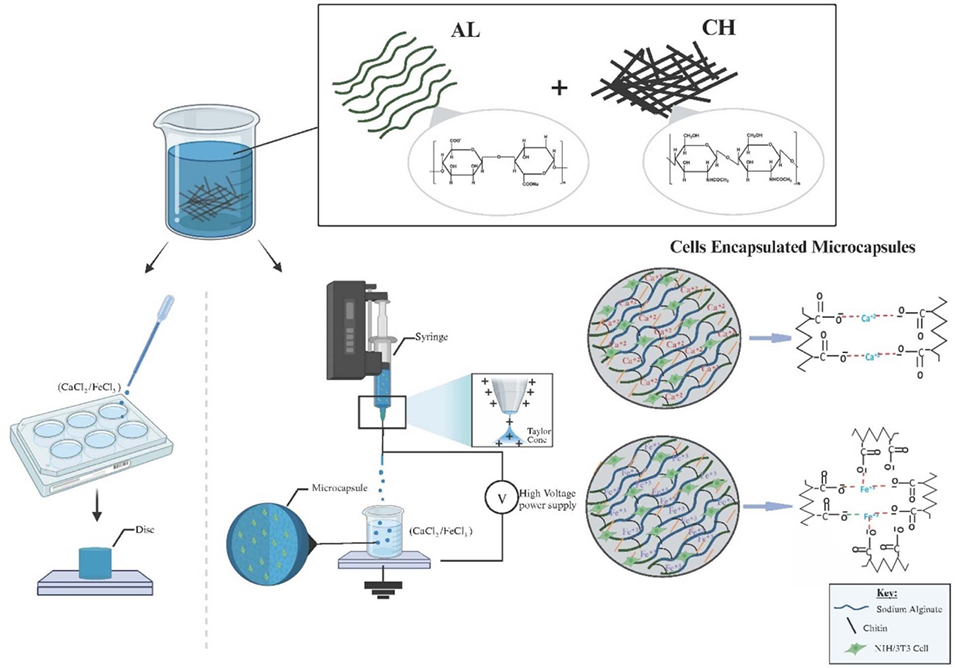
图1海藻酸盐/甲壳质盘和微胶囊的生产示意图,以及海藻酸盐在胶凝过程中与Ca2+或Fe3+金属离子的相互作用模式及其光学图像。
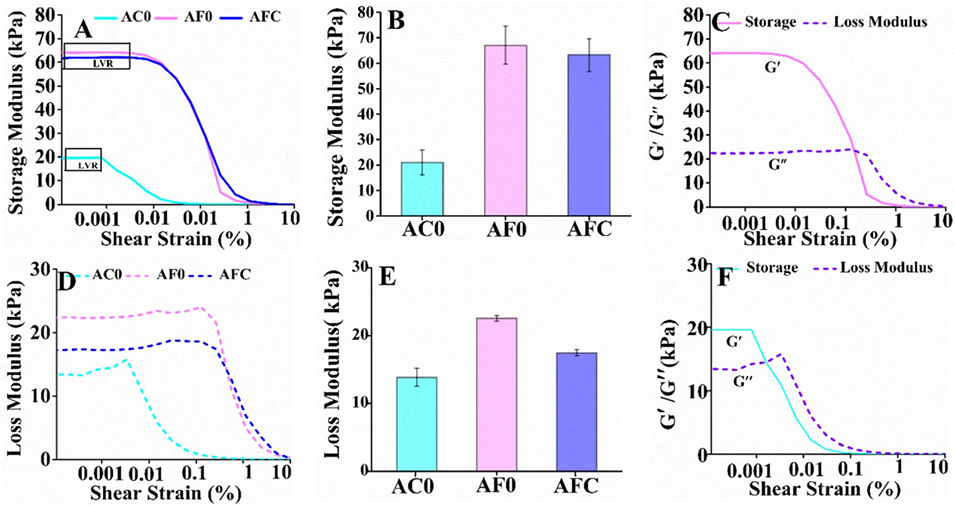
图2 25°C下水凝胶的流变分析。
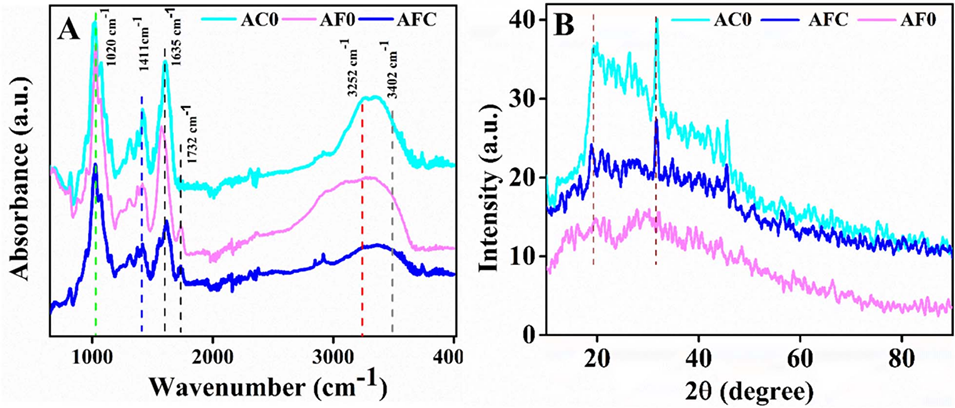
图3水凝胶微胶囊的化学结构和结晶度分析。(A)干燥微胶囊的ATR-FTR光谱和(B)微胶囊的XRD图谱。
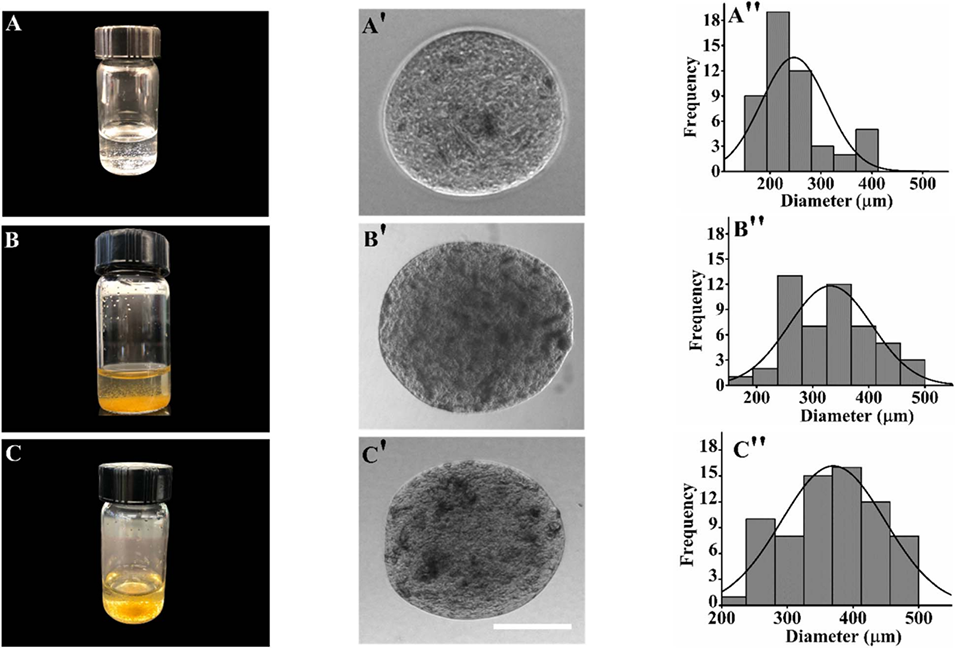
图4水凝胶微球的表征。
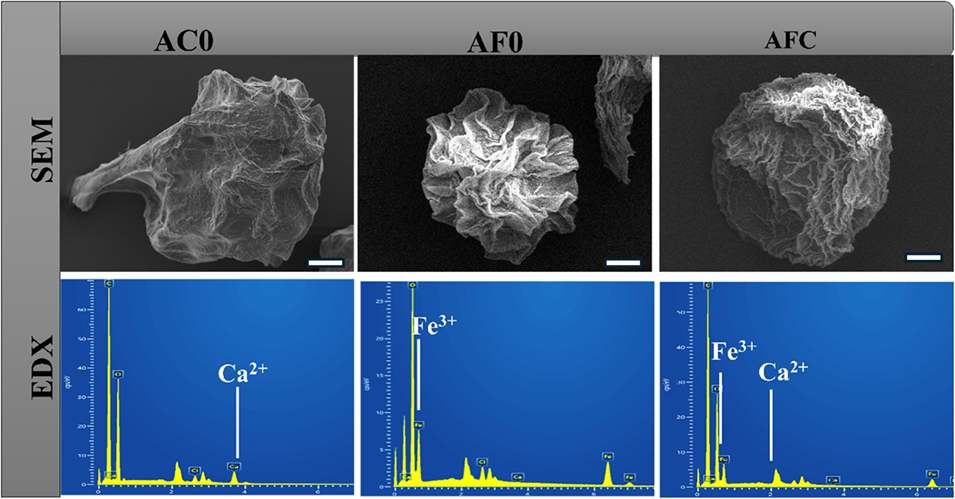
图5冻干微胶囊的表面形态表征和元素组成测定。上图为冻干AC0、AF0和AFC微胶囊的SEM显微照片,下图为各微胶囊的EDX分析,描绘了元素百分含量。比例尺=50 mm。
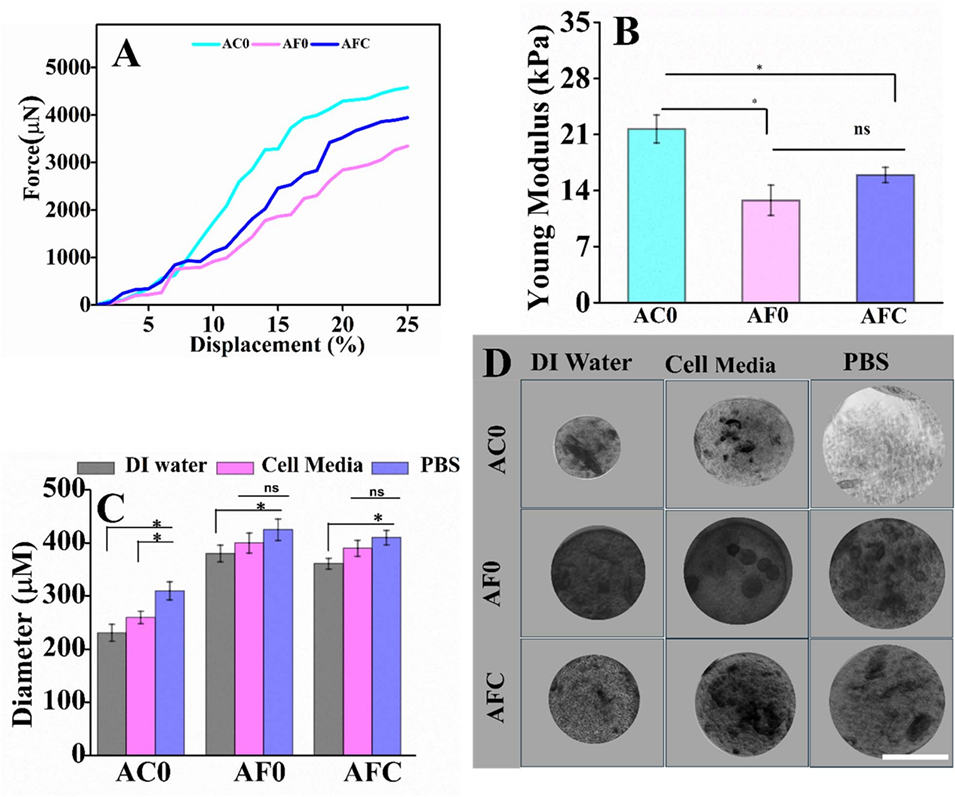
图6微胶囊在25°C下于不同培养基中孵育24小时的力学性能和稳定性分析。
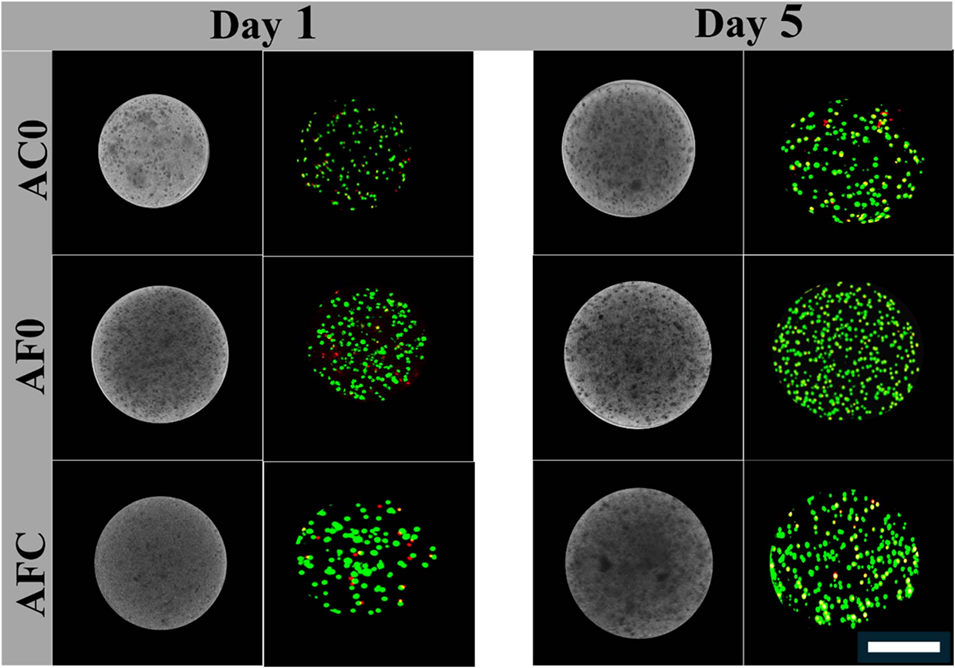
图7微胶囊的体外性能和细胞存活率研究。封装NIH/3T3成纤维细胞的微球的亮场图像和荧光图像,活细胞染成绿色,死细胞染成红色。用AOPI对细胞进行染色,比例尺=200 mm。
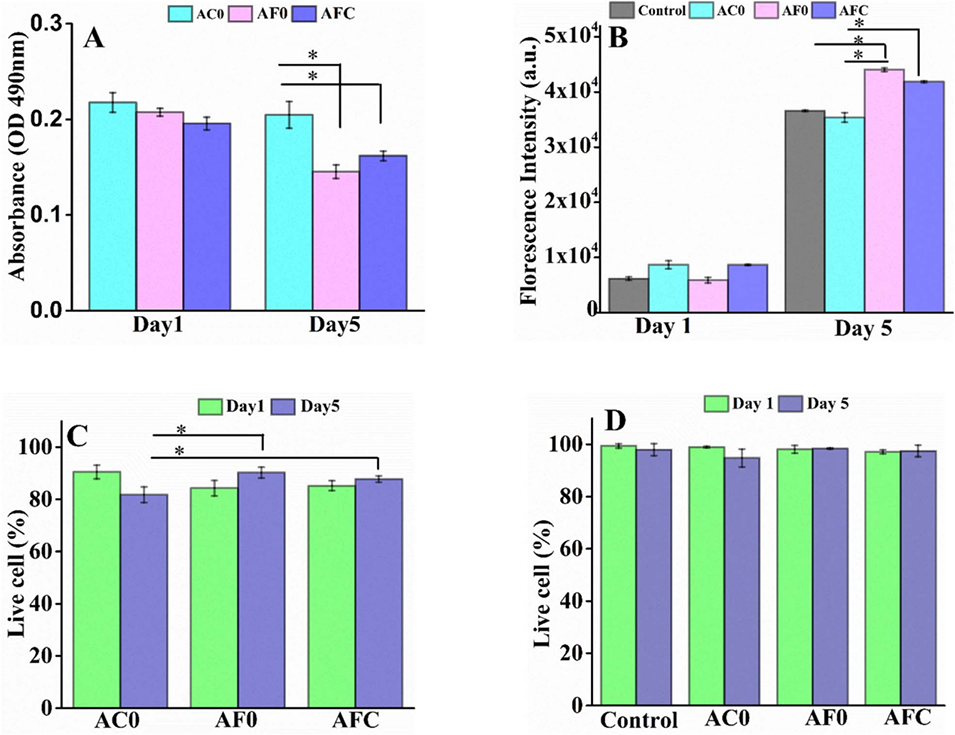
图8 NIH/3T3成纤维细胞微囊的体外分析,以及通过LDH测定和活死染色研究的细胞存活率和细胞附着性能。
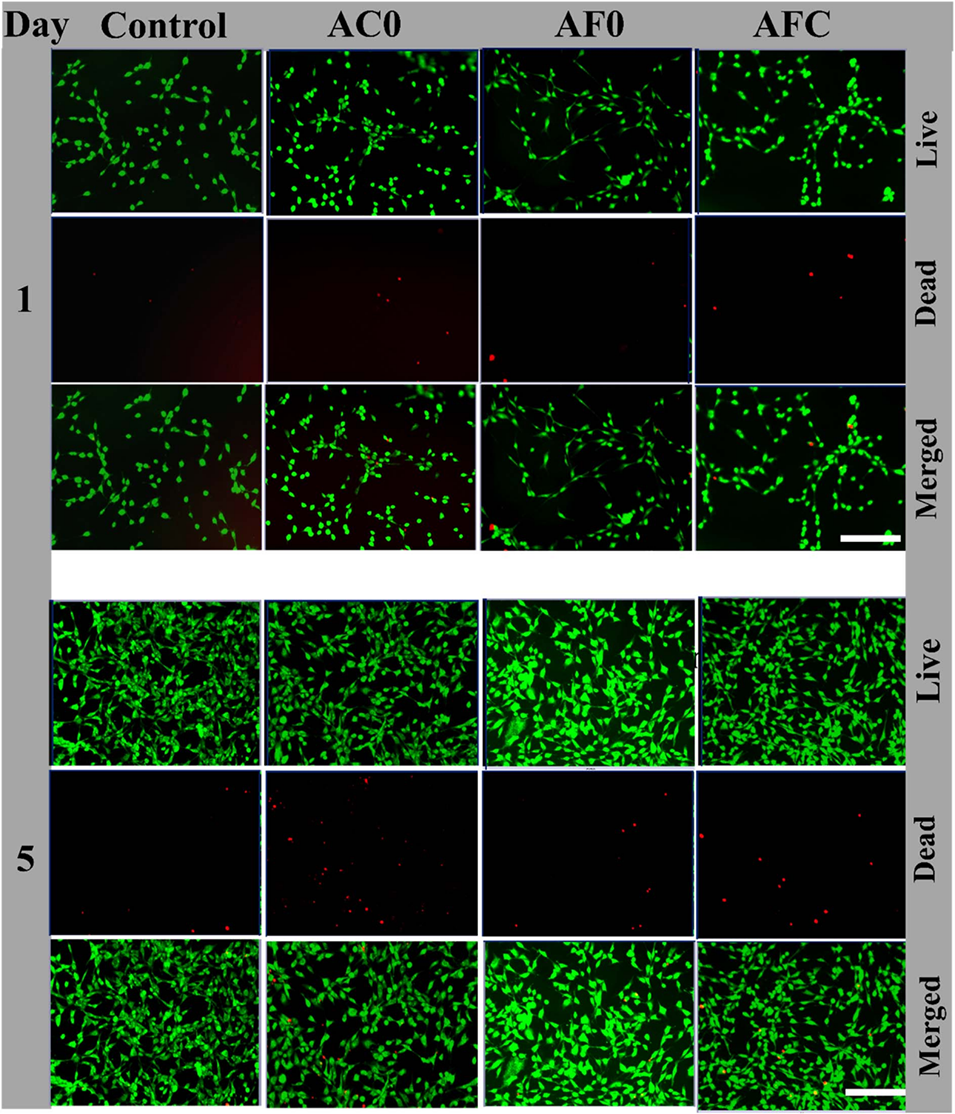
图9微胶囊提取液的体外性能和细胞活力研究。第1天和第5天在提取液中培养的NIH/3T3细胞的荧光图像,活细胞染成绿色,死细胞染成红色。使用AOPI对细胞进行染色,比例尺=200 mm。
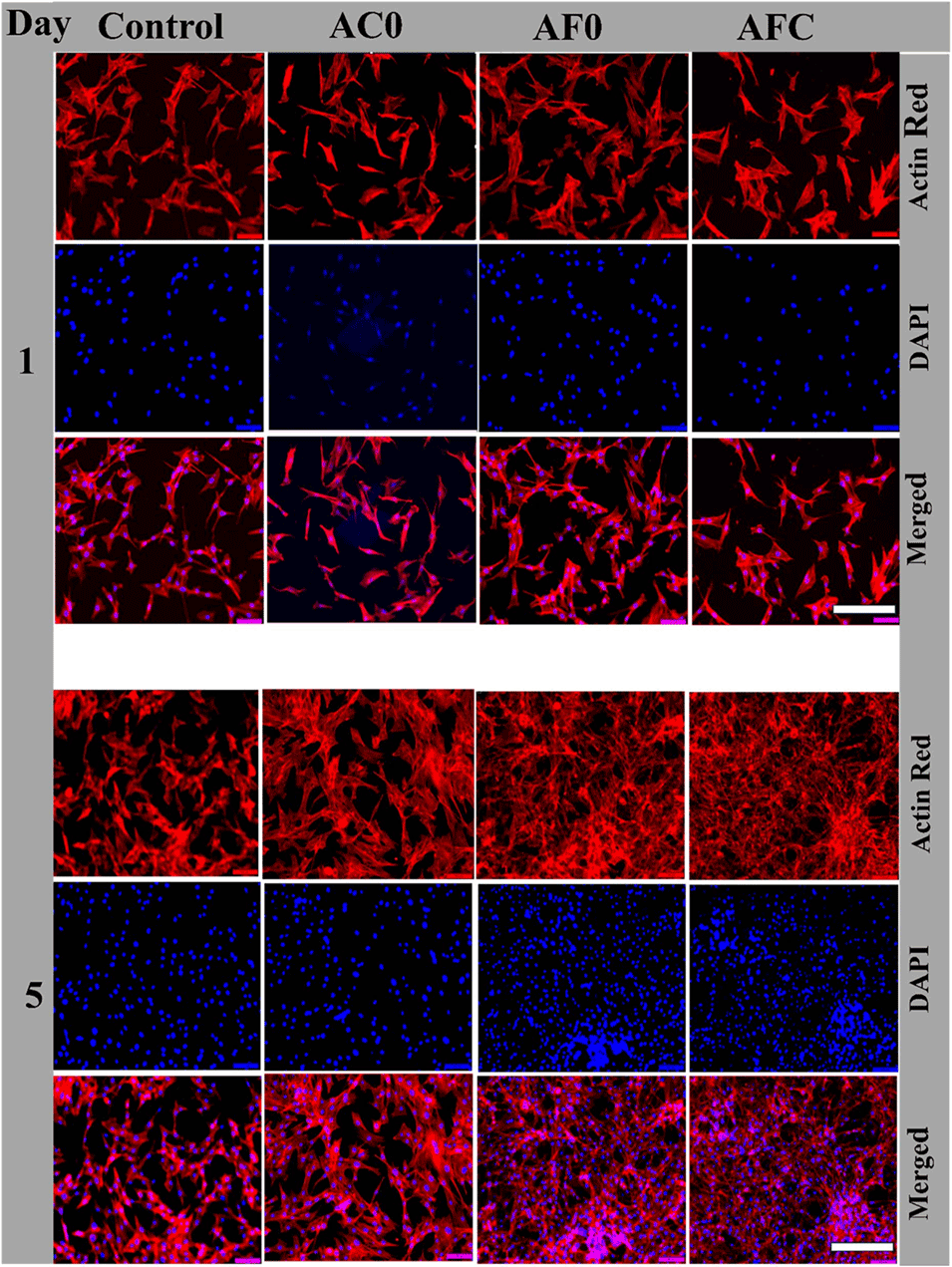
图10在AC0、AF0、AFC微胶囊提取液和对照培养基上培养的NIH/3T3成纤维细胞增殖和形态的研究。第1天和第5天后在提取液中培养的NIH/3T3成纤维细胞的荧光显微镜图像。细胞骨架用罗丹明-鬼笔环肽(红色)染色,细胞核用DAPI(蓝色)反染。比例尺=100 mm。
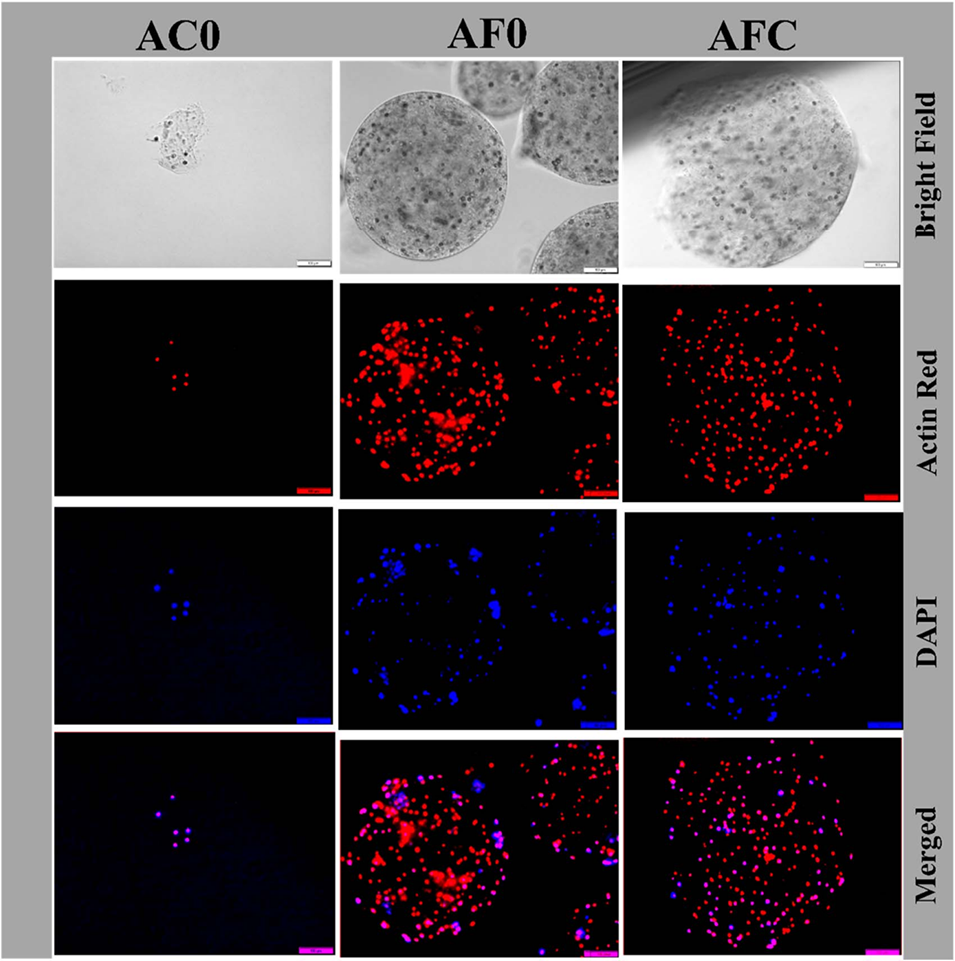
图11培养5天后AC0、AF0和AFC微胶囊内NIH/3T3成纤维细胞形态和增殖的研究。封装细胞的微胶囊的亮场图像(上图),随后是荧光显微镜图像,细胞骨架用罗丹明-鬼笔环肽(红色)染色,细胞核用DAPI(蓝色)染色,比例尺=100 mm。
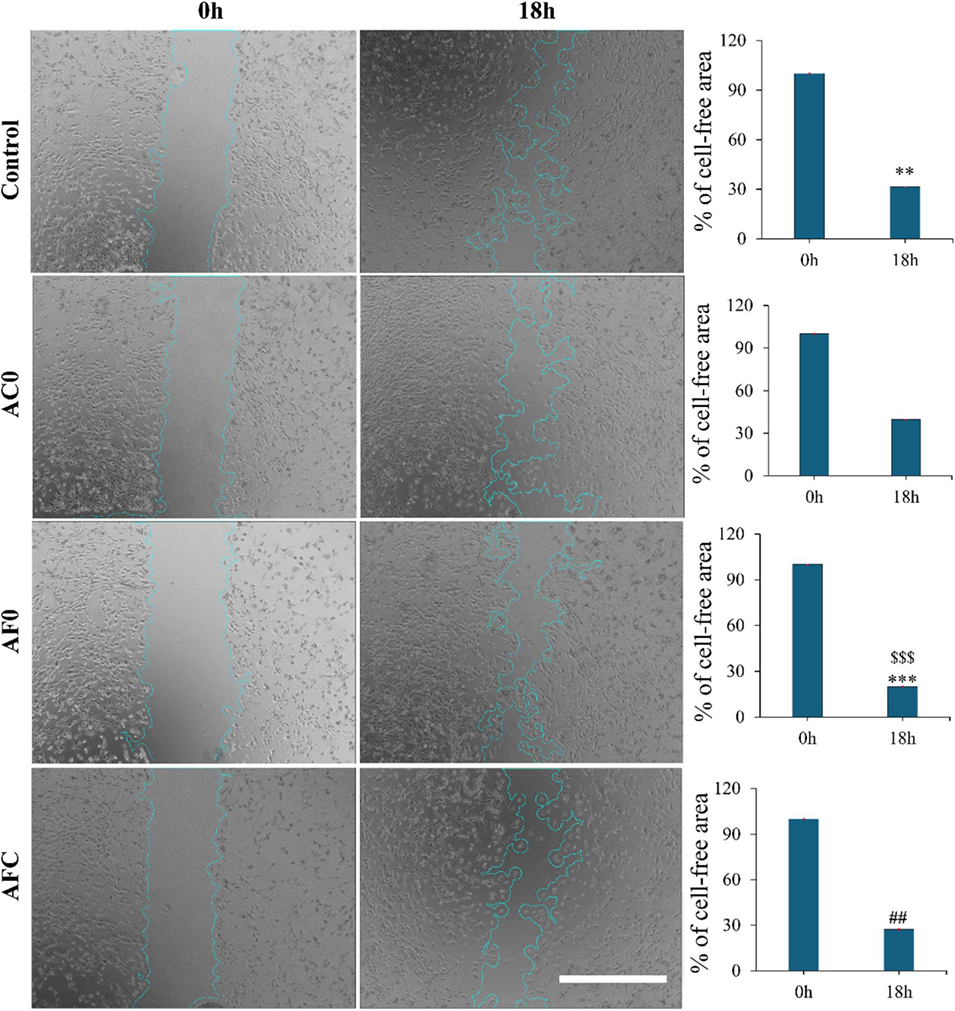
图12体外划痕伤口愈合试验的代表性图像和相应的定量分析表明,NIH/3T3细胞迁移到无细胞区域,如不同微胶囊培养基提取物中的蓝线所示。使用ImageJ软件的伤口愈合尺寸工具测量NIH/3T3的迁移能力。在0 h和18 h时,使用相差倒置显微镜观察并拍摄细胞在伤口区域迁移和扩散的图像。比例尺=500 mm。右栏的相应柱状图表示划痕伤口试验期间给定时间间隔内无细胞区域的百分比。采用Tukey事后分析法进行单因素方差分析,数据表示为平均值±标准差;每组n=4(其中,##p < 0.01表示与对照组(TCP)和AFC组相比,**p < 0.01表示与对照组和AC0组相比,***p < 0.001表示与AC0组和AF0组相比,$$$p < 0.001)
论文链接:https://doi.org/10.1039/D5RA01397F














