果蔬采后因腐烂、生理失调等问题,在运输和贮藏过程中损耗严重,传统化学杀菌剂存在残留和抗药性风险,亟需开发绿色、环保的天然保鲜材料。芳樟醇作为天然单萜醇,具有广谱抗菌、抗氧化等生物活性,被美国FDA列为GRAS物质(这意味着它在预期使用条件下被专家普遍认为是安全的),但其高挥发性、不稳定、短作用时间和强刺激性气味限制了直接应用。微囊化技术通过天然/半合成聚合物壁材包裹活性成分,可保护芯材、控制释放、掩盖异味。

近期,北京市农林科学院农产品加工与食品营养研究所副所长王宝刚团队以海藻酸钠(SA)和氯化钙为壁材组分,通过离子凝胶法制备芳樟醇微胶囊 —— 海藻酸钠分子结构中古洛糖醛酸(G 嵌段)的羧基可与钙离子(Ca²⁺)快速交联,形成不可逆的“蛋盒式”凝胶网络,且包封过程在室温下进行,能最大程度保留芳樟醇的生物活性,有效解决其挥发性强、热稳定性差的应用瓶颈。该微胶囊不仅因海藻酸钠的生物可降解、无毒、来源广泛等特性契合食品保鲜领域绿色环保趋势,优化后包封率更达 88.44%,在甜樱桃采后保鲜中可显著提升果实抗氧化酶和抗真菌酶活性、抑制褐腐病菌生长,延长货架期。相关研究以“Preparation of linalool microcapsules and its application on preservation and antifungal protection in postharvest sweet cherry”为题目,发表在期刊《Food Chemistry》上。
本文要点:
1、该研究以芳樟醇为芯材、海藻酸钠为壁材,通过离子凝胶法制备芳樟醇微胶囊(LMs),并探究其在樱桃采后保鲜及对褐腐病菌(Monilinia fructicola)的抑制作用。
2、研究先通过单因素实验和响应面法优化制备工艺,确定最佳条件下包封率达88.44%;经扫描电镜、红外光谱及热重分析验证,芳樟醇成功包封,微胶囊具有良好热稳定性和缓释性。
3、应用实验表明,LMs可提升樱桃抗氧化能力、抗病性和贮藏品质,减少腐烂率(降幅47.5%)和失重率(降幅17.6%),维持果实硬度、糖酸含量及抗氧化酶、抗真菌酶活性。
4、抗菌机制研究显示,芳樟醇通过破坏褐腐病菌细胞膜完整性、抑制麦角甾醇合成、诱导活性氧积累,显著抑制病菌菌丝生长和孢子萌发,且在适宜浓度下能完全抑制樱桃褐腐病斑发展。综上,LMs可延长樱桃货架期,在果蔬保鲜领域具有广阔应用前景。
读后启示
本研究采用离子凝胶法,以海藻酸钠和氯化钙为壁材体系,成功制备了芳樟醇微胶囊,包埋效率达88.44%,并实现了缓释效果。然而,该方法在规模化生产中仍面临以下挑战:
1、微胶囊结构一致性难以控制
实验表明,壁材浓度、钙离子浓度、芯材比例等因素均显著影响微胶囊形貌与包埋效率。若放大生产,搅拌方式、滴加速度、温度波动等工艺参数更难精确控制,可能导致微胶囊大小不均、壁厚不一,影响释放行为一致性。
2、释放机制仍较为单一
当前微胶囊释放主要依赖扩散机制,受温度影响显著(如在20℃下释放更快)。未来可通过复合壁材设计(如引入壳聚糖、明胶等多糖/蛋白体系)或响应性材料(如pH敏感、酶敏感材料),实现更智能的释放控制,适应不同果蔬的贮藏环境。
3、规模化生产中的能耗与环保问题
虽然离子凝胶法在常温下进行,但后续的洗涤、干燥(如喷雾干燥)仍可能增加能耗。未来可探索微流控技术或膜乳化技术,提高微胶囊的均一性,同时减少溶剂使用与干燥步骤,推动绿色生产。
总之,微胶囊技术从实验室走向产业化,需在结构设计、工艺控制、释放机制三方面进行系统优化,并结合食品工程、材料科学等多学科交叉创新。
本研究发现芳樟醇通过破坏细胞膜完整性、抑制麦角甾醇合成、诱导活性氧积累等多种机制协同抑制褐腐病菌。这一多靶点作用机制为设计新型天然保鲜体系提供了重要思路:
1、开发复合微胶囊体系
可将芳樟醇与其他具有协同作用的天然成分(如壳聚糖、植物多酚、益生菌代谢物)共同包埋,构建“多效合一”的微胶囊体系。例如,壳聚糖本身具有抑菌性,且能增强微胶囊的成膜性与黏附性,进一步提升保鲜效果。
2、设计靶向释放系统
基于真菌细胞膜中麦角甾醇的特异性,可设计麦角甾醇响应型微胶囊,使其在感知真菌存在时更快速地释放活性成分,提高抑菌效率并减少对果蔬本身的影响。
3、结合纳米载体提升穿透性
芳樟醇虽具亲脂性,但对真菌细胞壁的穿透能力仍有限。未来可尝试将其封装于脂质体或固体脂质纳米粒中,增强其对细胞膜的亲和力与渗透性,从而在更低浓度下实现高效抑菌。
简言之,天然保鲜剂的设计不应局限于单一成分的封装,而应基于病原菌的生理特性与作用机制,构建多组分、多机制协同的智能递送系统,实现高效、安全、可持续的果蔬保鲜。
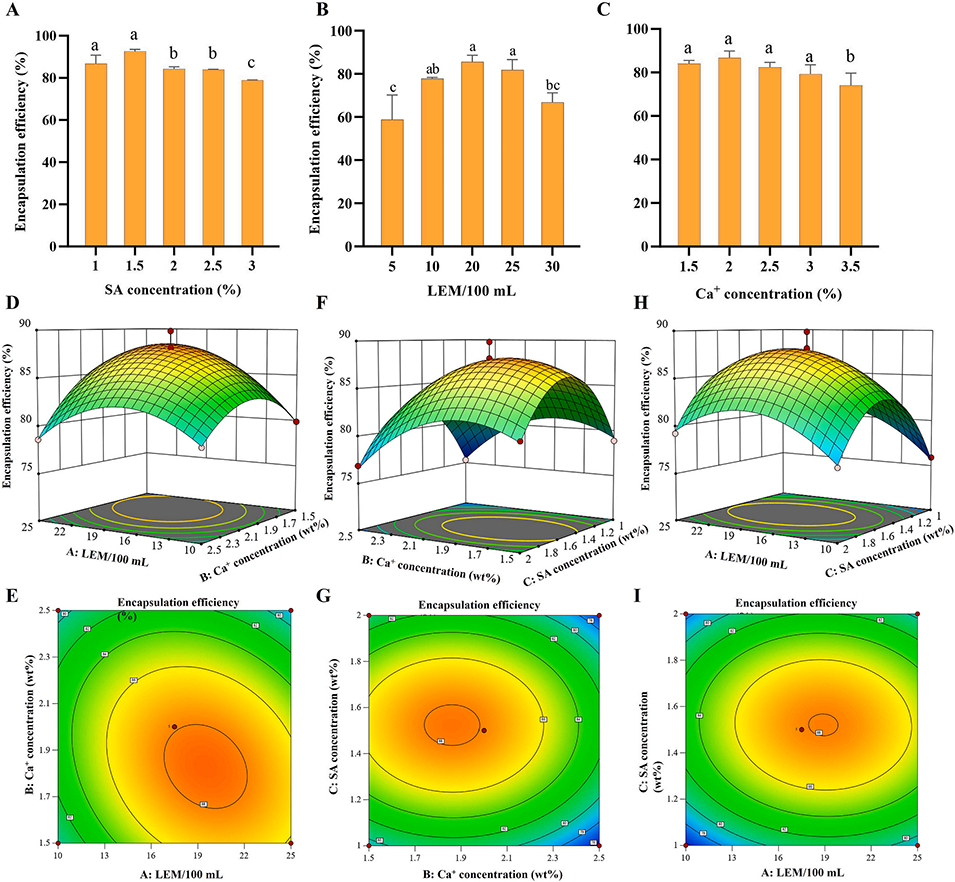
图1. 海藻酸钠(SA)浓度(A)、芳樟醇浓度(B)和氯化钙浓度(C)对芳樟醇微胶囊(LMs)包封率的影响;基于响应面理论模型优化微胶囊制备工艺的响应面图及等高线图(D-I)。注:因素 A 为每 100 mL 海藻酸钠溶液中芳樟醇-乙醇溶液的体积;因素 B 为氯化钙浓度(质量体积比);因素 C 为海藻酸钠浓度(质量体积比)。误差线代表标准误差;不同小写字母表示组间差异显著(P<0.05,Tukey 检验)。
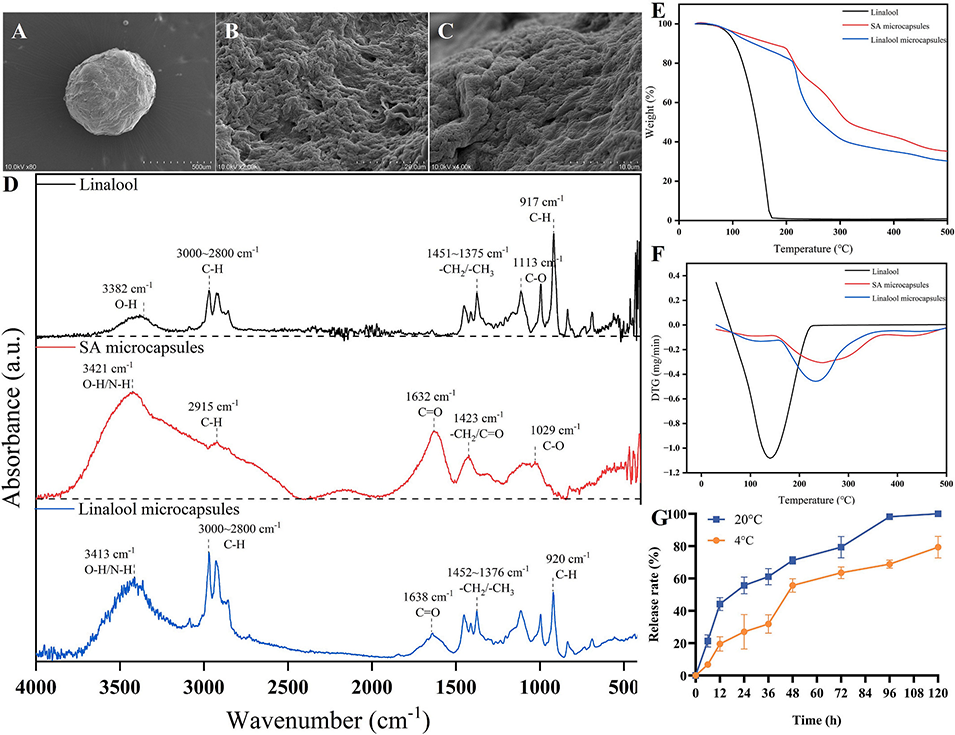
图2. 芳樟醇微胶囊(LMs)的表征结果。A-C 为不同放大倍数下 LMs 的扫描电子显微镜(SEM)图像;D 为芳樟醇、海藻酸钠空白微胶囊及 LMs 的傅里叶变换红外光谱(FTIR)图;E、F 为芳樟醇、海藻酸钠空白微胶囊及 LMs 的热重分析(TGA)曲线;G 为 LMs 的释放动力学曲线。误差线代表标准误差;每组数据为三次重复测量的均值;采用 Tukey 检验分析,统计学差异标注如下:*P < 0.05(显著差异),**P < 0.01(极显著差异)。

图3. 芳樟醇微胶囊(LMs)在 “胜利” 樱桃保鲜中的应用效果。A 为樱桃贮藏期间的外观变化;B 为腐烂率;C 为腐烂指数;D 为失重率;E 为硬度;F 为总可溶性固形物(TSS)含量;G 为可滴定酸(TA)含量;H 为总酚含量;I 为总黄酮含量;J 为过氧化氢酶(CAT)活性;K 为抗坏血酸过氧化物酶(APX)活性;L 为超氧化物歧化酶(SOD)活性;M 为苯丙氨酸解氨酶(PAL)活性;N 为几丁质酶(CHI)活性;O 为葡聚糖酶(GLU)活性。樱桃经 LMs 处理或空白对照后,于 20℃±0.5℃条件下贮藏 10 d。误差线代表标准误差;每组数据为三次重复测量的均值;采用 Tukey 检验分析,统计学差异标注如下:*P < 0.05(显著差异),**P < 0.01(极显著差异)。
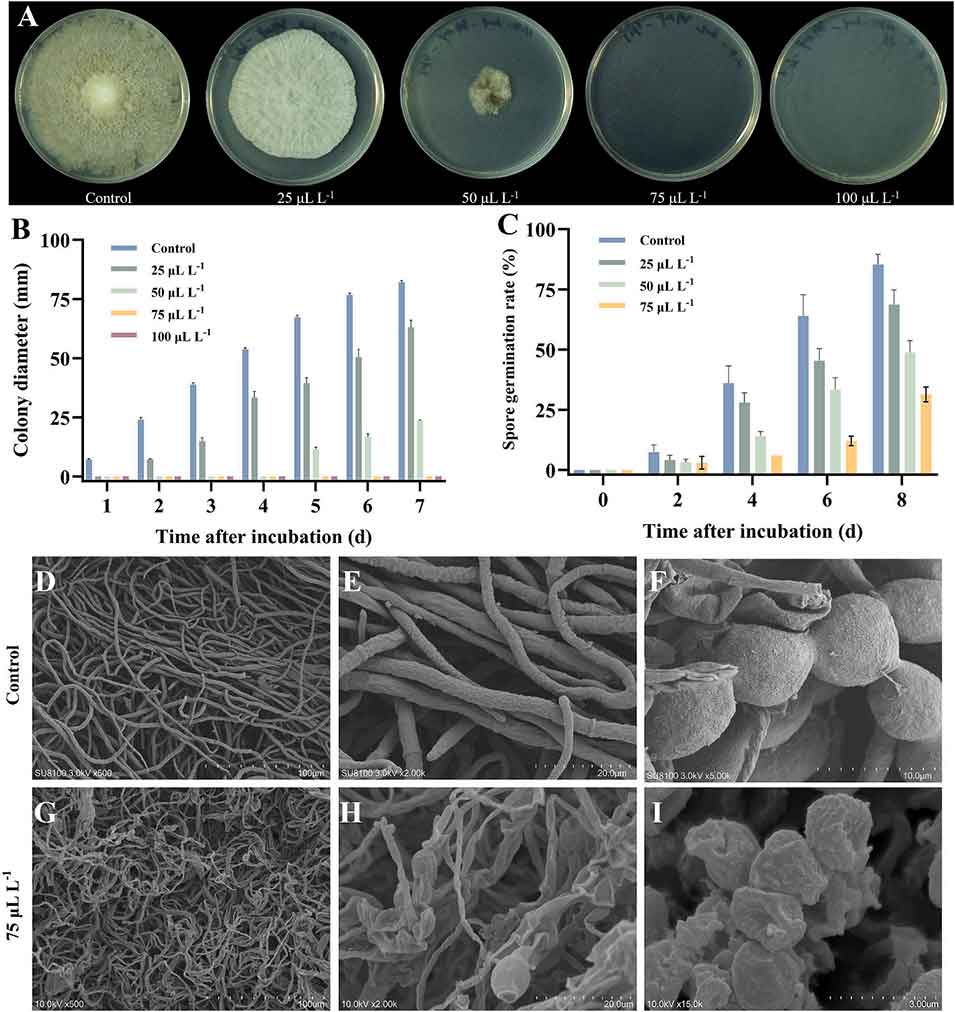
图4. 芳樟醇处理对褐腐病菌(Monilinia fructicola)菌丝生长(A)、菌落直径(B)、孢子萌发率(C)及菌丝超微结构(D)的影响。褐腐病菌菌丝经不同浓度芳樟醇(0、25、50、75、100 μL・L⁻¹)处理后,于 25℃培养;菌丝超微结构通过扫描电子显微镜(SEM)观察(处理组为 75 μL・L⁻¹ 芳樟醇熏蒸处理,对照组无处理,均于 25℃培养)。误差线代表标准误差;每组数据为三次重复测量的均值。
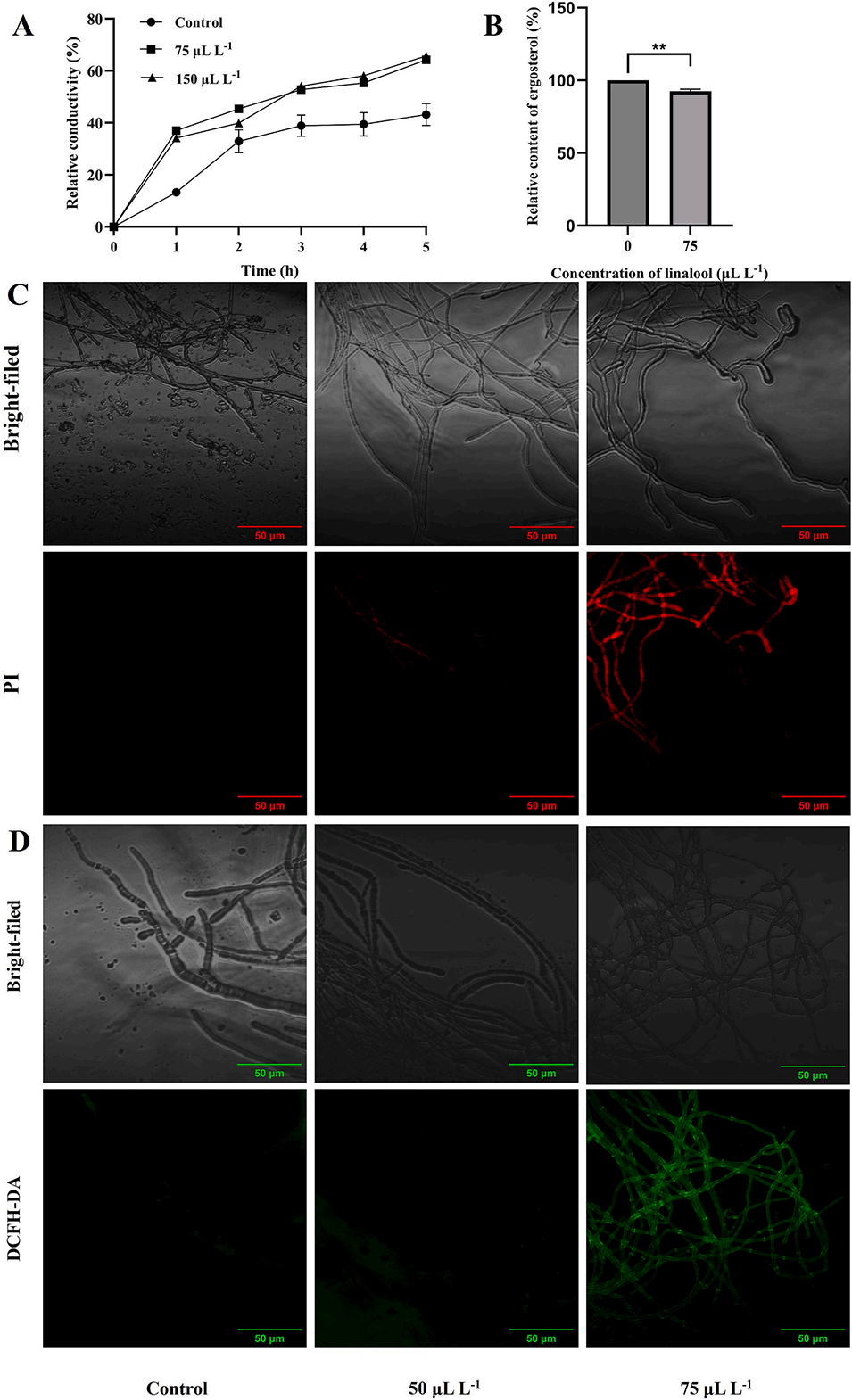
图5. 芳樟醇对褐腐病菌(Monilinia fructicola)细胞膜完整性及活性氧(ROS)积累的影响。A 为相对电导率;B 为麦角甾醇含量;C 为碘化丙啶(PI)染色结果;D 为 2′-7′- 二氯二氢荧光素二乙酸酯(DCFH-DA)染色结果。褐腐病菌菌丝经不同浓度芳樟醇(0、50、75 μL・L⁻¹)处理后,于 25℃培养。
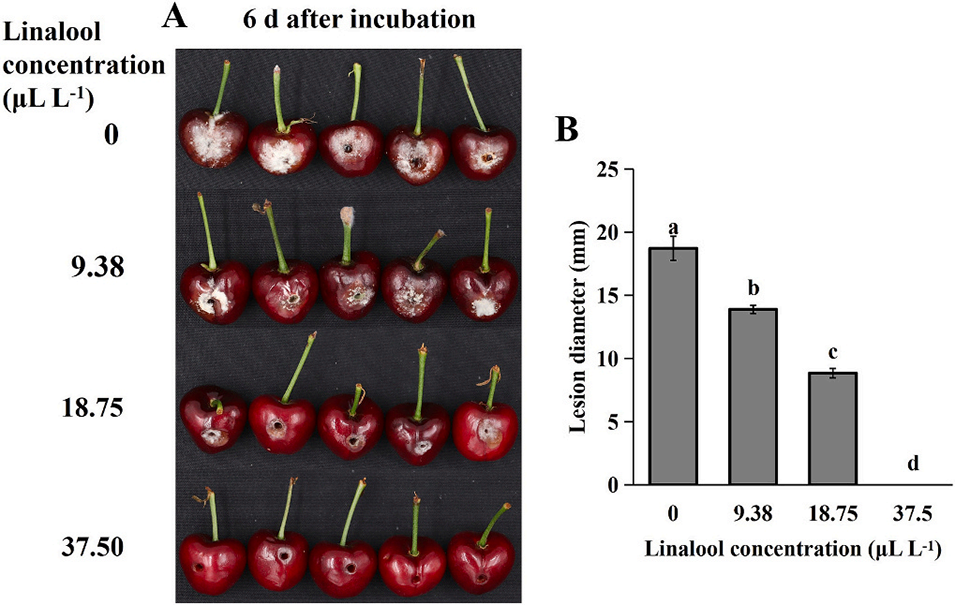
图6. 芳樟醇对 “美早” 樱桃褐腐病(由褐腐病菌 Monilinia fructicola 引起)的防治效果。A 为接种病菌 6 d 后樱桃的病害症状;B 为芳樟醇对接种褐腐病菌樱桃病斑直径的影响。误差线代表标准误差;每组数据为三次重复测量的均值;不同小写字母表示组间差异显著(P<0.05,Tukey 检验)。
论文链接:https://doi.org/10.1016/j.foodchem.2025.147821
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














