研究背景:
骨关节炎(OA)是最常见的退行性关节疾病,已被确定为老年人致残的主要原因之一,但因其关节腔血流和氧含量有限、降解过程活跃,全身药物递送难以有效治疗。临床常用的关节内注射给药(如注射润滑剂或抗炎剂)效果未达预期,虽有螺纹针灸针等创新手段改善药物递送,但OA病变微环境中存在大量活性氧(ROS)、衰老相关分泌表型(SASP)及基质金属蛋白酶(MMPs)等有害因子,且负电细胞膜、内溶酶体降解构成的生物屏障,会阻碍药物向病灶受损细胞的选择性有效递送。
现有层级微纳结构递送系统虽为组织再生提供可能,但常忽略细胞内化、溶酶体逃逸等关键环节;海洋多糖褐藻糖胶虽能模拟细胞外基质(ECM)、激发内源性抗氧化特性,但其从糖肽组装水凝胶中的释放缺乏细胞和细胞器选择性,易在细胞摄取前被不受控消耗,因此亟需构建可响应微环境、实现时空释放的精准药物递送系统,以突破OA治疗瓶颈。

导读:
近期,苏州大学骨科研究所朱雪松教授、张一健医生、杨惠林教授、侯明壮博士等人成功开发了一种受“特洛伊木马”启发的智能药物递送系统。该体系通过微流控技术构建了载药水凝胶微球,能像“特洛伊木马”一样分三步精准地将褐藻多糖硫酸酯递送至软骨病灶内部,并通过激活SIRT3显著增强软骨细胞的线粒体能量代谢,最终有效延缓了骨关节炎的进展并促进了软骨再生。相关研究以“Trojan horse-inspired spatiotemporal strategy augments cartilage regeneration by enhancing mitochondrial energy production”为题目,发表于期刊《The Innovation》。
本文要点:
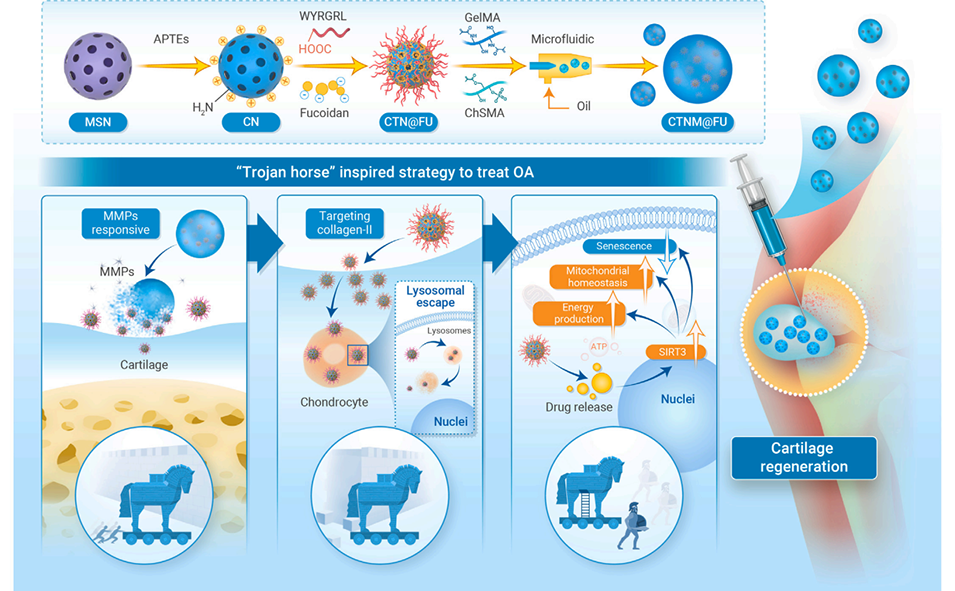
1、本研究针对骨关节炎(OA)治疗中传统关节内注射药物渗透性差、释放不可控的难题,受特洛伊木马启发,开发了一种时空策略引导的微纳递送系统CTNM@FU。
2、先通过经典水热法制备介孔二氧化硅纳米颗粒(MSN),经氨基修饰后结合软骨靶向肽(WYRGRL)和褐藻多糖硫酸酯(Fucoidan)形成CTN@FU;再利用微流控技术,将CTN@FU与光固化甲基丙烯酰化明胶(GelMA)和甲基丙烯酰化硫酸软骨素(ChSMA)复合水凝胶结合,构建出CTNM@FU。
3、CTNM@FU具备三步程序化功能:通过基质金属蛋白酶(MMPs)响应及II型胶原靶向肽(WYRGRL)主动靶向受损软骨;有效穿透软骨基质并进入软骨细胞;逃逸溶酶体降解并释放Fucoidan。
4、实验表明,CTNM@FU能显著逆转受损软骨代谢,延缓软骨退变并促进新生软骨形成。
5、其作用机制与激活SIRT3、增强线粒体能量合成、抑制细胞衰老密切相关。该时空引导策略为退行性关节疾病的精准治疗提供了新途径。
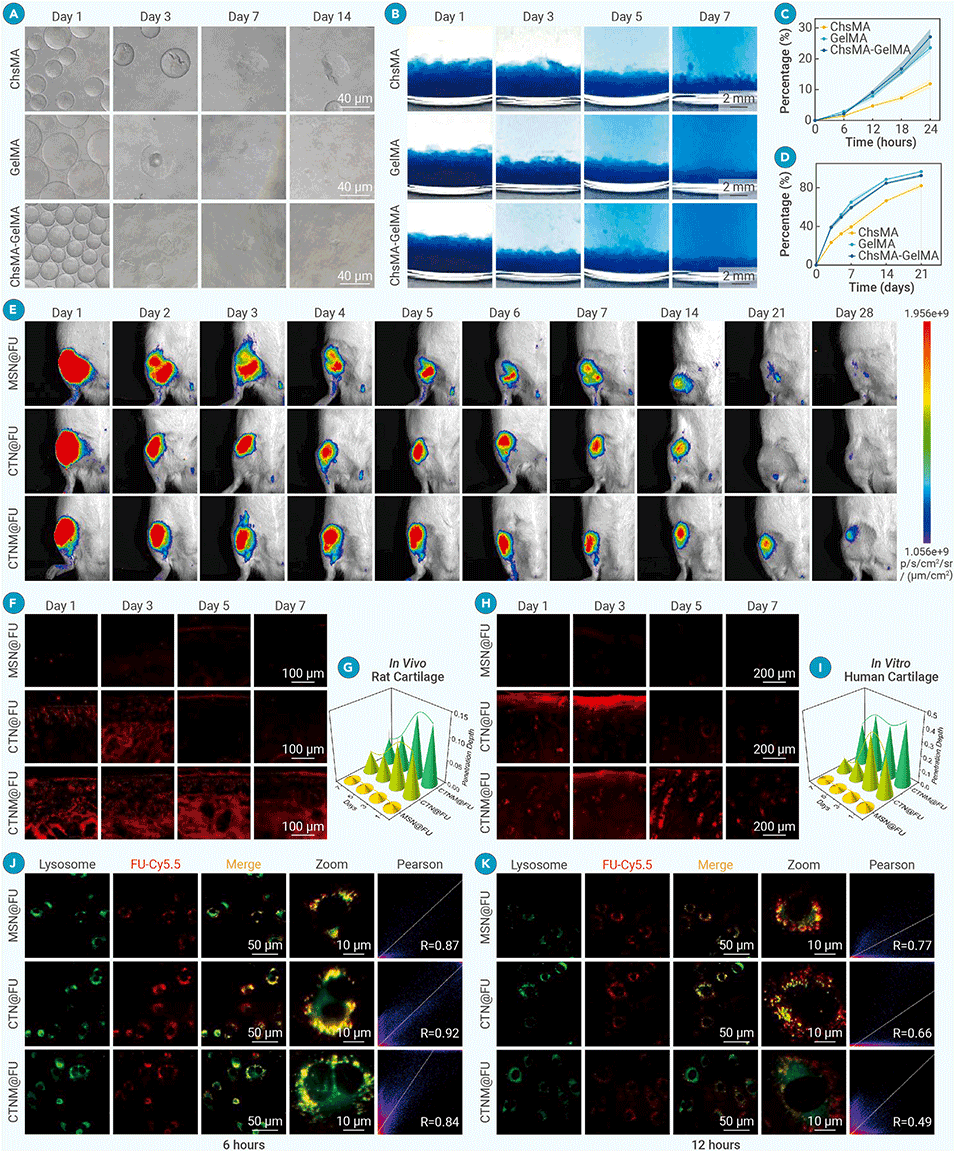
图1. 受特洛伊木马启发的CTNM@FU三步式转运、渗透与逃逸过程
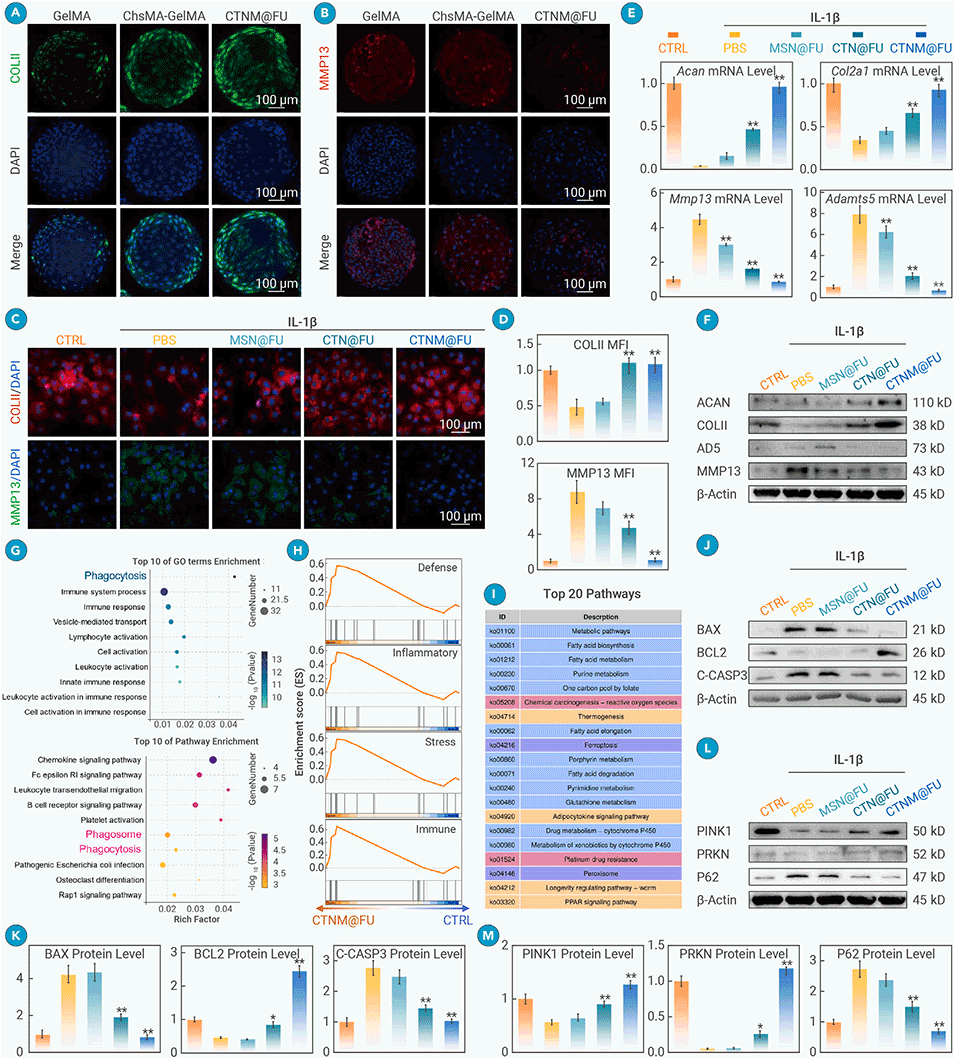
图2. CTNM@FU通过抑制线粒体凋亡并促进线粒体自噬,进而促进软骨合成代谢
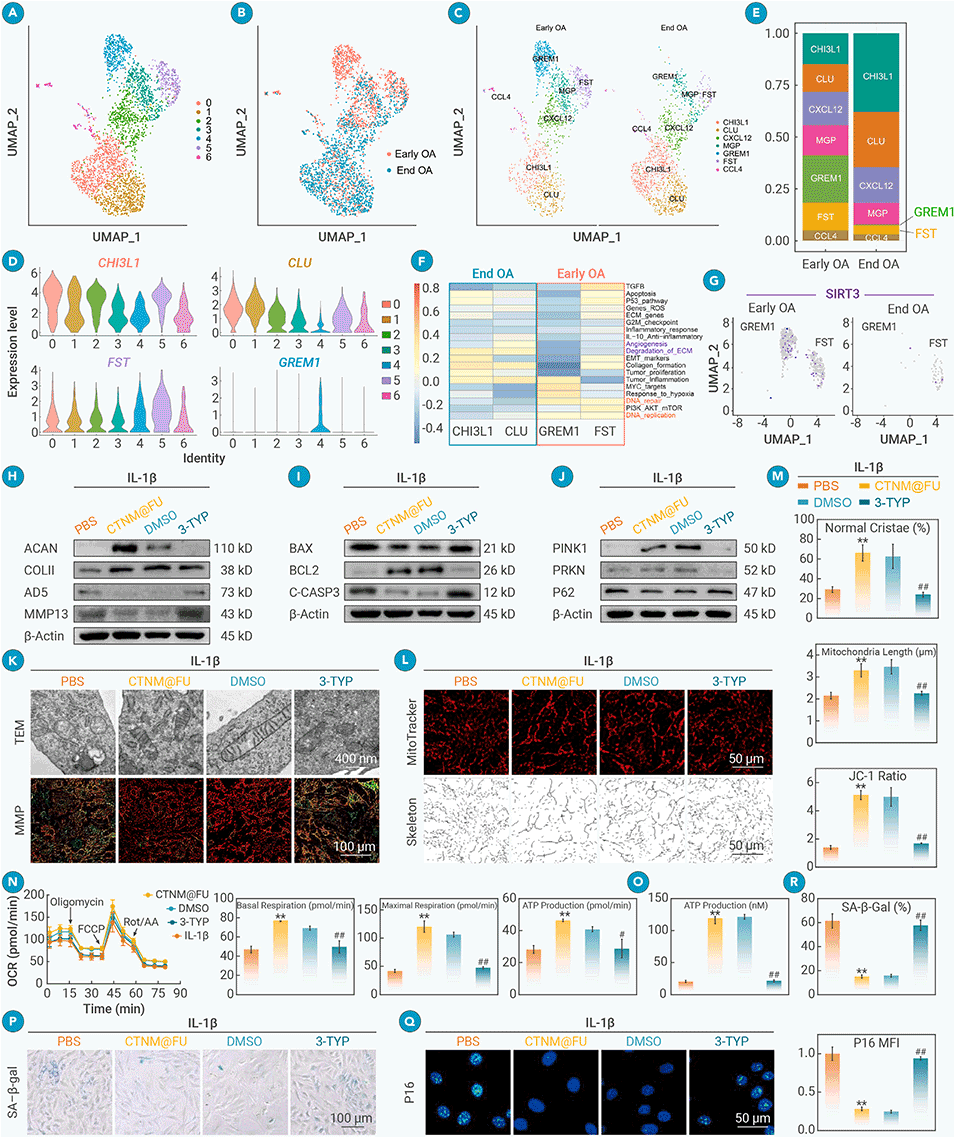
图3. CTNM@FU的软骨保护作用依赖于线粒体SIRT3(沉默信息调节因子3)
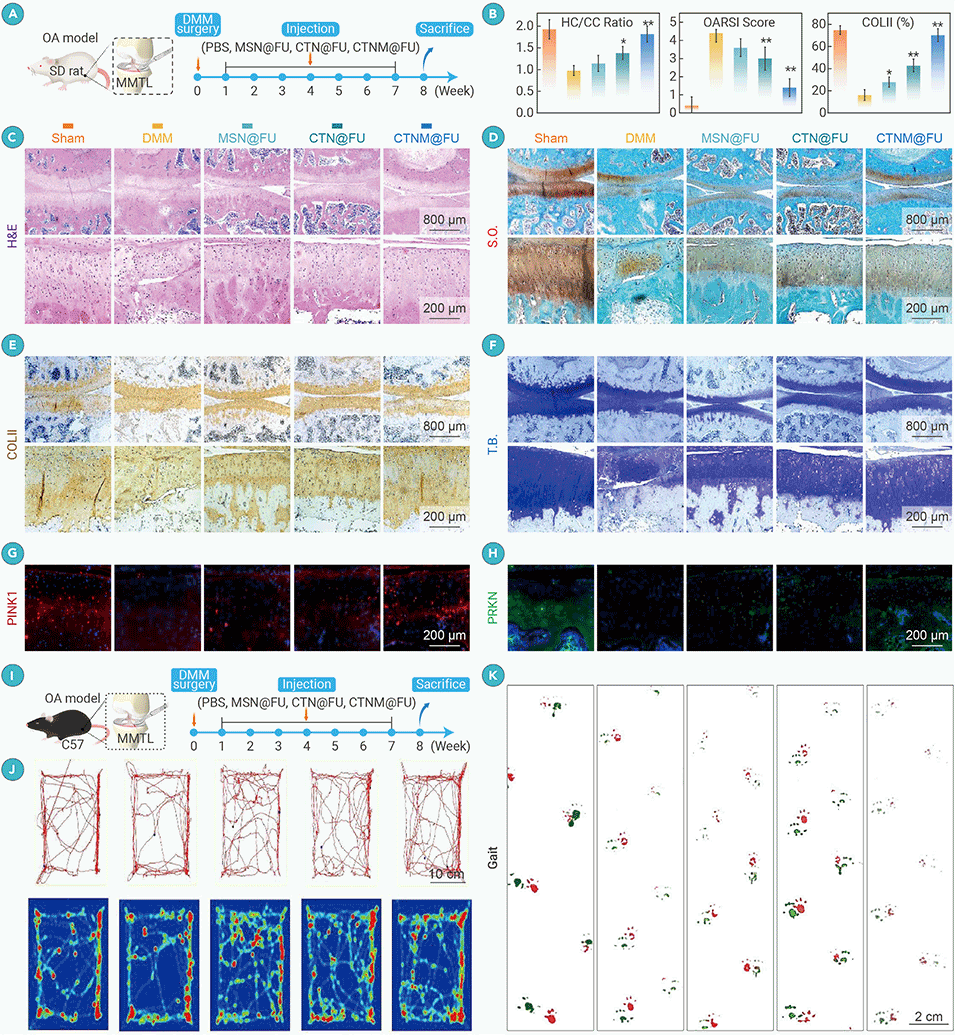
图4. CTNM@FU在手术诱导的创伤后骨关节炎(OA)模型中减轻软骨退变
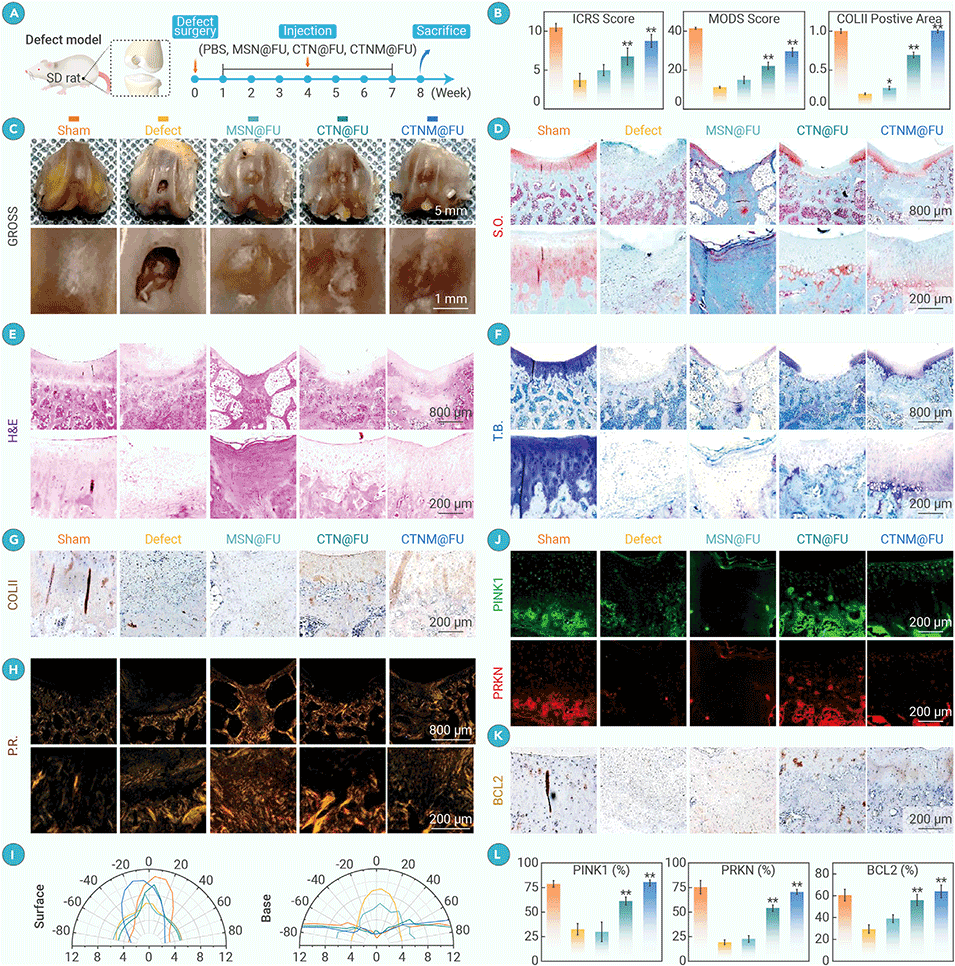
图5. CTNM@FU在全层软骨缺损模型中促进软骨再生
论文链接:https://doi.org/10.1016/j.xinn.2025.100913
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














