组织工程虽为移植用生物人工器官研发带来希望,但受限于组织构建体中微血管网络难以建立,工程化组织尺寸较小,无法满足临床需求。传统自上而下的组织工程方法(如细胞接种到支架)难以实现精准细胞定位和高血管化结构,而自下而上的方法(如球状微组织组装)在毛细血管网络密集排列方面存在挑战。

近期,有研究人员通过预设挤出生物打印与微流控乳化技术,成功制备出内皮细胞覆盖的核壳结构球形微组织,并将其组装后结合培养基灌注培养,构建出高血管化、高细胞密度的体积组织,该组织可在体外稳定培养7天,为临床级人工器官的开发提供了关键基础技术。相关研究以“Engineering Volumetric Tissue Analogs via Assembly of Endothelial Cell-Covered Spheroidal Microtissues”为题目,发表于期刊《Advanced Healthcare Materials》。
本文要点:
1、本研究提出了一种新策略:通过组装内皮细胞覆盖的球状微组织来构建具有功能化微血管网络的三维组织。
2、利用预设挤出式生物打印与微流控乳化技术,成功制备了具有核-壳结构(内皮细胞覆盖表面)的球状微组织,其结构完整性显著优于非结构化的混合细胞微组织。
3、将这些微组织组装后,微组织之间的空隙形成了内皮化的通道网络,可作为微血管。
4、在灌流培养条件下,培养基可流经这些通道,有效输送营养和氧气,从而支持了大体积、高细胞密度组织的体外培养长达7天。该技术为制造可用于移植的人工器官奠定了重要基础。
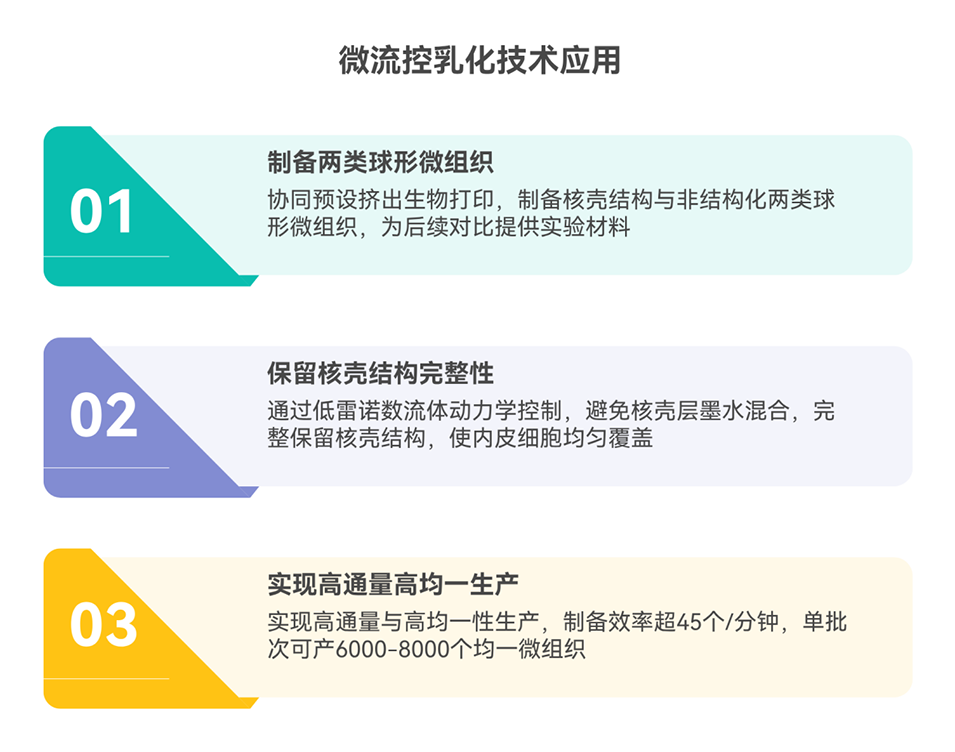
本研究的创新点主要体现在以下三个方面:
核壳结构设计:针对性设计“内皮细胞(hy926)壳+肝实质细胞(HepG2/C3A)核”的球形微组织,壳层内皮细胞既提供结构边界(维持微组织形态稳定),又为后续组装形成微血管通道奠定基础,解决非结构化微组织融合无间隙的问题;
高效制造技术:结合预设挤出生物打印与微流控乳化,实现核壳微组织的高通量生产(>45个/分钟,单批次6000-8000个),且微组织尺寸均一、结构完整(内皮细胞覆盖率>95%);
灌注培养调控:设计3D打印PCL灌注腔室,通过控制培养基流速,确保组装后的微组织间隙不被融合填充,形成功能性微血管通道,实现全组织营养/氧气供应,避免深层细胞坏死。
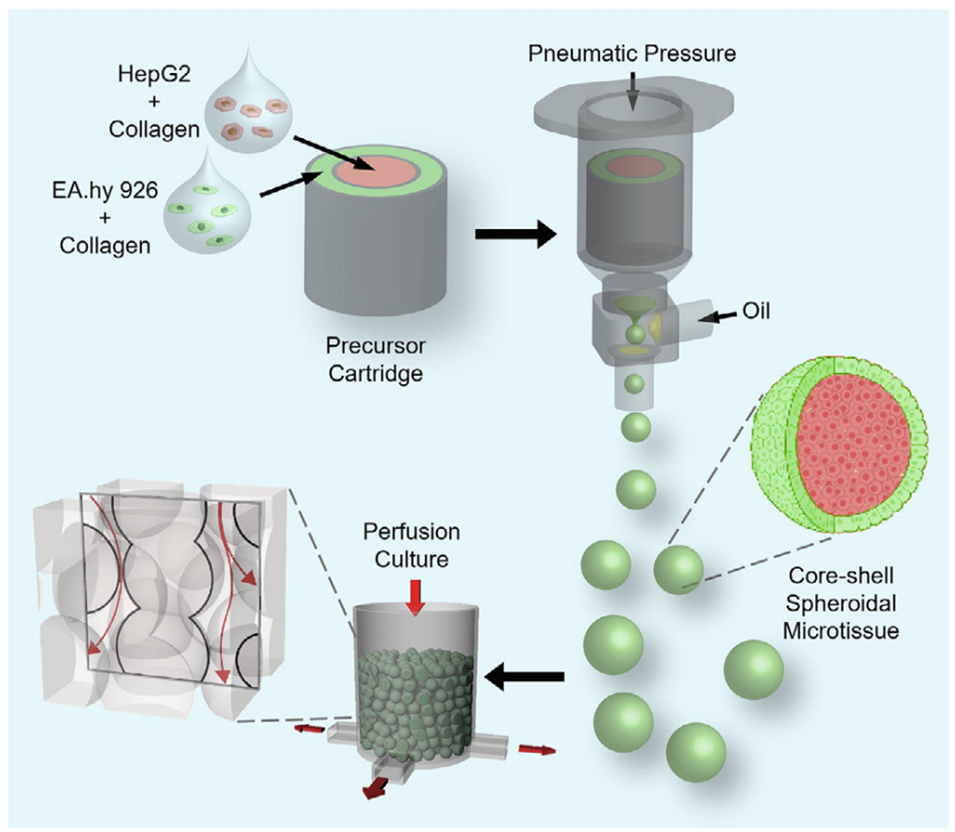
图1. 研究策略示意图。通过预设挤出生物打印与微流控乳化系统相结合,制备核-壳结构球状微组织,再以此构建体积血管化组织构建体。将组装后的微组织置于 3D 打印培养舱内,在灌注条件下培养,以促进微血管形成,并确保营养物质输送至整个组织构建体。
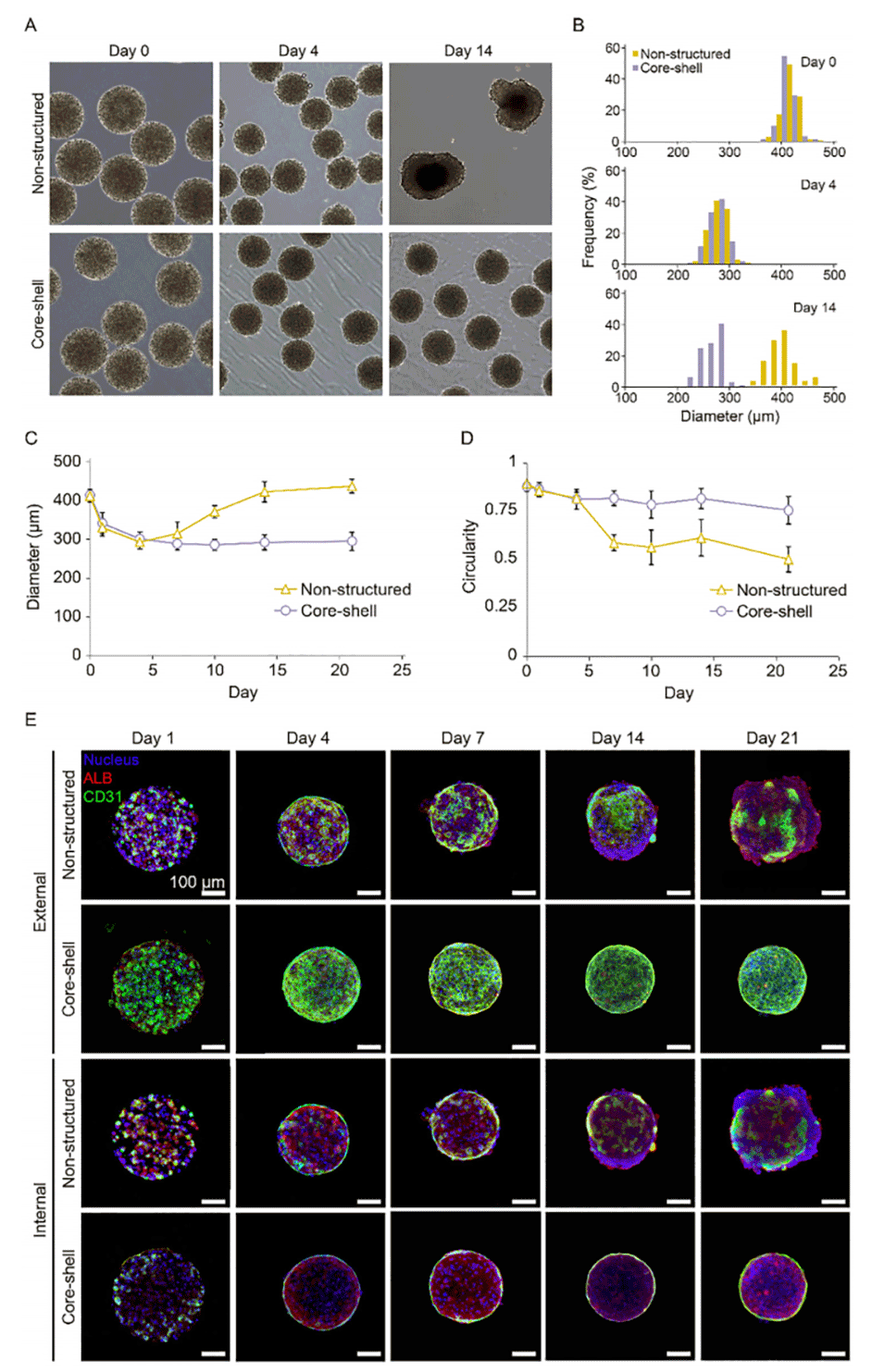
图2. 核-壳结构与非结构化球状微组织的长期结构对比。该对比凸显了二者在形态与稳定性上的差异。A)非结构化与核-壳结构球状微组织在第 0 天、第 4 天和第 14 天的明场显微镜图像。B)直径分布定量分析(n=80)。C)非结构化与核-壳结构球状微组织随时间变化的直径数据(n=30)。D)非结构化与核-壳结构球状微组织随时间变化的圆形度测量结果(n=50)。数据以平均值±标准差(SD)表示。E)第 1 天、第 4 天、第 7 天、第 14 天和第 21 天,非结构化与核-壳结构球状微组织表面及横截面的免疫荧光染色图像。
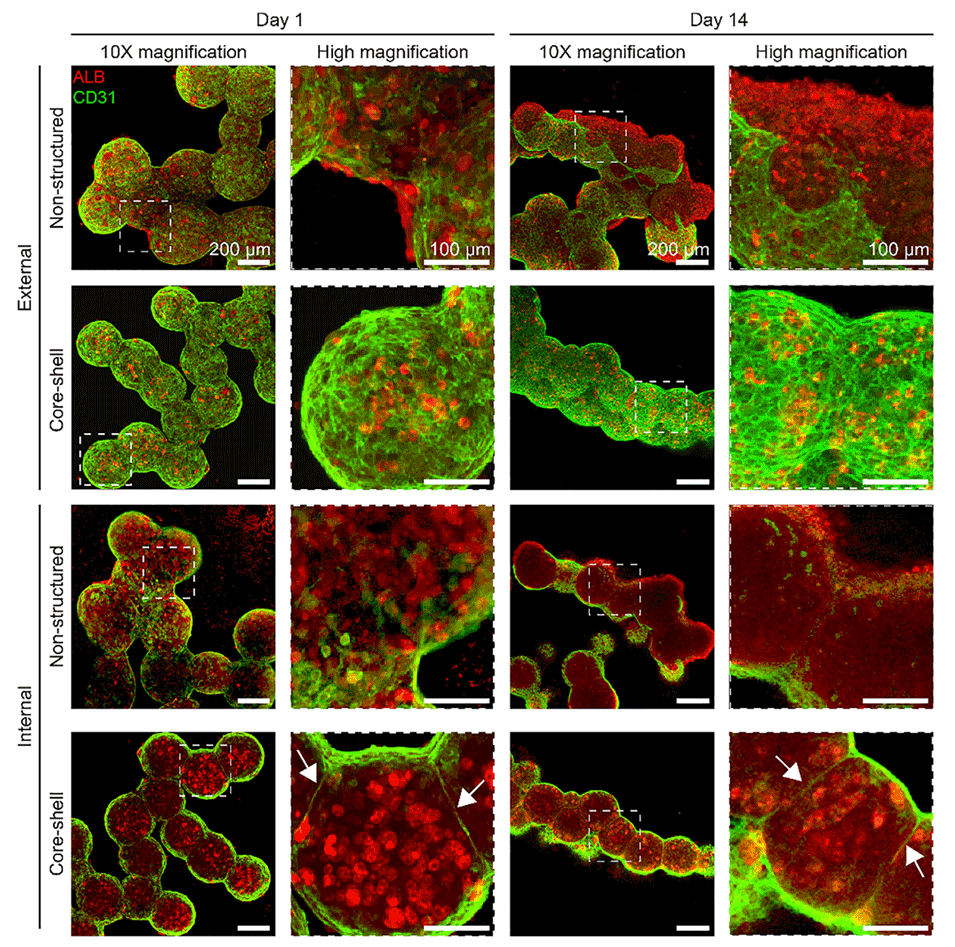
图3. 球状微组织聚集体的免疫荧光染色(展示第 1 天和第 14 天核-壳结构与非结构化球状体的结构对比)。可观察到二者在形态、稳定性及细胞排列上的差异。第一行和第二行分别为非结构化与核-壳结构球状微组织形成聚集体的表面视图;第三行和第四行为通过共聚焦显微镜拍摄的聚集体中部横截面视图。第二列和第四列是第一列和第三列中白色方框标注区域的放大图像。白色箭头指示核-壳结构球状微组织组中 HepG2/C3A 细胞与 EA.hy926 细胞之间维持的空间分离状态。
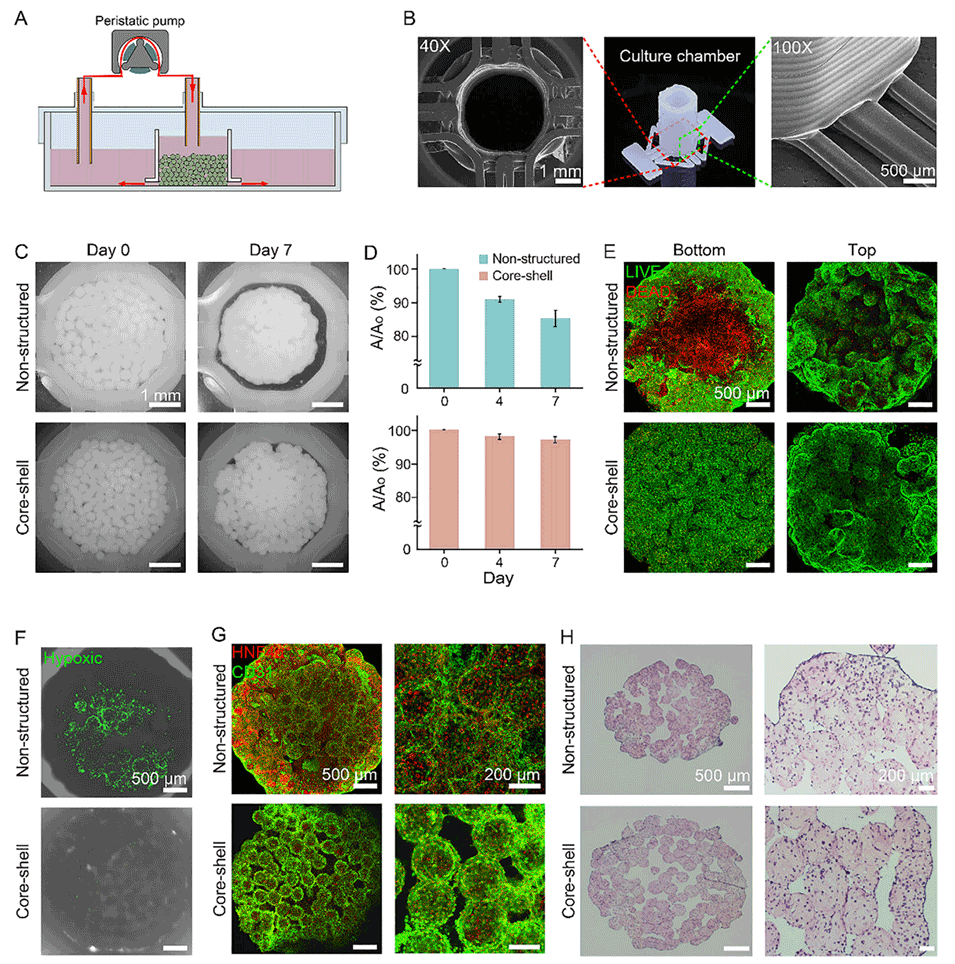
图4. 灌注培养条件下,非结构化与核-壳结构球状微组织构建体的结构差异。A, B)定制化灌注培养系统的示意图,以及 3D 打印聚己内酯(PCL)培养舱的实物图(A)和扫描电子显微镜(SEM)拍摄的培养舱微观结构图像(B)。C)组织构建体底部区域在第 0 天和第 7 天的明场图像。D)底部区域面积随时间变化的定量分析,数据以平均值±标准差(SD)表示(n=3)。E)第 7 天组织构建体顶部和底部区域的活/死染色图像。F)第 7 天组织构建体底部区域的缺氧染色图像。G)第 7 天组织构建体底部区域的免疫荧光染色图像(4 倍和 10 倍放大)。H)第 7 天组织构建体顶部和底部切片的苏木精-伊红(H&E)染色图像。第一行展示非结构化球状微组织构建体的代表性 4 倍和 10 倍放大图像,第二行展示核-壳结构球状微组织构建体的对应图像。
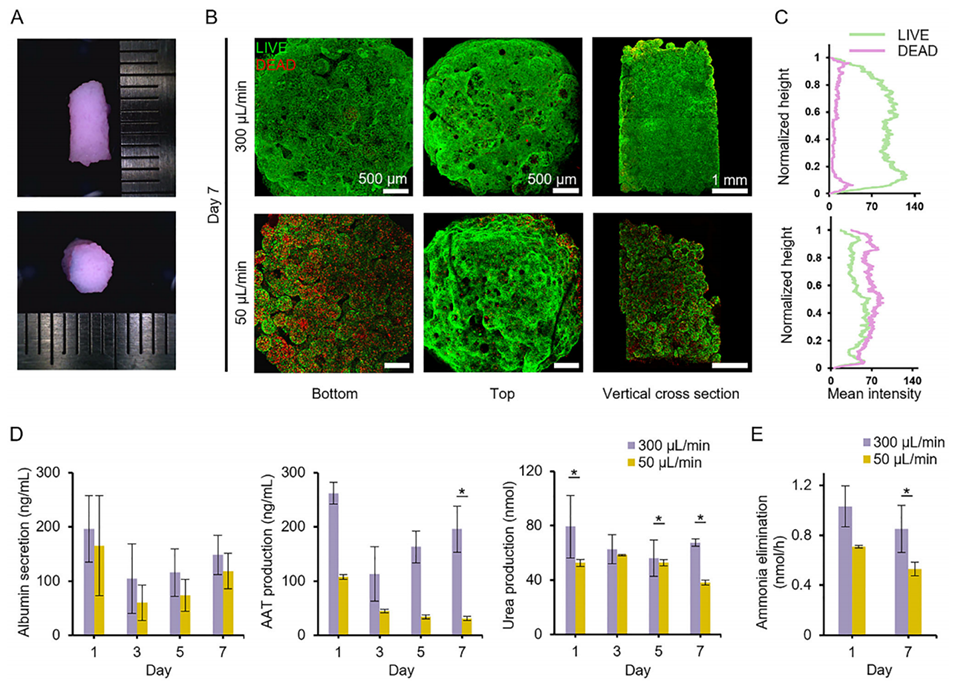
图5. 体积组织的培养结果及培养基灌注速率的影响研究。A)利用核-壳结构球状微组织构建的体积组织结构照片。B)不同培养基灌注速率下,体积组织结构的细胞活力评估。C)活细胞与死细胞沿组织结构高度方向的分布情况。D)组织结构产生白蛋白、α-1 抗胰蛋白酶(AAT)和尿素的能力评估(n=3)。E)不同灌注速率下,核-壳结构球状微组织构建的体积组织从培养基中清除氨的能力对比。数据以平均值±标准差(SD)表示(n=3)。星号表示 300μL/min 组与 50μL/min 组之间存在显著差异(p<0.05)。
论文链接:https://doi.org/10.1002/adhm.202502418
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














