
导读:
单细胞分析对于理解细胞异质性、识别单个细胞独特生物学特征及体外细胞培养至关重要。液滴微流控技术是一项极具潜力的技术,能够高通量、高灵敏度地分离和检测生物颗粒。近期,河北工业大学勾易行副教授、哈尔滨工业大学机电工程学院任玉坤教授发表综述,系统梳理了微流控平台中被动式(依托通道几何设计)与主动式(借助电场、磁场等外场)两类液滴生成方法,详解了液滴合并、分选、混合、分裂的核心操控技术,同时重点阐述了该技术在循环肿瘤细胞分析、细菌检测及3D细胞培养等生物医学领域的最新应用进展,并探讨了其在技术标准化、多功能集成等方面的挑战与未来发展方向。相关研究成果以“Development of droplet-based microfluidics in generation, manipulation and biomedical application”为题目,发表在期刊《Microchemical Journal》上。
文章亮点:
1、系统综述了液滴生成的主要机制及其最新力学原理。
2、介绍了典型的液滴操控方式,如合并、分选、混合、分裂及其最新操作技术。
3、总结了液滴微流控技术在循环肿瘤细胞(CTC)检测、细菌分析和三维细胞培养等生物医学领域的最新应用。
4、最后,讨论了液滴微流控技术的现存挑战和未来发展方向。
一张图读懂全文:

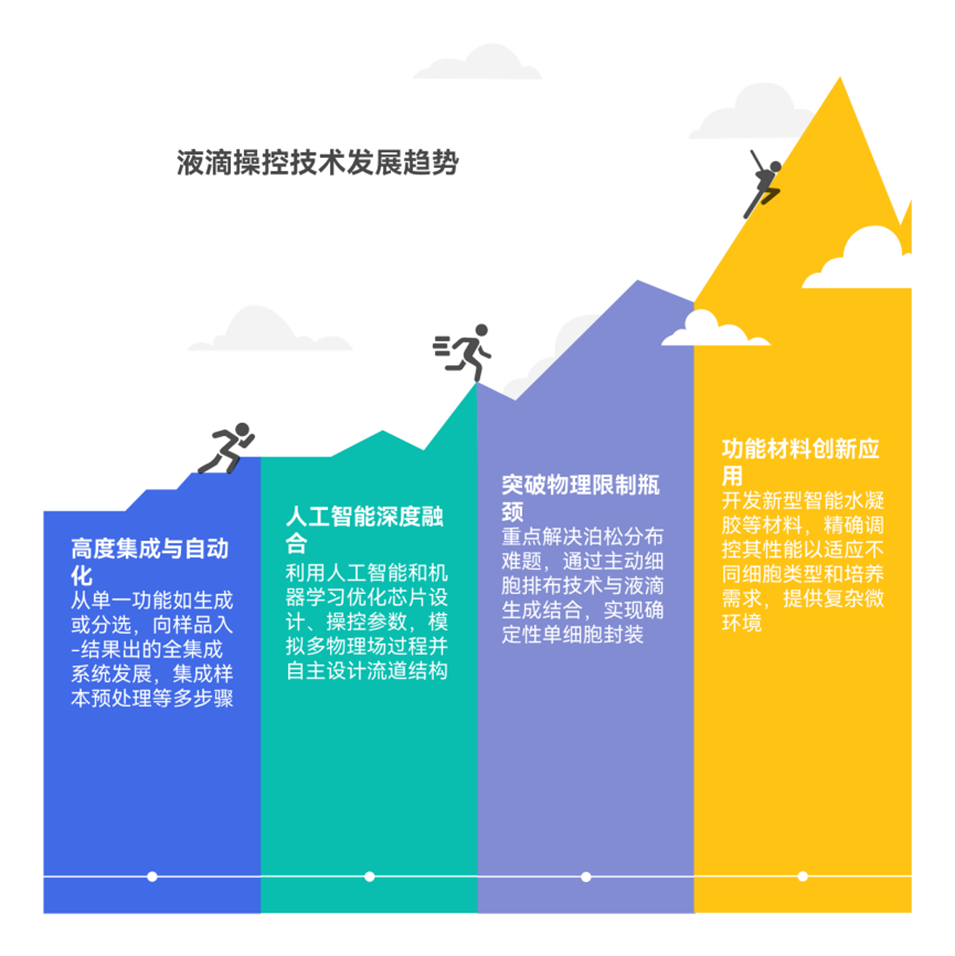
“泊松分布限制”是液滴微流控技术在单细胞封装时面临的根本性挑战。当细胞随机进入液滴时,会导致大量空滴(无细胞)和少量多细胞液滴,这不仅降低通量,更严重影响单细胞分析的准确性(如CTC突变检测或细菌耐药性分析)。
泊松分布是一种统计与概率学里常见的离散概率分布,无法完全消除,但可以通过技术手段将其影响最小化,使其分布更趋近于“单细胞占主导”的理想情况。具体如下:
- 主动细胞操控与排序:在封装前,先利用芯片上的其他物理场对细胞进行“预处理”。例如,结合介电泳(DEP)或声场(如声流聚焦)等技术,在通道内对细胞进行精确排布,使其以更均匀的间距进入液滴生成区,从而大幅提高单细胞封装率。
- 基于图像的实时反馈与分选:生成液滴后,利用高速成像技术实时识别每个液滴的内容物。随后通过荧光激活液滴分选(FADS)或其他主动分选技术(如声场、电场),将含单细胞的液滴准确地分选出来,同时丢弃空滴和多细胞液滴。这是一种“事后补救”但非常有效的策略。
- 单细胞捕获与确定性封装:开发新型结构,在液滴生成前确定性地捕获单个细胞。例如,设计微腔室或窄通道结构,确保每个捕获位点只容纳一个细胞,随后通过流体切换将捕获的细胞冲洗并包裹进入新生成的液滴中。这种方法可以近乎完美地规避泊松分布,但可能以牺牲部分通量为代价。
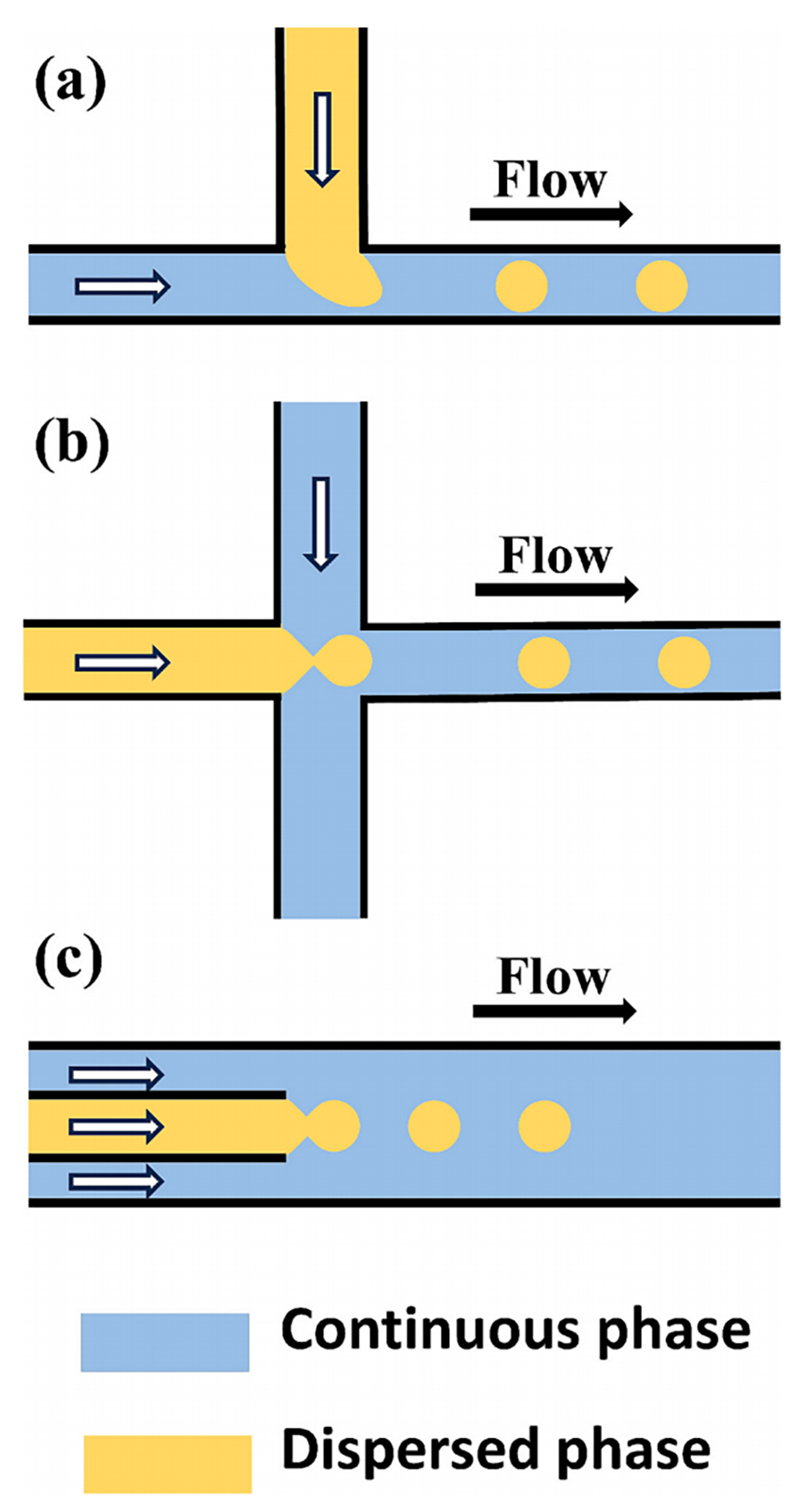
图1. 不同结构的微流控液滴生成装置。(a)T 型结结构;(b)流动聚焦结构;(c)同轴聚焦结构
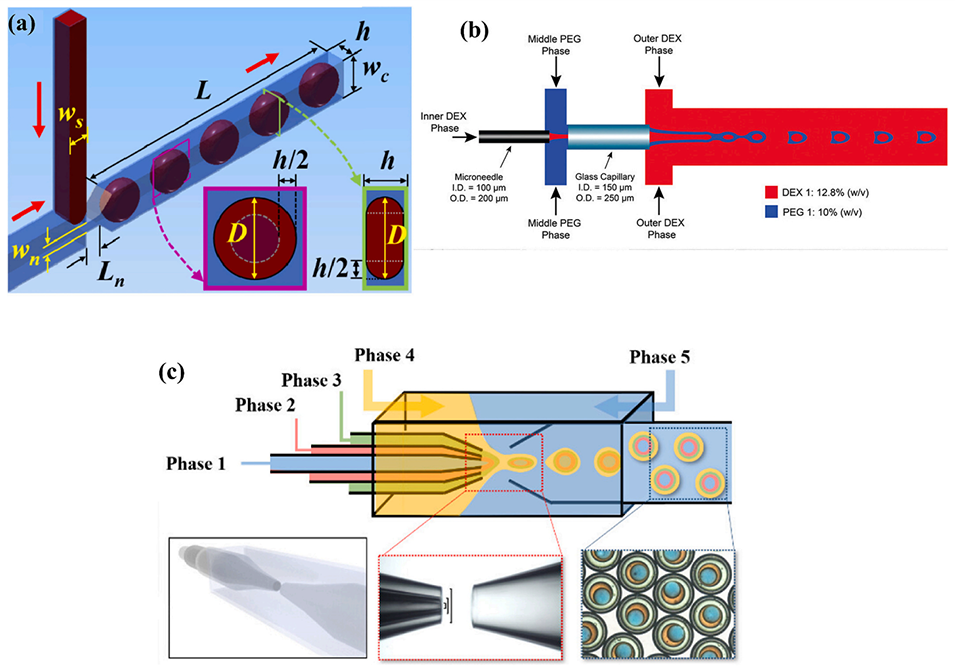
图2. 被动式微流控液滴生成。(a)带颈部的 T 型结结构示意图;(b)用于制备双乳液的混合装置示意图;(c)用于制备多重乳液液滴的同心毛细管微流控装置
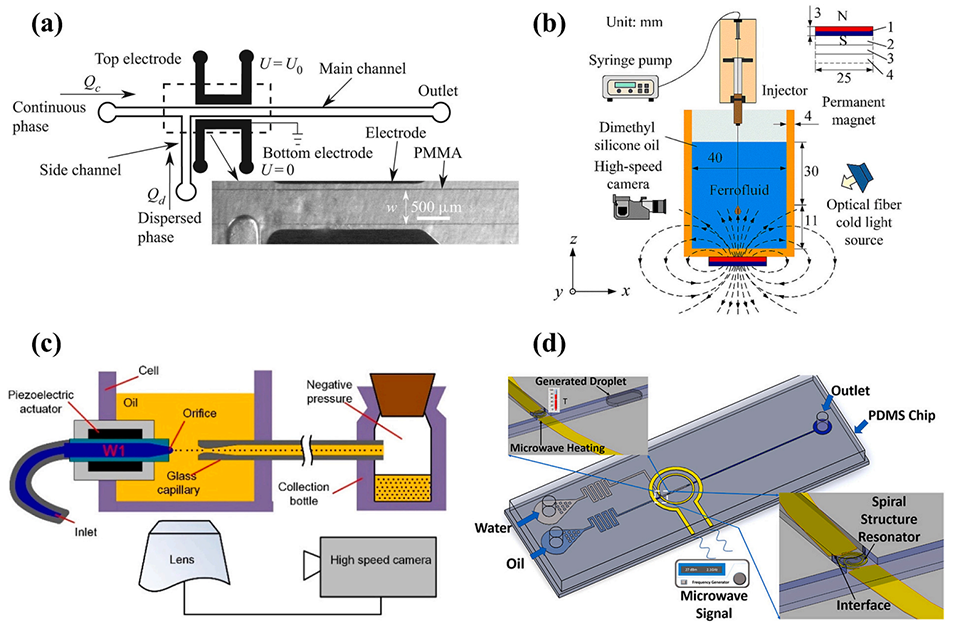
图3. 主动式微流控液滴生成。(a)含两个非接触电极的 T 型微流控装置示意图;(b)在毛细管中利用磁场生成铁磁流体液滴的示意图;(c)通过压电驱动器在微流控装置中实现主动式飞升(飞升,体积单位,10⁻¹⁵升)级液滴生成的示意图;(d)集成微波加热器的微流控芯片示意图
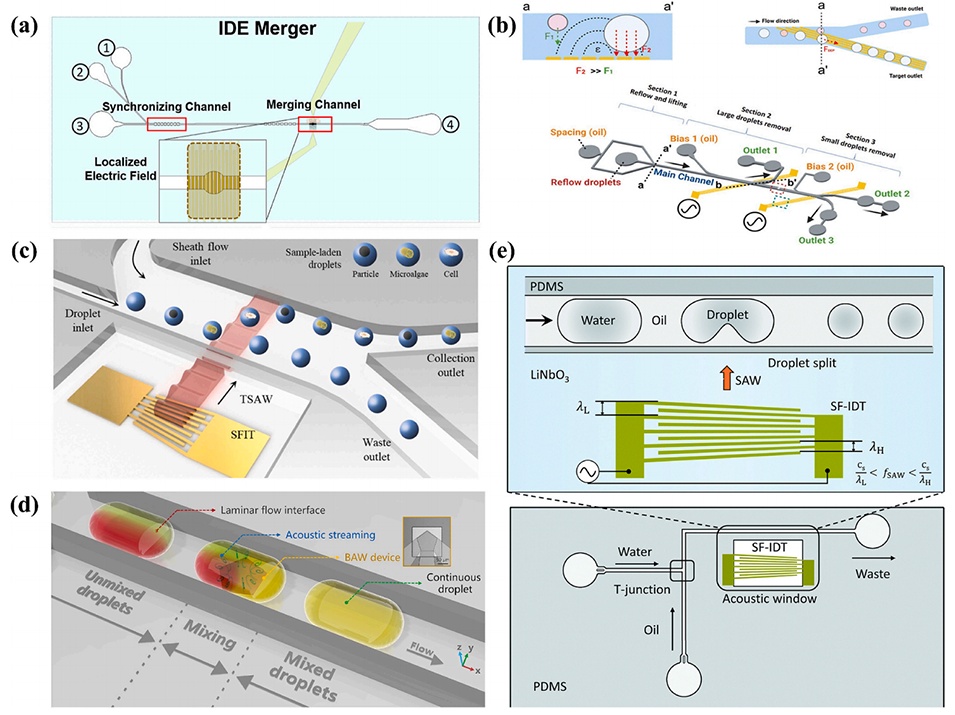
图4. 典型液滴操控。(a)基于叉指电极(Interdigitated Electrode, IDE)的液滴合并结构示意图;(b)利用叉指电极产生的介电泳力(DEP force)与液滴浮力现象实现的基于尺寸的液滴分选装置示意图;(c)基于行波表面声波(Traveling Surface Acoustic Wave, TSAW)诱导声辐射力(Acoustic Radiation Force, ARF)的声流控液滴分离芯片示意图;(d)通过吉赫兹(GHz)频段声流涡旋实现液滴混合的示意图;(e)含聚二甲基硅氧烷(Polydimethylsiloxane, PDMS)微通道与斜指型叉指换能器(Slanted-Finger Interdigitated Transducer, SF-IDT)的声微流控液滴分裂装置示意图
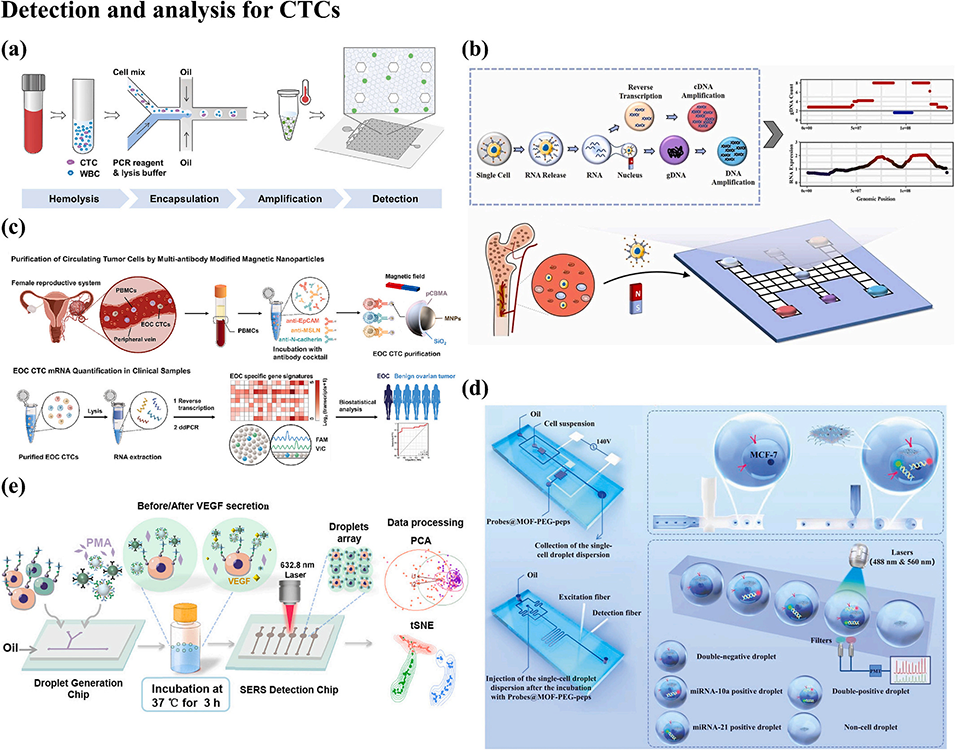
图5. 基于液滴微流控技术的循环肿瘤细胞(CTC)检测与分析平台。(a)基于分区策略的循环肿瘤细胞数字定量分析流程;(b)基于数字微流控的纳米级单细胞多组学样本制备平台;(c)基于多抗体修饰磁性纳米颗粒的循环肿瘤细胞纯化及上皮性卵巢癌检测的分子分析流程;(d)纳米级数字液滴微流控流式细胞仪(Nano-DMFC)的原理示意图,该仪器含样本处理单元与微小 RNA(miRNA)检测单元,可实现单个细胞的液滴封装、纳米传感器微注射及单个 CTC 内多微小 RNA 的荧光检测;(e)基于细胞表面生物偶联策略的单细胞预处理及微滴表面增强拉曼光谱(SERS)检测单细胞分泌血管内皮生长因子(VEGF)的流程
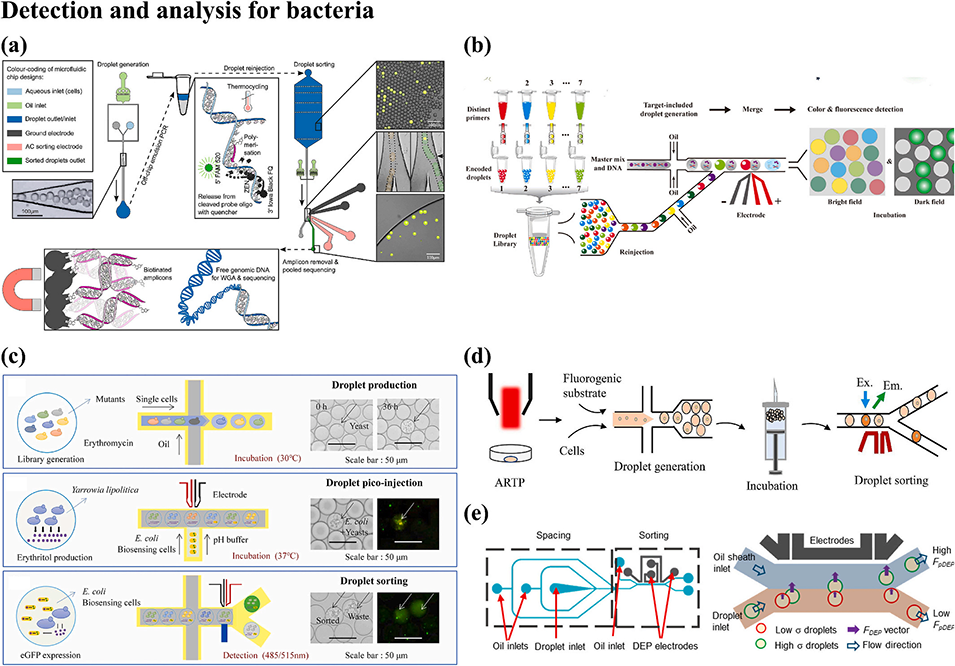
图6. 基于液滴微流控技术的细菌筛选平台。(a)利用液滴微流控富集肠道菌群菌株以实现未培养基因组测序的流程;(b)基于 CRISPR/Cas13a 的一步式液滴微流控目标细菌识别与定量系统;(c)基于赤藓糖醇转录因子的生物传感器系统 ——FADS 平台(荧光激活液滴分选平台)的高通量筛选流程;(d)基于介电泳分离的集成化无标记液滴分选平台(用于评估细菌耐药性);(e)基于液滴微流控的工业产酶菌株高通量筛选流程
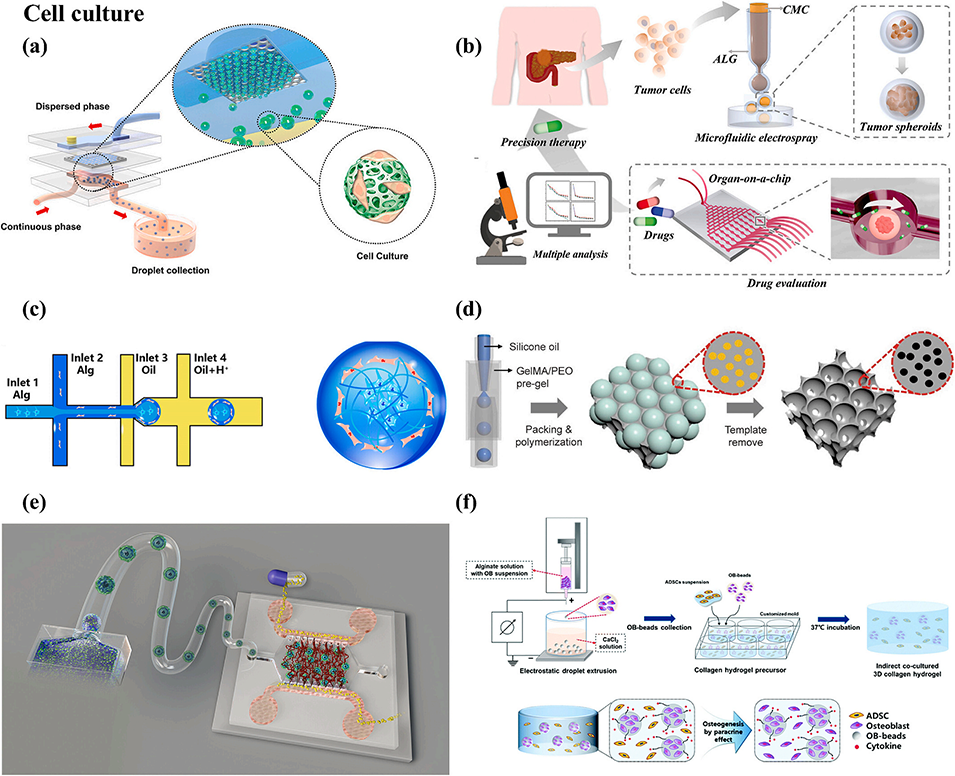
图7. 基于液滴微流控的细胞培养平台。(a)用于高通量制备单分散水凝胶微球的集成微通道板结构示意图;(b)集成水凝胶微球的药物评价用微流控芯片;(c)利用 “双” 流动聚焦微流控装置制备核 - 壳结构液滴的水凝胶微球示意图;(d)基于反蛋白石支架(Inverse Opal Scaffold)的器官芯片(Organ-on-a-Chip)肿瘤球生成平台;(e)用于临床前药物筛选的血管支持型异质性肿瘤模型示意图;(f)基于水凝胶的三维间接共培养系统示意图
论文链接:https://doi.org/10.1016/j.microc.2025.113101
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














