
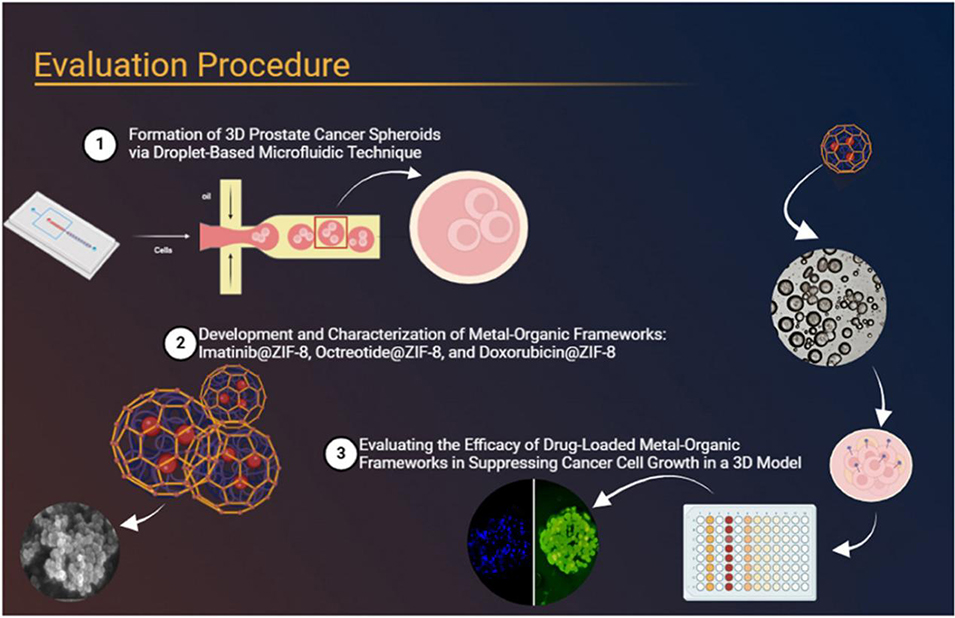
导读:
3D细胞培养模型(尤其是球状体)已成为临床前药物评估中极具潜力的动物模型替代方案。相较于传统的2D培养,这类模型能更精准地模拟肿瘤微环境的实际状况。近期,有研究人员采用液滴微流控技术构建前列腺癌细胞(PC3)球状体,以此评估伊马替尼、奥曲肽、多柔比星三种药物负载的ZIF-8金属有机框架(Drug@ZIF-8 MOFs)的疗效,证实这类载药体系因pH响应性与持续释药特性,对癌细胞的抑制效果优于游离药物,且微流控制备的3D模型比2D模型更贴合真实肿瘤微环境,能更精准反映药物作用。相关研究以“Advancing preclinical drug evaluation: Assessing drug-loaded metal-organic frameworks in droplet-based microfluidics for prostate cancer treatment”为题目,发表于期刊《Materials Today Advances》。
本文要点:
1、本研究利用液滴微流控技术构建前列腺癌细胞(PC3)球状体,以此评估载药金属有机框架(Drug@ZIF-8 MOFs)的作用效果。
2、研究结果表明,负载伊马替尼、奥曲肽或多柔比星的ZIF-8相比游离药物能更有效抑制癌细胞生长,这源于药物持续释放及ZIF-8对酸性肿瘤微环境的敏感性。
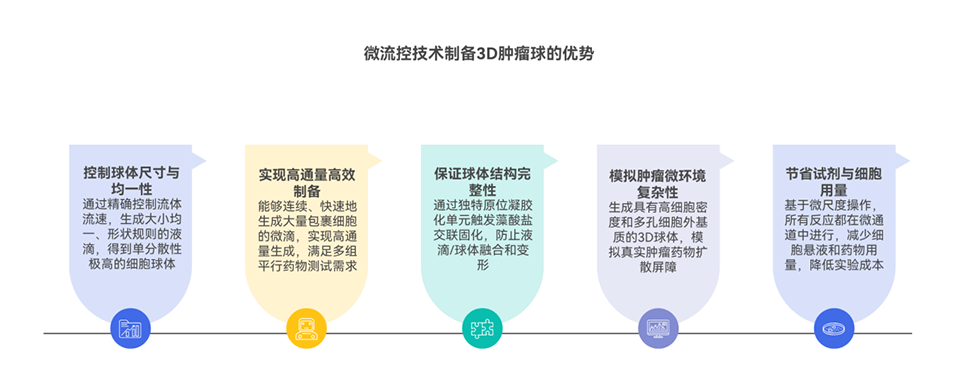
3、三维培养模型较二维模型更真实模拟肿瘤微环境复杂性,更适合用于药物尤其是Drug@ZIF-8 MOFs体系的效力评估。该研究突显了三维模型在推进抗癌策略临床前研究中的重要性。
本研究采用了三种理化性质迥异的药物(Dox, Ima, Oct),这种选择背后体现了怎样的技术研究策略?其对纳米载体的开发有哪些启示?
这种选择体现了一种超越简单验证、旨在“压力测试”和“探索边界”的系统性研究策略,对纳米载体的“普适性”与“个性化”设计提供了关键见解。具体而言:
1、分子多样性(Molecular Diversity): 三种药物代表了不同的类别:Dox是小分子化疗药;Ima是靶向小分子药物;Oct是一种肽类激素类似物(较大、亲水性更强)。这种选择并非随机,而是为了测试ZIF-8载体对不同大小、不同极性、不同作用机制药物的通用负载和释放能力。
2、“压力测试”与机理探索: 作者有意选择了一个“困难模式”。Oct的负载率和释放行为(快速突释)与Dox和Ima显著不同。这个“异常”数据点恰恰成为了最富信息量的发现。它迫使研究必须深入机理,最终用分子模拟和空间位阻效应来解释其差异性,从而更深刻地揭示了ZIF-8载药不仅受静电相互作用影响,还严重受限于药物分子的尺寸与载体的孔径匹配关系。
对技术开发的启示:
不存在“万能”载体:研究结果表明,即便像ZIF-8这样优秀的载体,其性能也因药而异。这批判了那种试图寻找一种“万能”纳米载体的思路。未来的载体设计必须考虑药物-载体的适配性。
从“普适性平台”到“个性化设计”:在开发一种新的载体平台(如ZIF-8)时,应用一系列具有不同理化性质的模型药物对其进行系统评估,从而绘制出该载体的“能力边界图”。这将指引我们走向更理性的设计:根据特定药物的性质,对载体进行个性化的后修饰或复合设计(例如,为负载大分子肽类药物而预先扩大ZIF-8的孔径或调整其表面性质)。
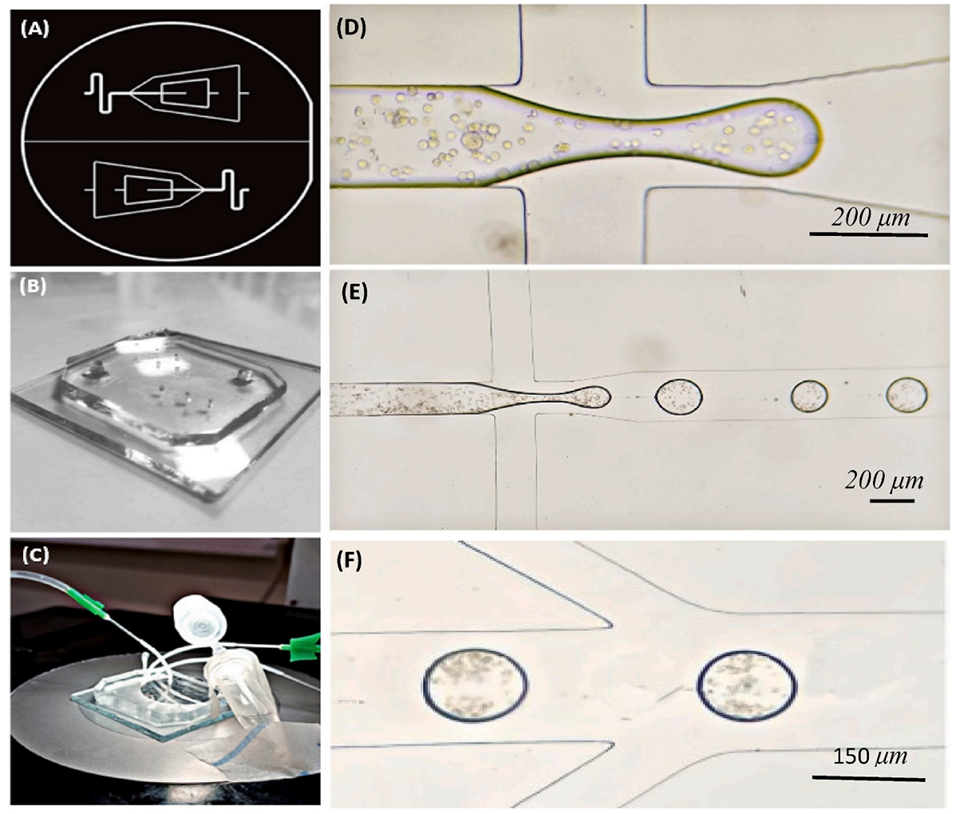
图1:微流控芯片设计与液滴生成原理
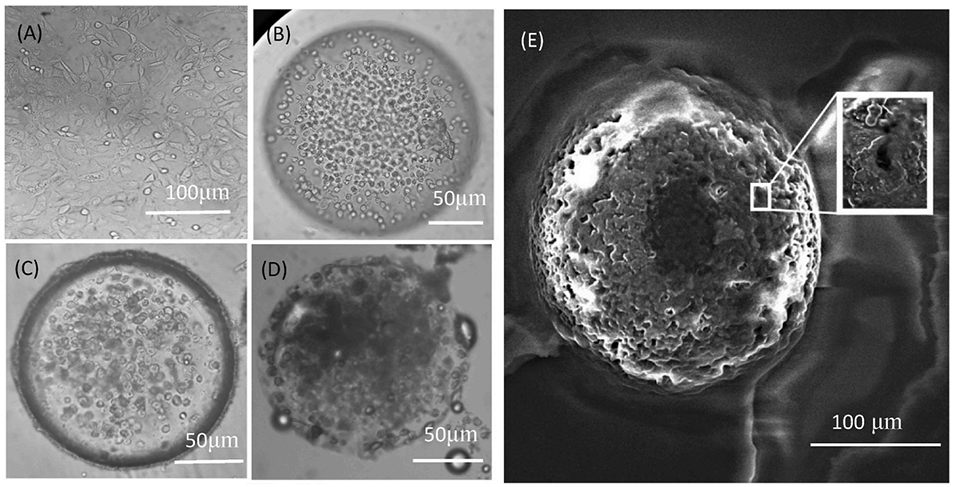
图2:PC3细胞及形成的肿瘤球体随时间的变化
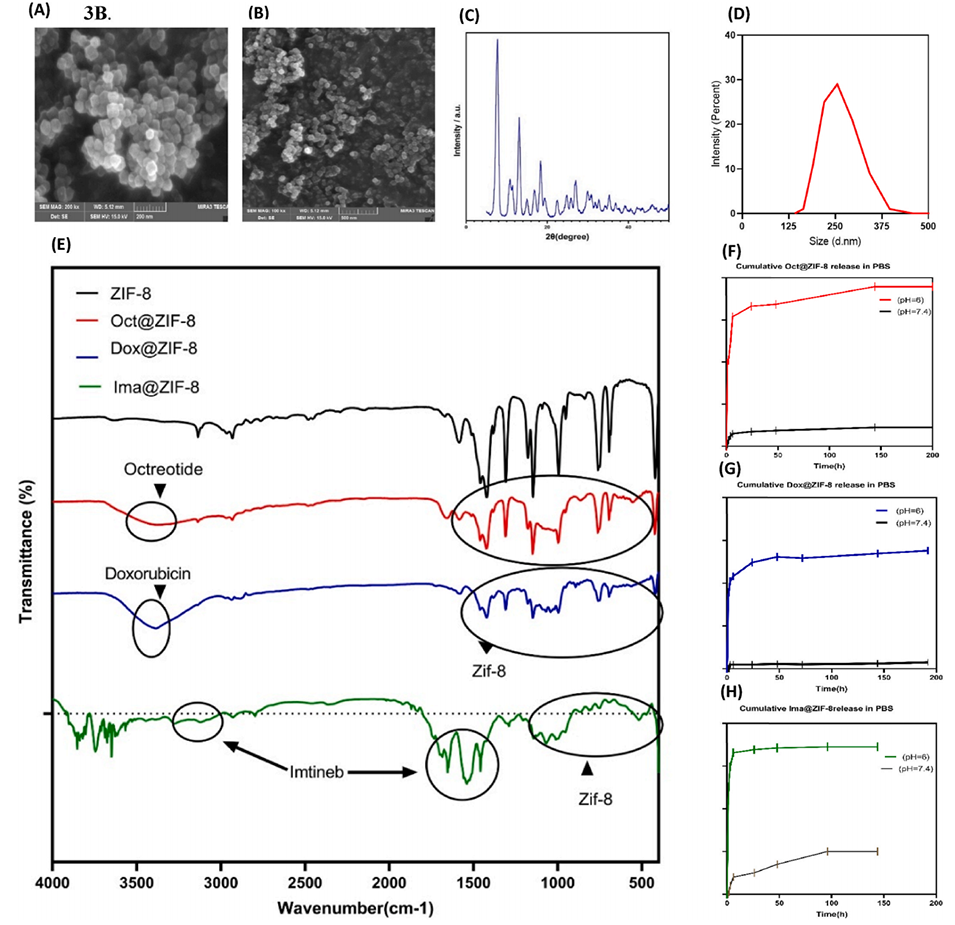
图3:ZIF-8 MOF的材料表征与药物释放曲线
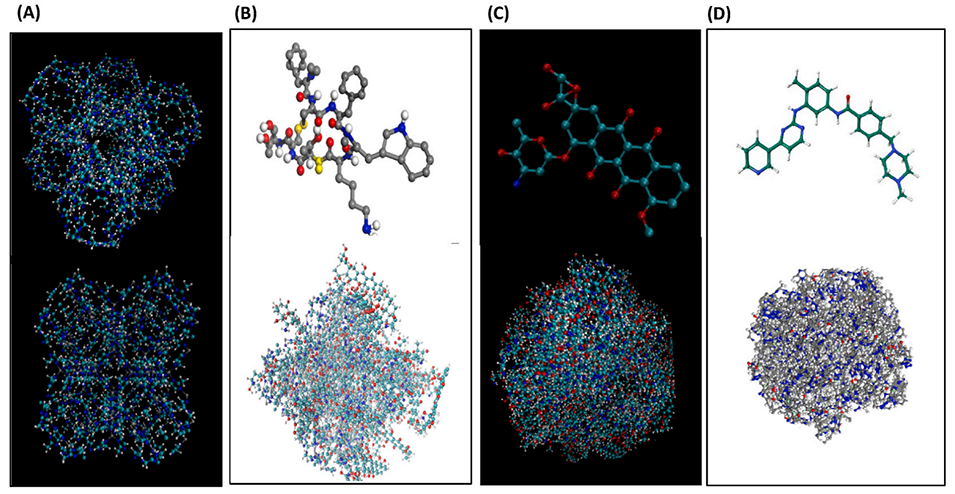
图4:ZIF-8单元结构与药物负载的分子模拟
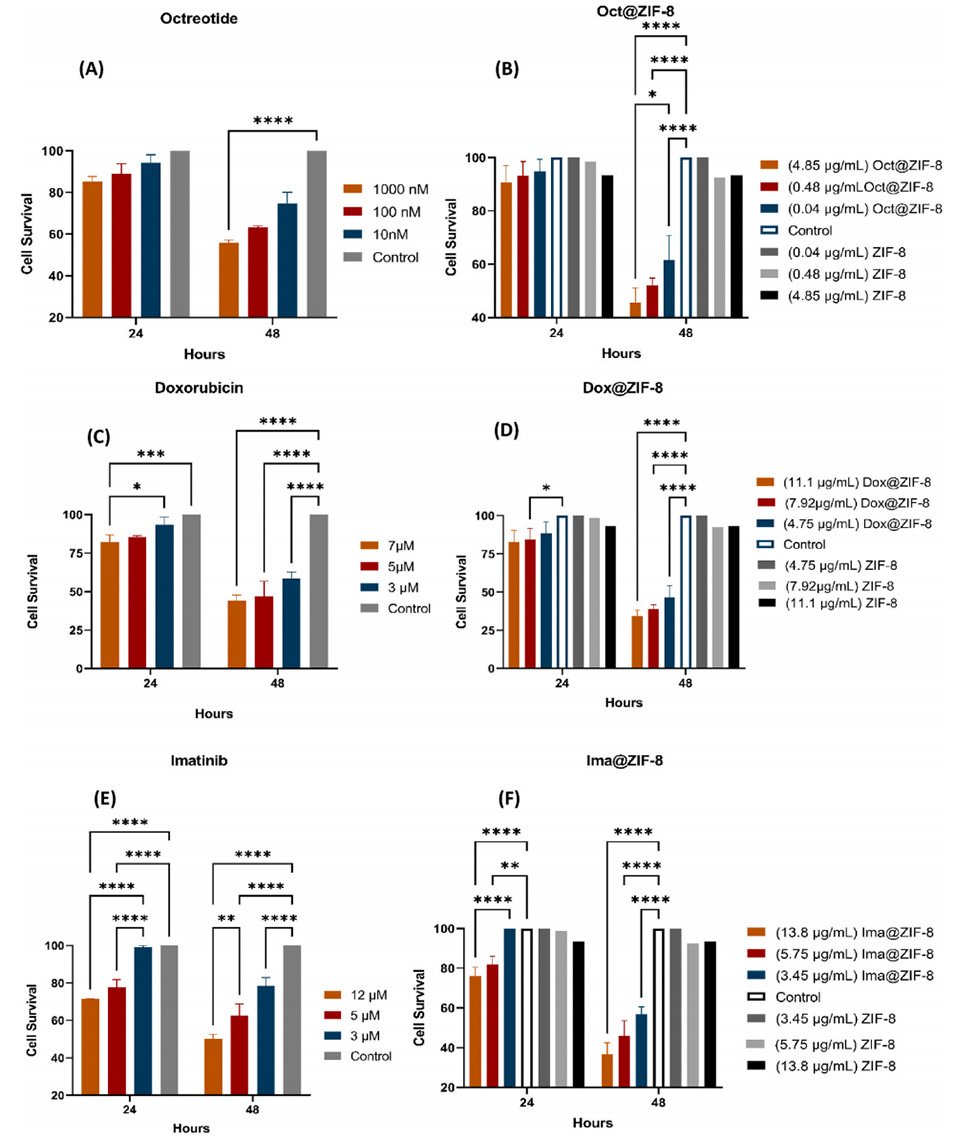
图5:二维细胞培养模型中的细胞毒性(MTT实验)
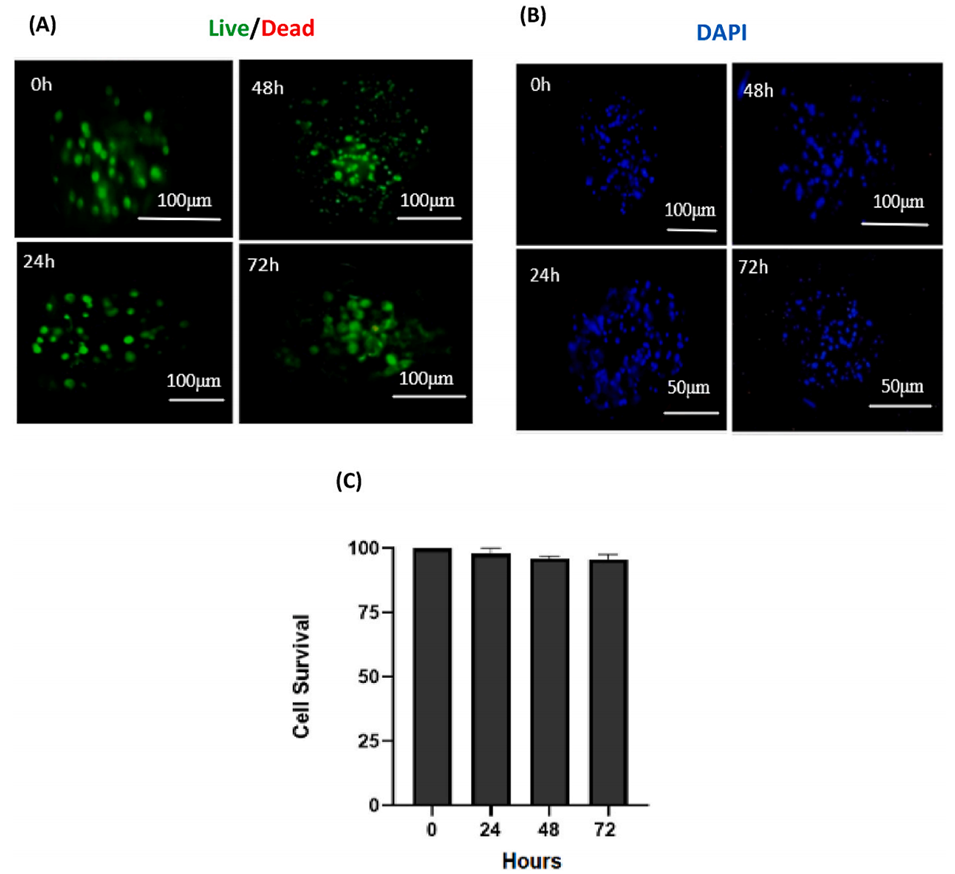
图6:3D肿瘤球状体的存活率检测
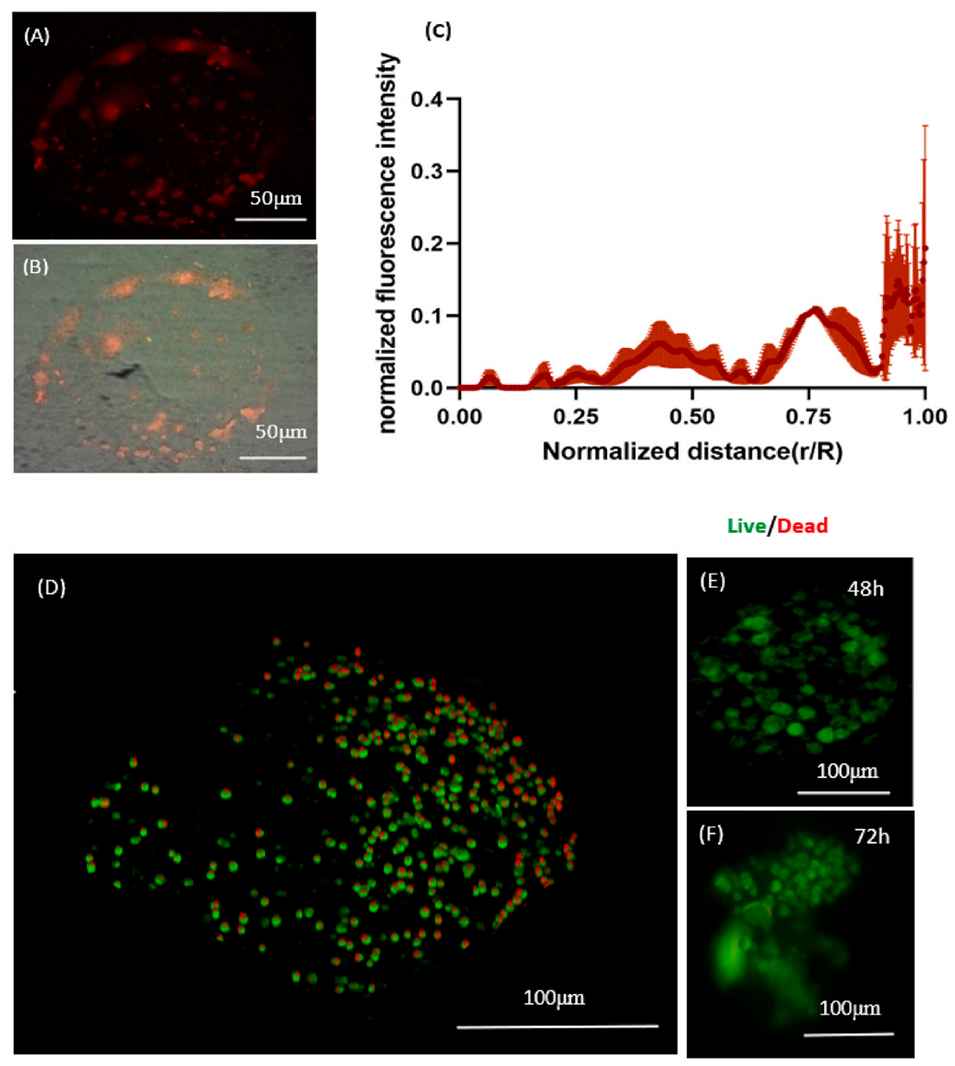
图7:ZIF-8在3D球状体中的渗透与作用
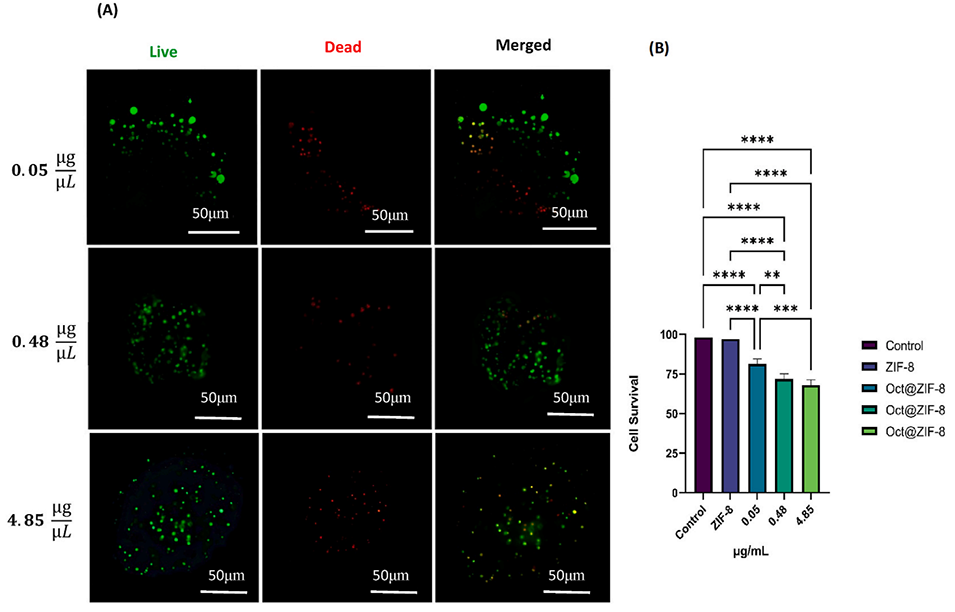
图8:Oct@ZIF-8对3D球状体存活率的影响
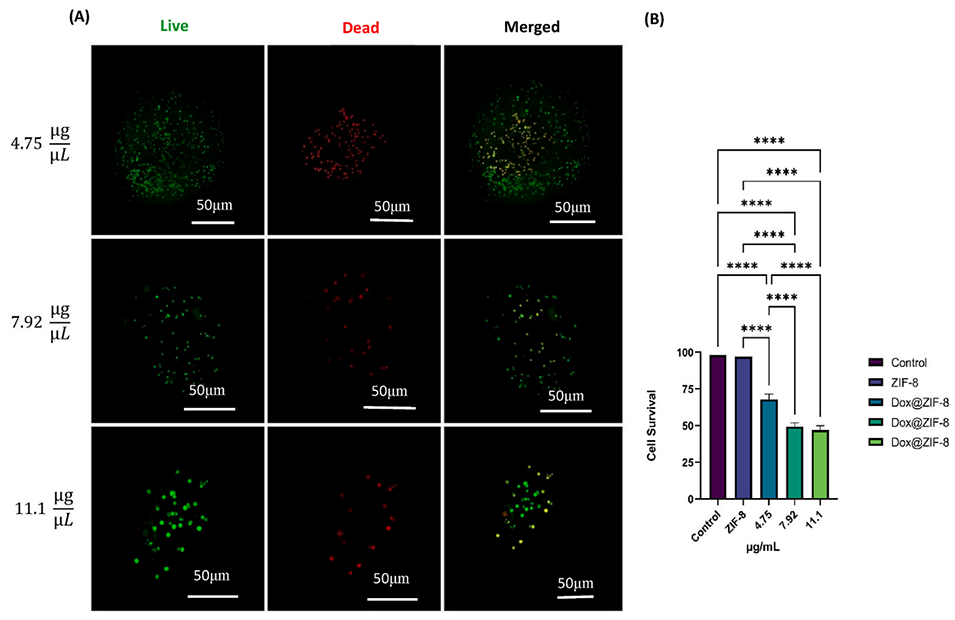
图9:Dox@ZIF-8对3D球状体存活率的影响
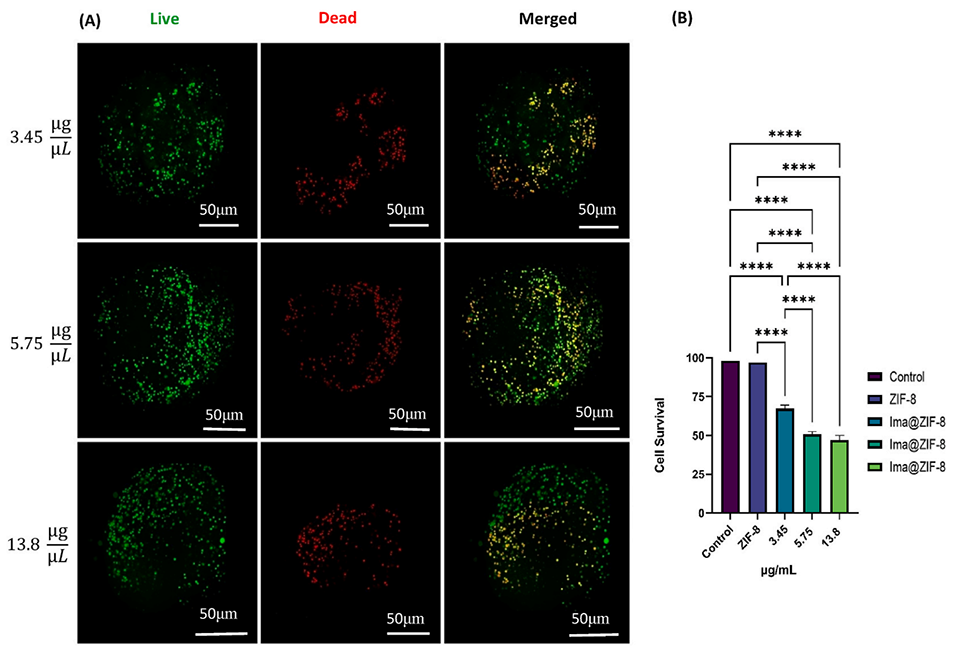
图10:Ima@ZIF-8对3D球状体存活率的影响
论文链接:https://doi.org/10.1016/j.mtadv.2025.100618
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














