研究背景:
急性肝衰竭(ALF)发病急、肝功能急剧衰退,死亡率高且严重影响患者生活质量,原位肝移植是当前治疗重症ALF的有效手段,但供体器官稀缺的问题极大限制了其临床应用,亟需开发全肝移植的替代方案。
通过移植人工生物工程肝移植物进行的细胞治疗因能促进受损肝脏再生、且创伤性更低,成为ALF治疗的潜在方向,多项临床前与临床研究已证实生物人工肝装置、工程化肝移植物对ALF的治疗潜力(如肝细胞样细胞球移植可挽救肝损伤小鼠、微囊化人肝细胞移植在儿童ALF中具安全性)。
不过,现有细胞疗法仍面临关键瓶颈:三维(3D)细胞聚集体(如细胞球、类器官)虽利于细胞间交互,但受氧与营养供应限制,尺寸易受限且长期培养易因形成坏死核心失稳,难以构建大规模组织;而功能微凝胶虽因模块化、多孔特性成为组织工程的理想构建模块,但如何高效制备兼具引导干细胞定向肝分化、支持微组织稳定构建的微凝胶,仍是待解难题。

导读:
近期,中山大学附属第三医院纳米医学中心李明强研究员、陶玉研究员团队开发了一种基于微流控技术的一体化策略,成功制备出搭载金纳米簇-微小RNA功能单元的载干细胞微凝胶。这些微凝胶不仅可高效诱导干细胞肝向分化,还能自下而上组装成具有抗氧化、抗炎和促血管生成功能的人工肝微组织,在药物性肝损伤模型中展现出显著的治疗潜力。相关研究以“Microfluidic fabricated cell-laden microgels aggregated into artificial liver microtissue to ameliorate drug-induced liver injury”为题目,发表在期刊《Biomaterials》上。
本文要点:
1、本研究开发了一种基于微流控技术的载细胞微凝胶构建方法,用于制备人工肝脏微组织以治疗急性肝衰竭。
2、该微凝胶搭载金纳米簇-微小RNA复合物(AuNCs-miRNA),可快速高效促进干细胞肝向分化,并在短时间内自组装成具有多功能的肝微组织。
3、这种生物工程肝微组织具备清除活性氧、调节炎症微环境、促进血管生成等生物功能,且在体内移植后能维持长期稳定性。
4、动物实验表明,该微组织移植能显著改善两种药物诱导的肝衰竭模型的小鼠肝功能,并通过转录组分析证实其通过增强肝脏功能、减轻炎症与氧化应激以促进肝再生。
5、综上,本结合功能性生物材料与微流控技术,构建的人工肝微组织在ALF治疗中疗效显著,为肝衰竭再生治疗提供了高效、安全的新策略。
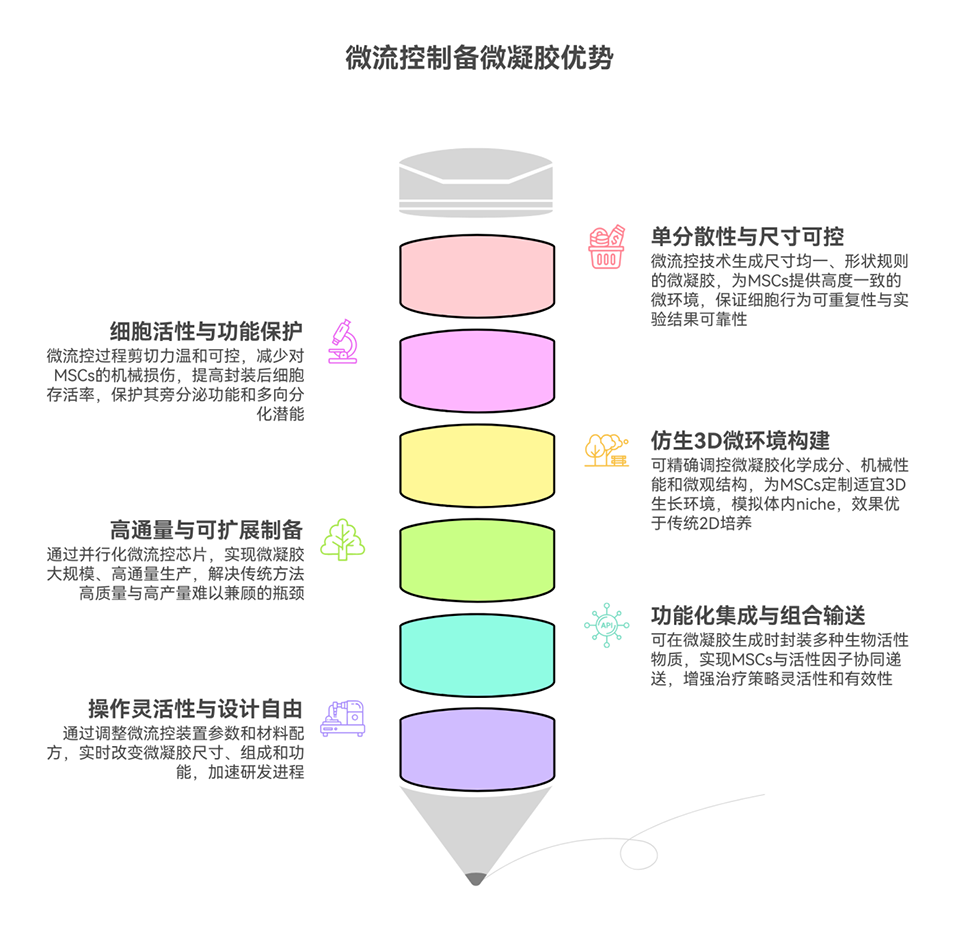

图1. 基于微流控技术制备负载间充质干细胞(MSCs)的微凝胶,进而自组装成生物工程肝微组织用于治疗肝衰竭的示意图。
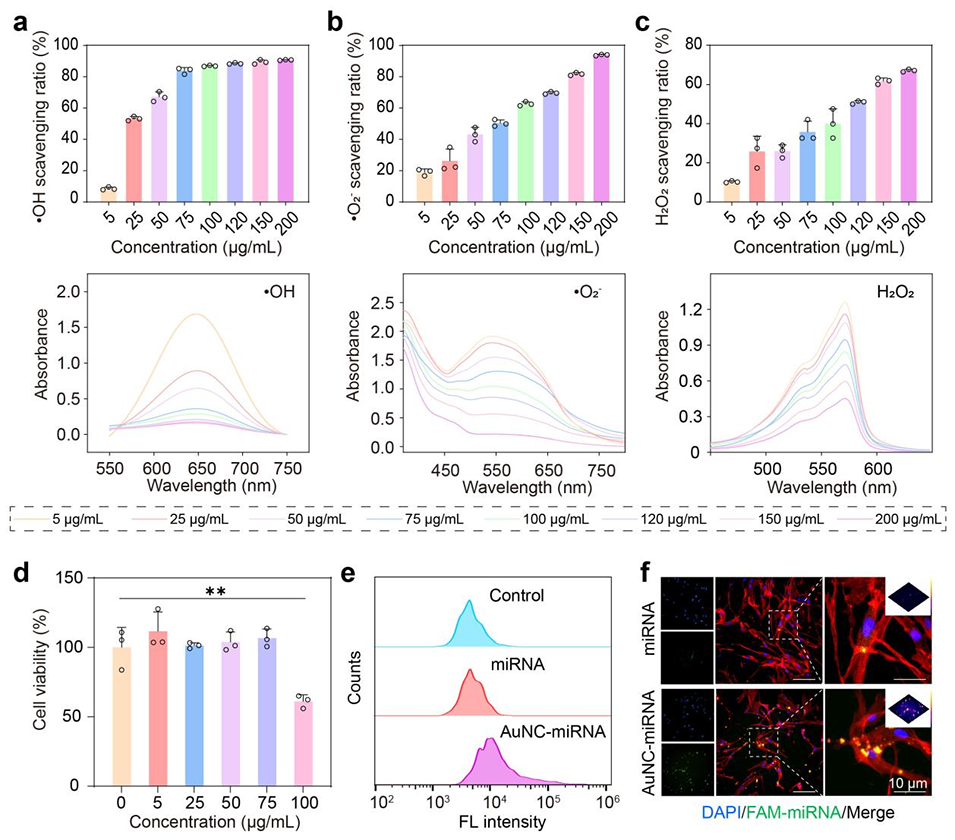
图2. 金纳米簇-微小RNA复合物(AuNCs-miRNA)的合成与表征。
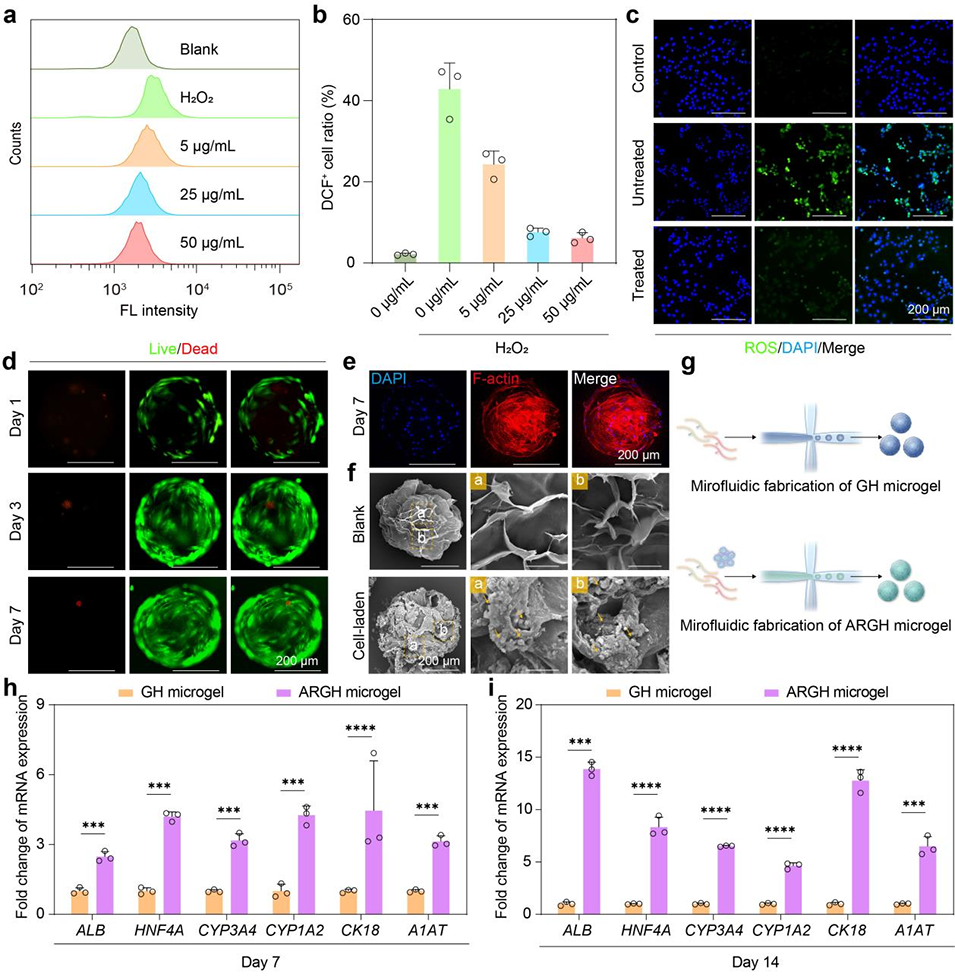
图3. ARGH微凝胶的表征及其在促进干细胞肝向分化中的作用。

图4. 负载细胞的ARGH微凝胶对巨噬细胞极化的调控作用。
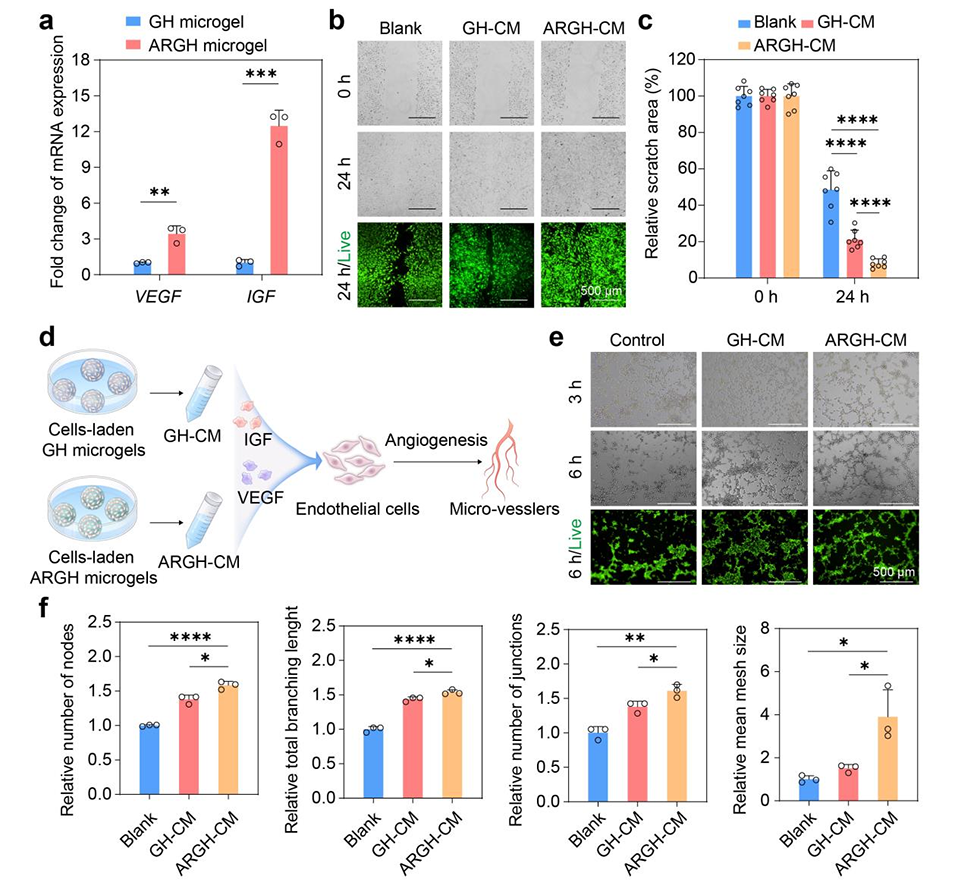
图5. 负载细胞的ARGH微凝胶促进细胞迁移与血管生成。
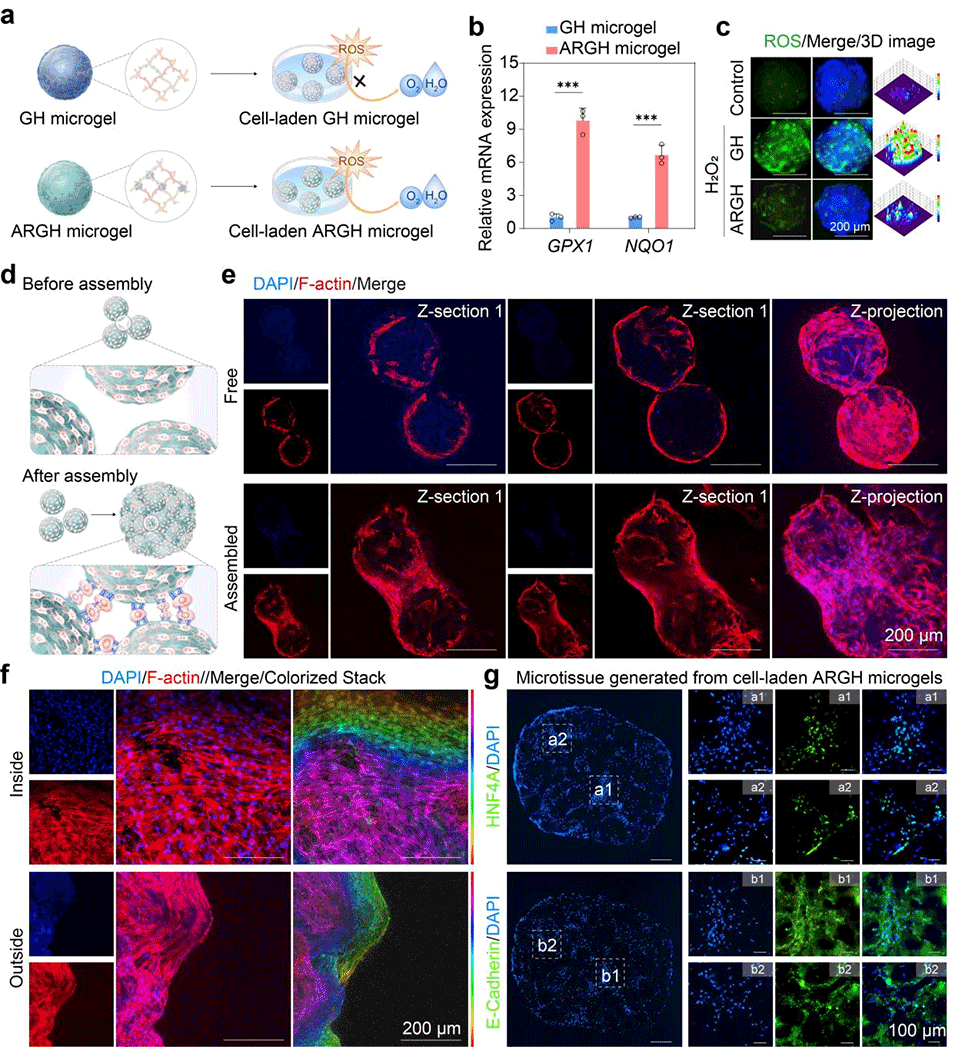
图6. 生物工程肝微组织的制备与表征。
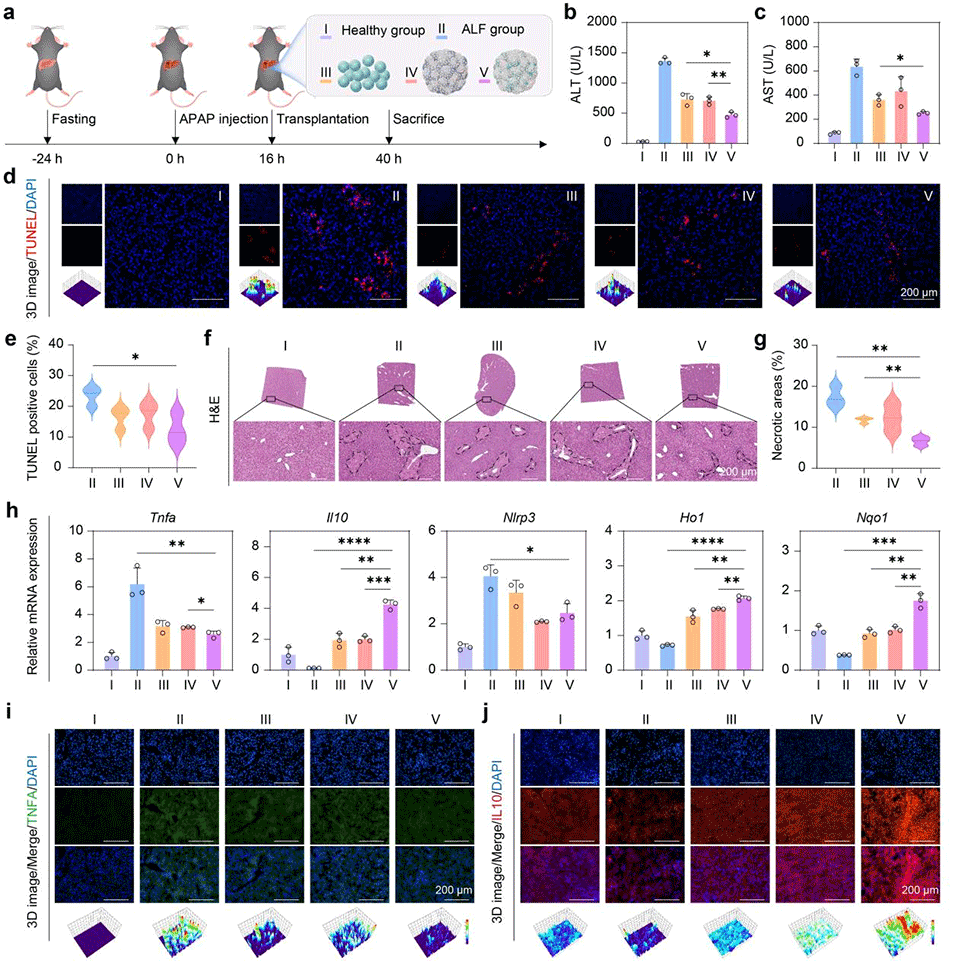
图7. 生物工程肝微组织在对乙酰氨基酚(APAP)诱导肝衰竭模型中的体内治疗效果。

图8. 生物工程肝微组织在四氯化碳(CCl4)诱导肝衰竭模型中的体内治疗效果。

图9. 转录组测序分析揭示生物工程肝微组织在CCl4诱导肝衰竭模型中对肝功能的恢复作用。
论文链接:https://doi.org/10.1016/j.biomaterials.2025.123710
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














