
导读:
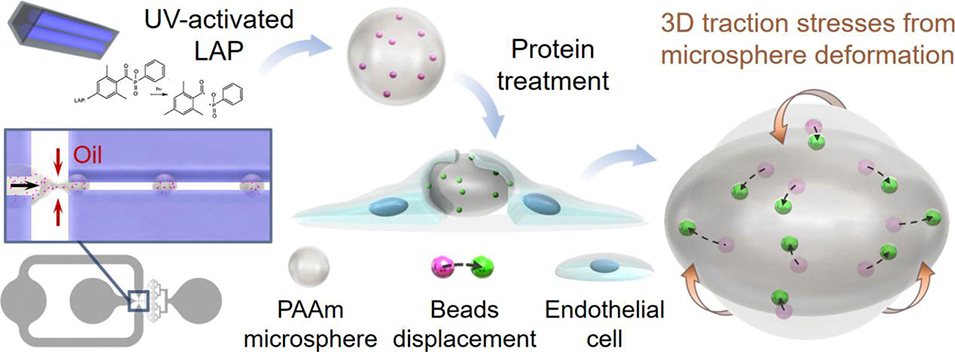
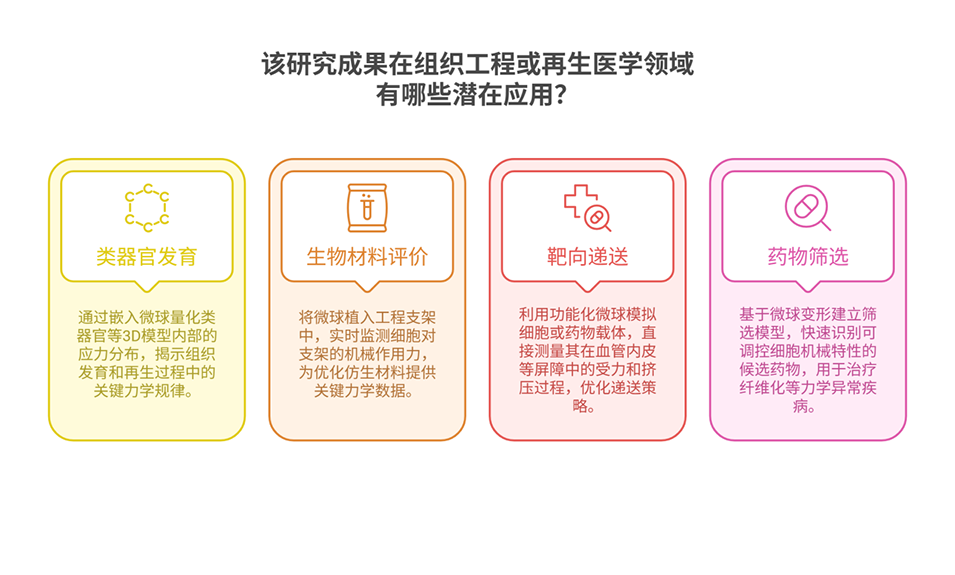
机械力在细胞生物学中起着至关重要的作用,但由于天然细胞微环境的复杂性,在生理相关系统中量化这些力仍然具有挑战性。近期,有研究人员开发了一种基于微流控技术的高通量方法,制备出尺寸与力学性能可控的聚丙烯酰胺水凝胶微球。这些微球可作为嵌入式力传感器,通过追踪内部荧光纳米珠的位移,直接量化细胞在三维环境中施加的应力。相关研究以“Tunable photoinitiated hydrogel microspheres for quantifying cell-generated forces in complex three-dimensional environments”为题目,发表在期刊《Acta Biomaterialia》上。
本文要点:
1、本研究开发了一种基于微流控技术和光引发聚合的高通量方法,用于制备尺寸与弹性模量可控的聚丙烯酰胺(PAAm)水凝胶微球,作为细胞力显微镜探针。
2、通过流动聚焦微流控装置生成单分散液滴,其中包含丙烯酰胺前体溶液与水溶性光引发剂LAP,经紫外光触发聚合后,微球表面可功能化修饰细胞外基质蛋白,并嵌入荧光纳米珠以标记变形。
3、实验证明,该微球可被血管内皮细胞单层包裹,通过追踪纳米珠位移并结合三维相干点漂移算法,直接计算应变与应力,从而量化细胞施加的径向压缩与切向剪切力。
4、综上,该方法为在三维复杂生理微环境中研究细胞力学提供了可靠且可定制的新型力传感工具。
细胞对微球作用力的测量是通过量化微球的三维弹性变形,并利用胡克定律直接计算应力来实现的。具体步骤如下:
标记与成像:在聚合前,将荧光纳米珠(~200 nm)混入水凝胶前体溶液中,使其最终均匀嵌入微球内部,作为变形的示踪标记。共聚焦显微镜分别采集细胞施加力时(应激状态)和使用细胞松弛素D(Cytochalasin D)使细胞失活后(松弛参考状态)的三维图像栈。
示踪点位移追踪:使用开源的相干点漂移(Coherent Point Drift, CPD)算法对前后两幅三维图像中的荧光纳米微球进行非刚性配准。该算法先计算微球的整体平移和旋转(刚体运动),再计算出每个纳米微球因微球弹性变形而产生的净位移。
应变与应力计算:将测得的离散位移数据插值到统一的三维网格上,通过有限差分法计算位移梯度,进而得到整个微球内部的三维应变张量。由于PAAm材料在线弹性范围内工作,可直接应用胡克定律,根据已知的杨氏模量(E)和泊松比(ν)将应变张量转换为三维应力张量。
表面牵引力提取:将计算出的内部应力张量投影到微球表面,即可得到细胞在微球表面施加的三维牵引力矢量,包括法向应力(压/拉)和切向应力(剪切)。
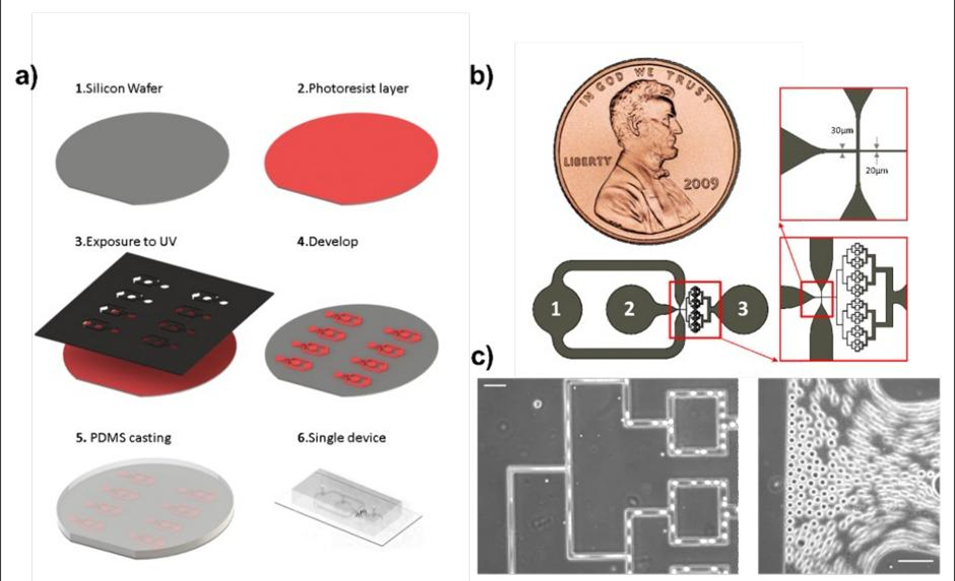
图 1:微流控乳化装置的设计与结构。展示了 PDMS 微流控装置的制备流程与核心结构:左侧(a)为软光刻制备步骤,包括硅片基底、光刻胶涂层、紫外光曝光等关键环节,用于制作微通道模具;右侧(b)为微流控电路结构,包含 “流动聚焦乳化区”(生成初始液滴)和 “多级 T 型结破碎区”(将初始液滴被动分割为更小的子液滴,且不增加分散性),最终通过出口收集液滴。该装置可通过调整通道几何、T 型结数量及油水相流速,实现液滴尺寸的精准调控。
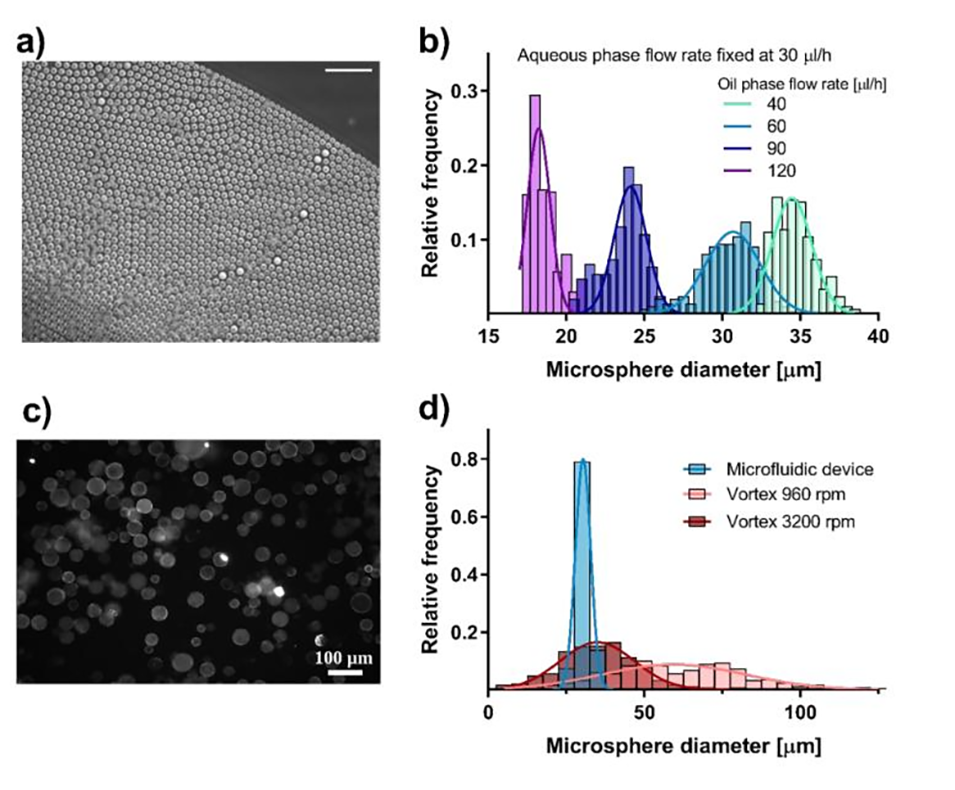
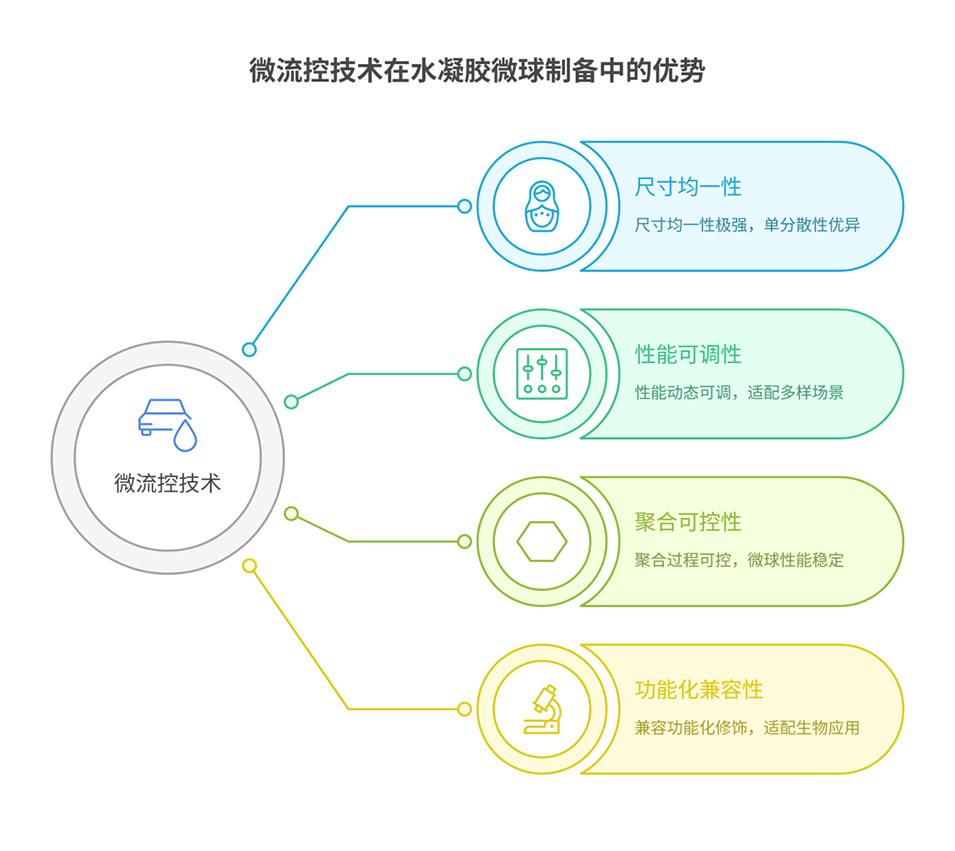
图 2:微流控与涡旋混合法生成微滴的尺寸分布对比。(a-b)为微流控装置(通道宽 30μm,前驱体液速固定 30μL/h)的结果:通过改变油相流速(40-120μL/h),微滴直径可在 18.6±0.9μm 至 34.7±1.3μm 间调节,且标准差仅为均值的 3.7% 左右,单分散性极佳;(c-d)为涡旋混合法的结果:即使调整转速(960-3200rpm),微滴直径分布仍极宽(如 3200rpm 时均值 35.4μm、标准差 12.9μm,标准差为均值的 36%),分散性远差于微流控法。图表清晰对比了两种方法的尺寸均一性差异,凸显微流控技术的优势。
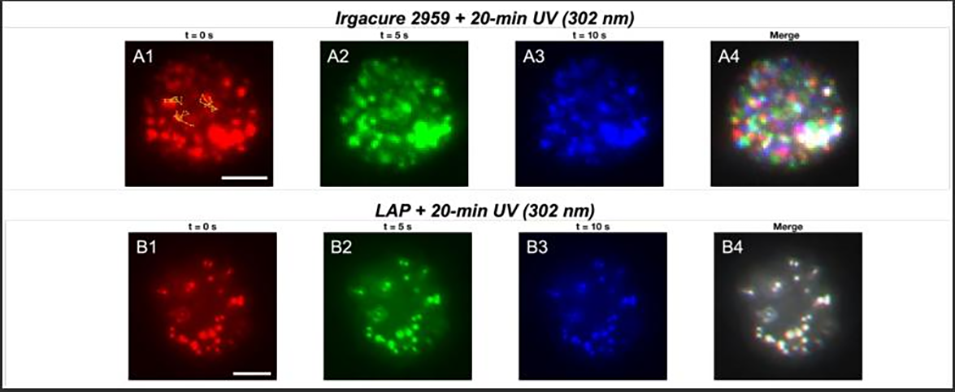
图 3:不同光引发剂的聚合效果对比。对比了光引发剂 Irgacure 2959 与 LAP(苯基 - 2,4,6 - 三甲基苯甲酰基次膦酸锂)的聚合效率:左侧(A1-A4)为 Irgacure 2959 组,经 20 分钟 302nm 紫外光照射后,荧光纳米珠仍呈现无规律布朗运动,表明未实现有效聚合;右侧(B1-B4)为 LAP 组,相同光照条件下,荧光纳米珠位置固定,说明聚合成功形成固态聚合物结构,且纳米珠结合于聚合物主链。证明 LAP 在水凝胶微球聚合中的优越性。
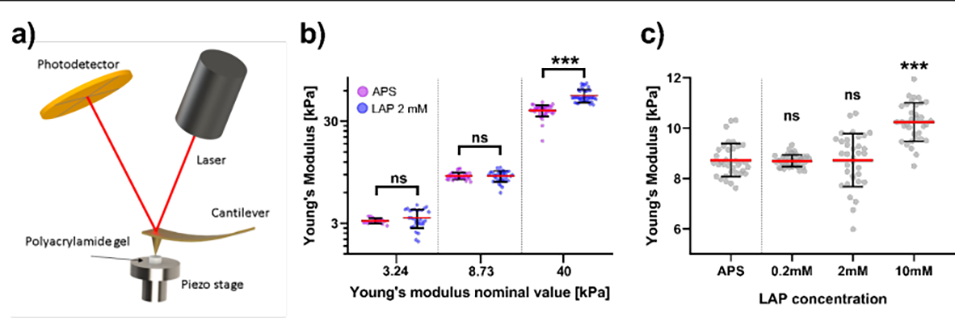
图 4:LAP 与 APS 引发的水凝胶杨氏模量对比。(a)为 AFM(原子力显微镜)测量平面水凝胶的示意图,包含激光、悬臂梁、压电平台等测量结构;(b)比较了 LAP(2mM)与传统化学引发剂 APS 在不同刚度水凝胶(低 3kPa、中 9kPa、高 40kPa)中的杨氏模量:低/中刚度组两者无统计学差异,高刚度组 LAP 引发的凝胶更硬(53.4±7.8kPa vs 38.3±4.8kPa,p<0.001);(c)为 LAP 浓度对中刚度凝胶(目标 8.7kPa)的影响:0.2-2mM LAP 不改变刚度,10mM LAP 时刚度显著升高(10.2±0.7kPa,p<0.001),证明 LAP 在一定浓度范围内不干扰水凝胶力学性能。
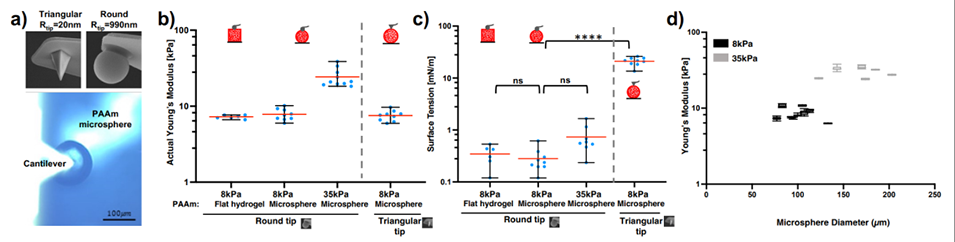
图 5:水凝胶微球的 AFM 力学表征(含表面张力校正)。(a)展示两种 AFM 探针(20nm 三角尖探针、990nm 球形探针)用于微球压痕测试;(b)结果显示:用球形探针时,微球与平面凝胶的杨氏模量无差异(如 8kPa、35kPa 配方均匹配设计值),表面张力影响可忽略;(c)表面张力估算:球形探针测得表面张力 0.42mN/m(弹性主导),三角探针测得 26mN/m(毛细作用主导);(d)证明微球尺寸(半径 30-100μm)不影响杨氏模量,进一步验证微球力学性能的稳定性。
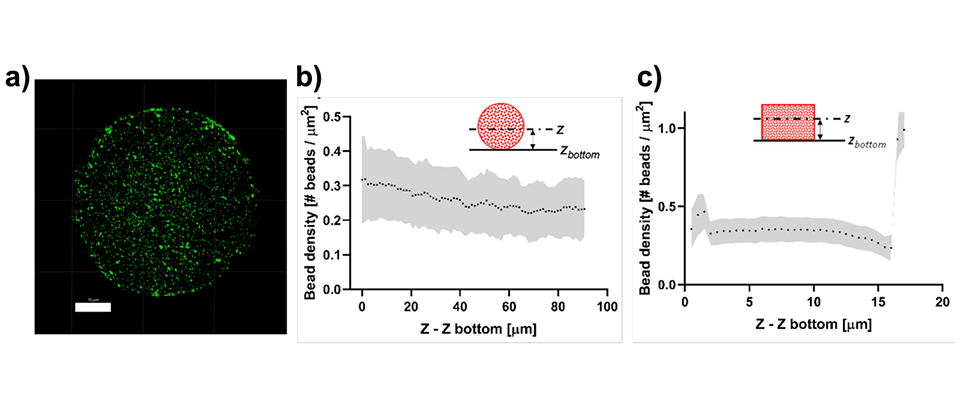
图 6:荧光纳米珠在水凝胶微球与平面凝胶中的分布。(a)为微球内纳米珠的共聚焦成像切片;(b)微球内纳米珠的密度分布:底部 0.32±0.12 个 /μm²、顶部 0.23±0.09 个 /μm²,整体均匀;(c)平面凝胶(12mm 直径、20μm 厚)的纳米珠分布:除与盖玻片接触的底部及自由顶部(密度升至 1 个 /μm²)外,内部密度稳定在 0.3 个 /μm²,与微球内分布一致,证明微球中纳米珠可作为可靠的形变追踪标记。
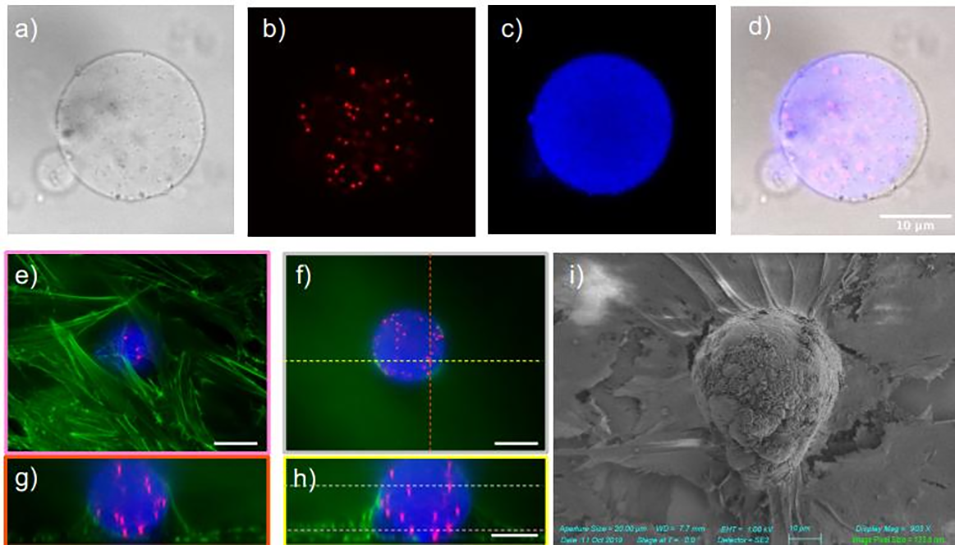
图 7:微球表面功能化与细胞吞噬现象。(a-d)为同一微球的成像:微球嵌入 TRITC 荧光纳米珠,表面功能化修饰 ICAM-1 蛋白(胞外基质蛋白),显示蛋白涂层均匀;(e-h)为内皮细胞(HUVECs)与微球共培养 12 小时的结果:内皮细胞经 FITC - 鬼笔环肽染色(标记 F - 肌动蛋白),形成单层并吞噬微球;(i)为 SEM(扫描电子显微镜)图像:可见内皮细胞的肌动蛋白应力纤维从基底径向延伸至微球中心,表明细胞向微球传递收缩力,验证微球与细胞的有效相互作用。
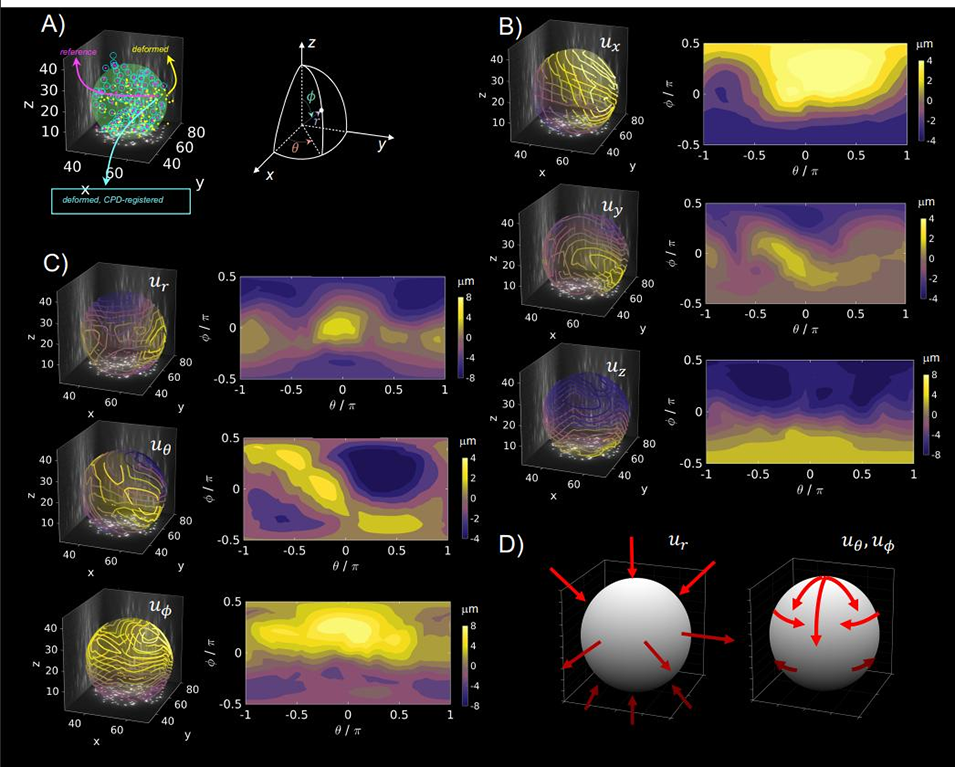
图 8:微球三维形变的量化分析。(A)为纳米珠位置对比:品红色为松弛态(细胞经细胞松弛素 D 处理,破坏肌动蛋白),黄色为应激态(细胞正常状态),青色为应激态纳米珠经 CPD(相干点漂移)算法回溯后的位置,三者重合度高,验证算法有效性;(B-C)为微球形变在笛卡尔坐标与球坐标下的分布:北极区(φ≥45°)因内皮细胞压缩呈径向负位移(ur<0),赤道区(-45°≤φ≤45°)因泊松效应呈径向正位移(ur>0),同时存在切向形变(uθ、uφ);(D)为示意图总结:内皮细胞单层附着并向基底牵拉微球,导致微球产生特定形变模式。
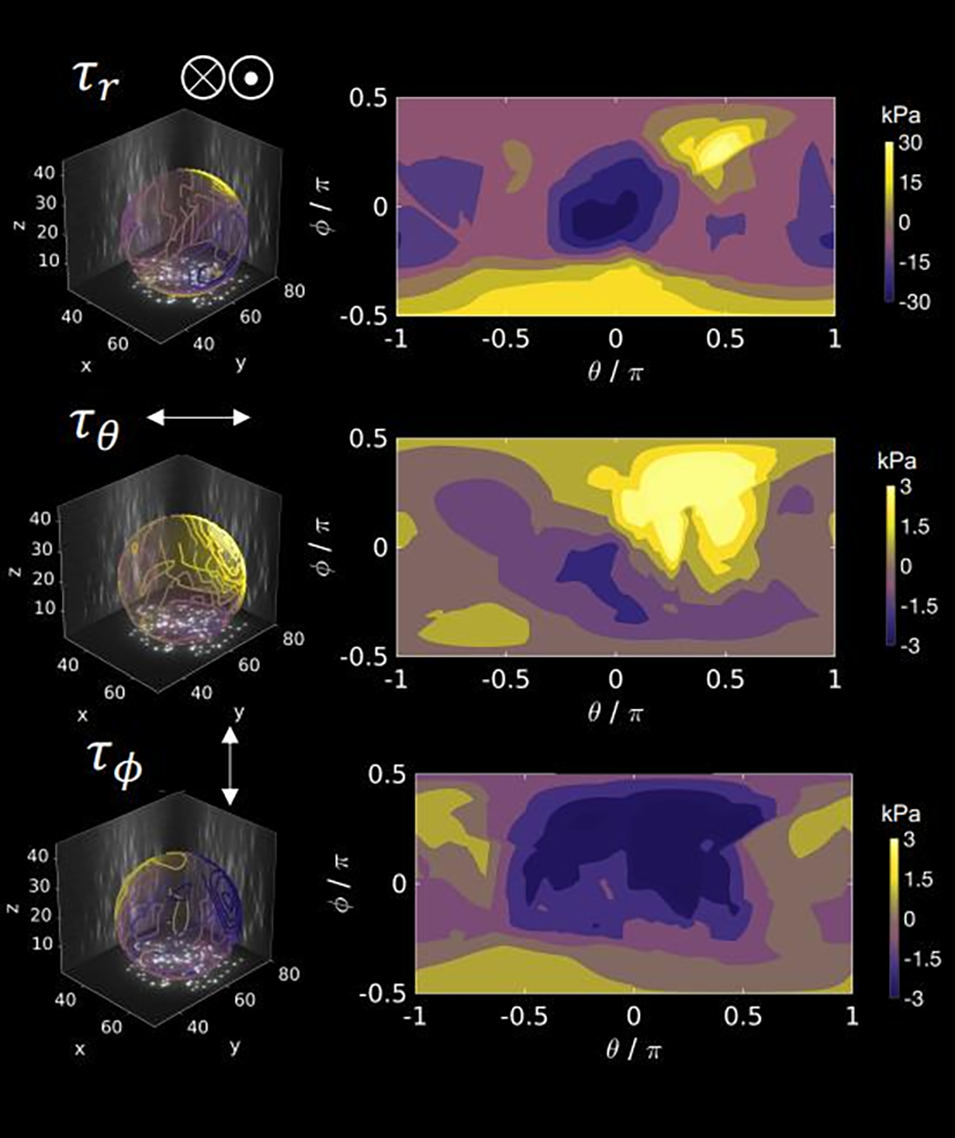
图 9:细胞产生的三维牵引应力分布。基于图 8 的形变数据,结合胡克定律计算并展示微球表面的三维牵引应力(τr:径向应力、τθ:方位角切向应力、τφ:天顶角切向应力):径向应力 τr 约 30kPa,远高于切向应力(τθ、τφ 约 3kPa),与形变模式一致(北极区压缩应力显著);应力图清晰呈现内皮细胞对微球施加的应力大小与空间分布,证明该方法可量化细胞在三维环境中的力学输出。
论文链接:https://doi.org/10.1016/j.actbio.2025.08.041
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














