在生物医学领域,精准靶向治疗与微创干预是重要发展方向,微型机器人因可实现精准递送和无创操作而备受关注。然而,现有磁性微型机器人多由固体单块颗粒构成,难以灵活调控亚单位间的动态相互作用,导致其在不规则生物组织(如崎岖黏膜)和受限空间(如弯曲根管)中导航时,集体效能受限,无法高效穿越复杂微环境,难以满足靶向治疗的实际需求。

近期,宾夕法尼亚大学研究团队设计出分层组装的磁性微胶囊机器人集合体,通过调控亚单位间的磁相互作用能,构建出稳定且可自我重构的结构,其能借助集体自适应移动穿越复杂生物环境,实现靶向抗真菌递送且不损伤宿主细胞。相关研究以“Robotic Microcapsule Assemblies with Adaptive Mobility for Targeted Treatment of Rugged Biological Microenvironments”为题目,发表在期刊《ACS Nano》上。
本文要点:
1、本研究通过设计亚单位之间的潜在磁相互作用能,研发出具有多轴移动能力和集体适应性的分层组装微型机器人,以创建稳定、可自我重构的结构,能够在内部携带和保护货物。
2、利用双乳液模板和磁控技术,将10 nm氧化铁和15 nm二氧化硅纳米颗粒限制在100 μm微胶囊的壳层内,形成多单元机器人集合体。
3、研究发现,氧化铁纳米颗粒在微胶囊中的不对称定位增强了胶囊间的势能,在旋转磁场下形成稳定连接,且不改变磁化率。
4、这些机器人微胶囊集合体表现出突现行为,能自我重构为运动链状结构,穿越复杂障碍物、拱形约束以及具有粘性的崎岖生物组织。
5、利用这些功能,在粘膜组织上使用局部生物膜模型展示了靶向抗真菌递送,结果显示其能有效杀灭念珠菌,且不会与宿主细胞结合或对其造成物理损伤。
6、研究表明,分层组装技术能够制造出具有集体自适应移动能力的载货微型机器人,用于穿越复杂生物环境,以推动生物医学领域中靶向递送技术的发展。
双乳液模板微流控制备技术的原理是通过微流控装置精准操控多相流体界面,生成具有核-壳结构的水包油包水(W/O/W)双乳液液滴,再以该液滴为模板固化形成微胶囊。具体过程如下:
1、多相流体分层流动:将疏水的氧化铁和二氧化硅纳米颗粒混合悬浮液作为中间油相,2wt%聚乙烯醇(PVA)水溶液作为内相和外相,通过微流控毛细管装置使三相流体同轴分层流动。内相形成核心液滴,被中间油相包裹,再共同被外相流体剪切,形成嵌套式的双乳液液滴。
2、界面稳定机制:疏水的二氧化硅纳米颗粒吸附在双乳液的内、外油水界面,结合PVA分子对界面的修饰,共同抑制液滴聚并,确保双乳液形态均匀稳定(内、外直径分别约100 μm和110 μm)。
3、模板固化:通过蒸发中间油相(甲苯),使纳米颗粒在液滴壳层中固化,形成具有核-壳结构的微胶囊。内部水相核心可直接装载水溶性药物(如氯己定),最终获得壳层含磁性纳米颗粒、内部可载货的微胶囊结构,为后续磁控和cargo递送奠定基础。
该技术通过精准控制流体速率、界面张力和纳米颗粒分布,实现了微胶囊尺寸均一性、结构稳定性及cargo高效装载。若制备不对称微胶囊,在溶剂蒸发前需施加约30 mT的磁场,使氧化铁纳米颗粒在乳液中间相的一侧富集,最终形成壳层中氧化铁分布不对称的微胶囊。
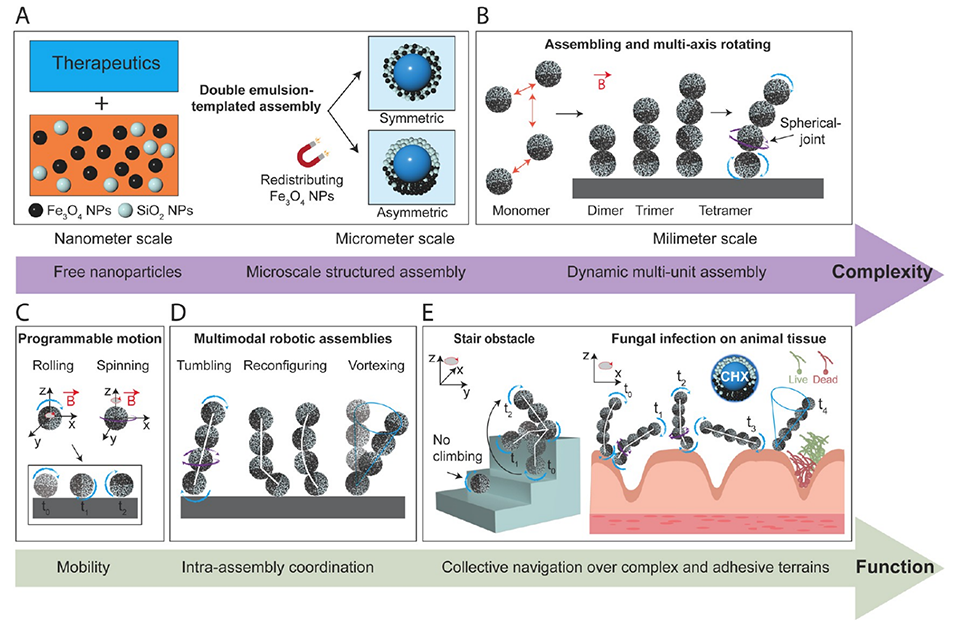
图 1. 通过分层组装设计的可自我重构微型机器人
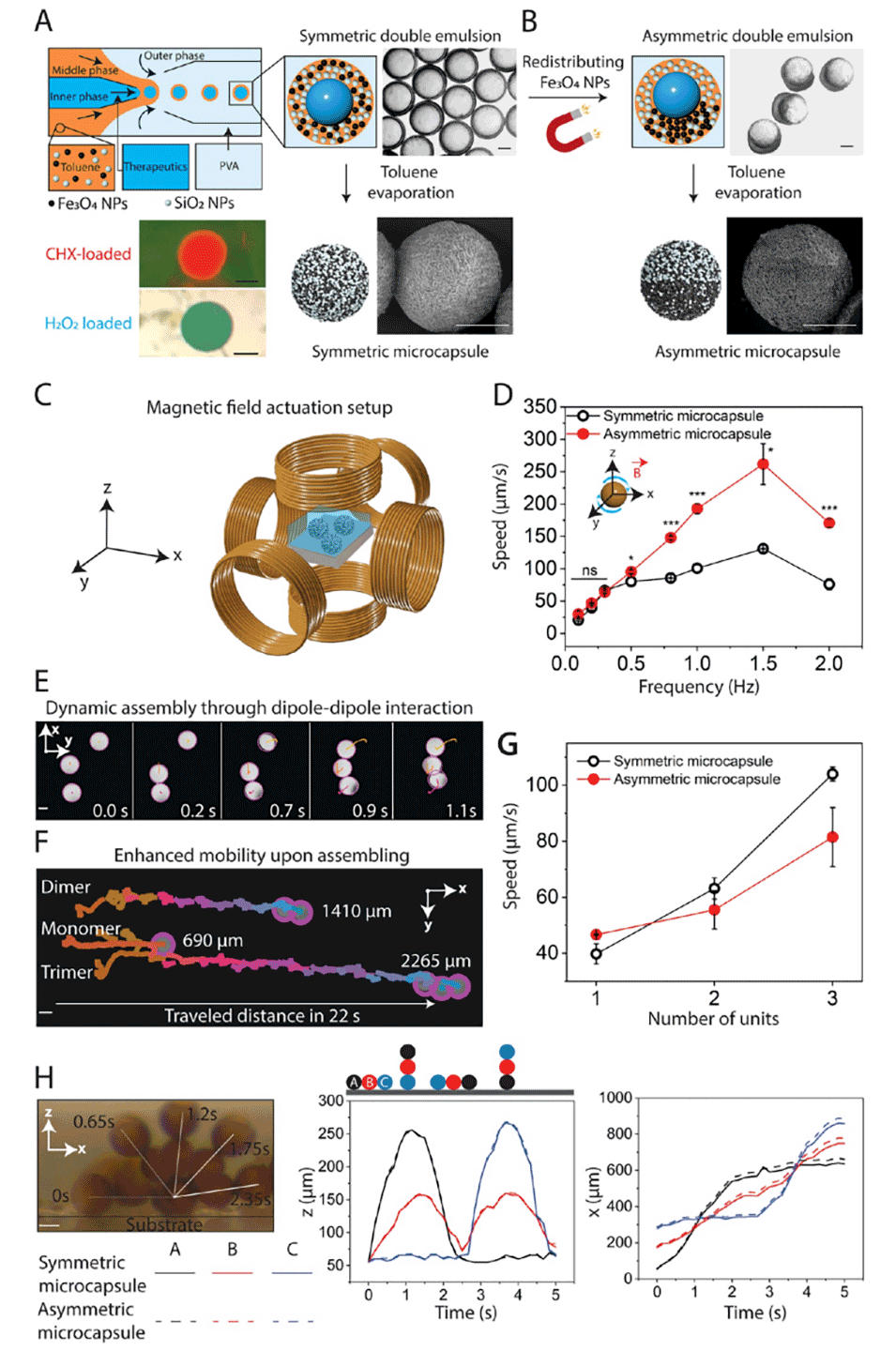
图 2. 磁性微胶囊的制备、动力学特性及组装行为
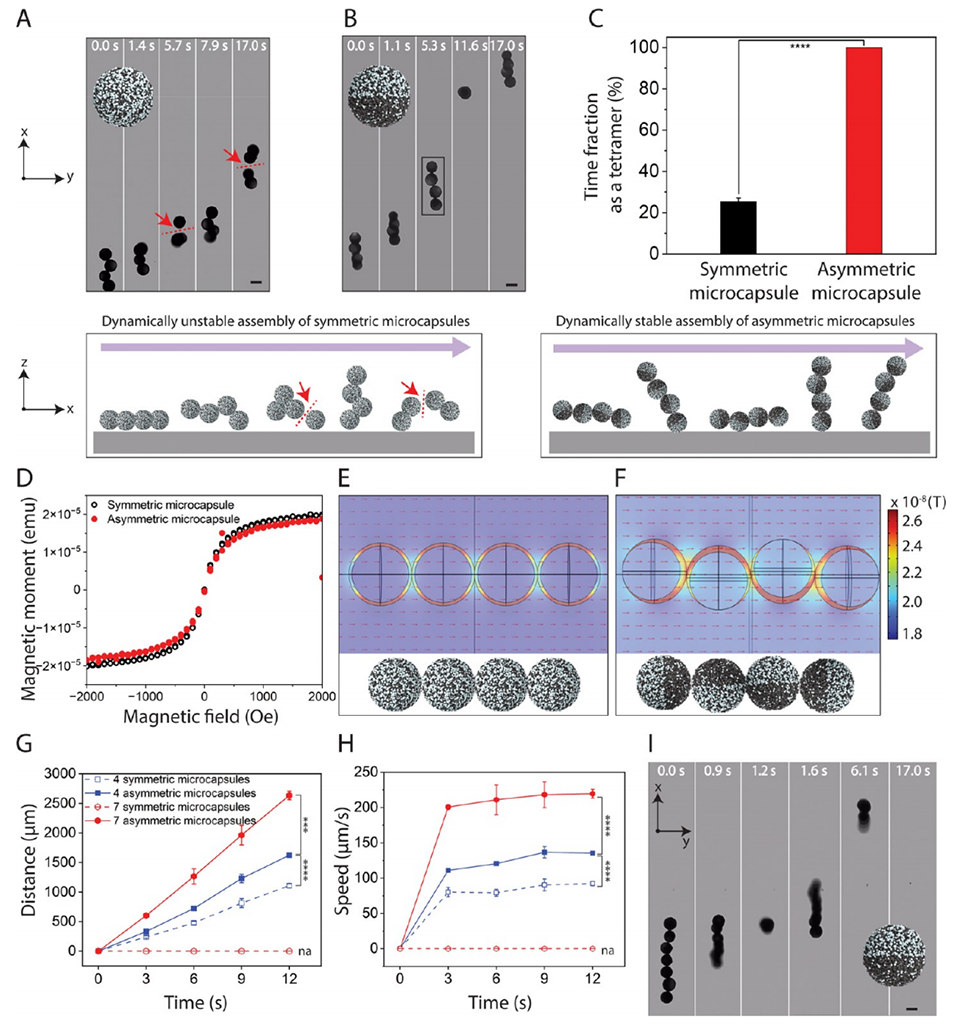
图 3. 微胶囊集合体的动态稳定性
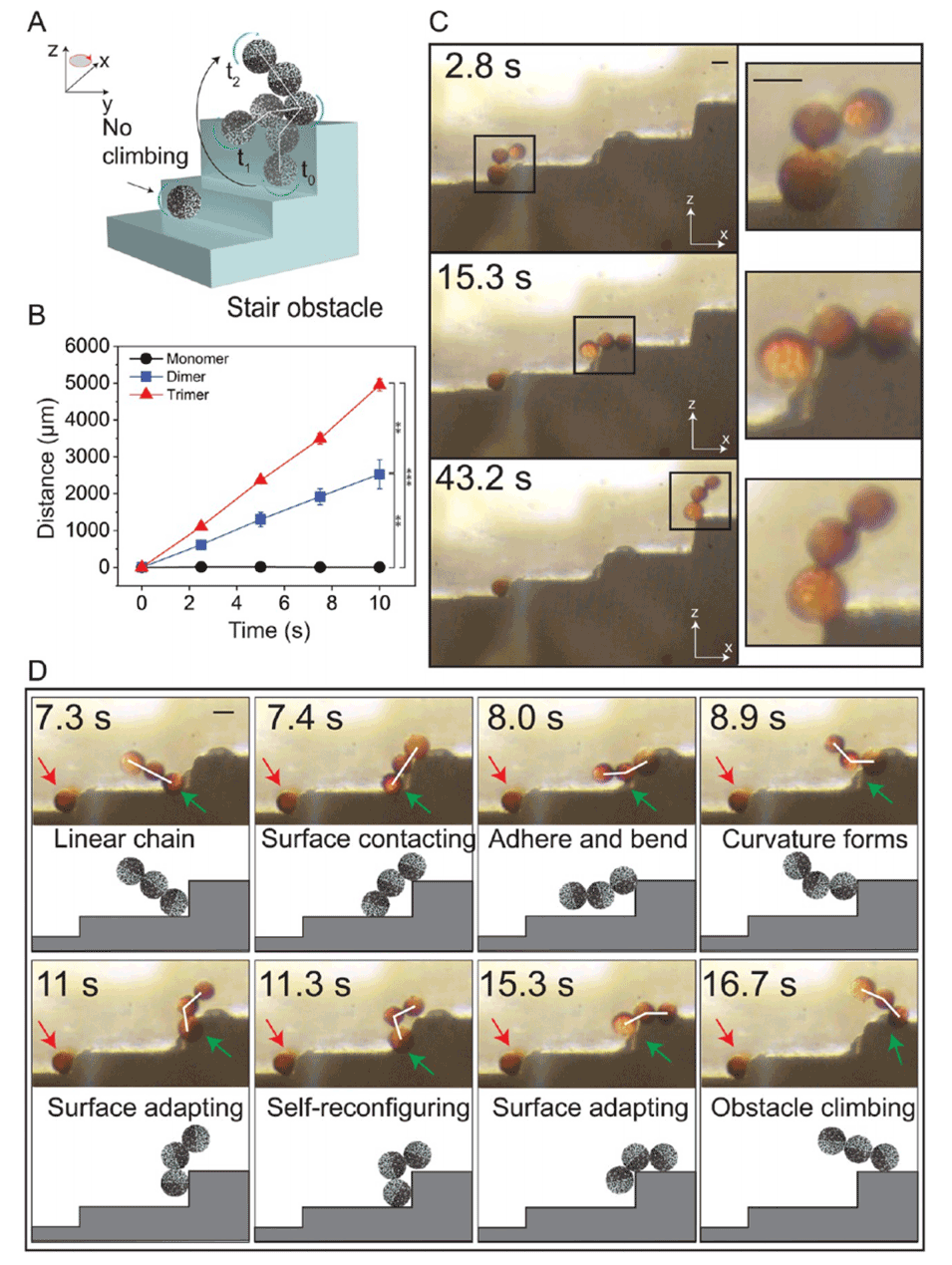
图 4. 不对称磁性微胶囊集合体穿越阶梯状障碍物的集体自适应移动能力
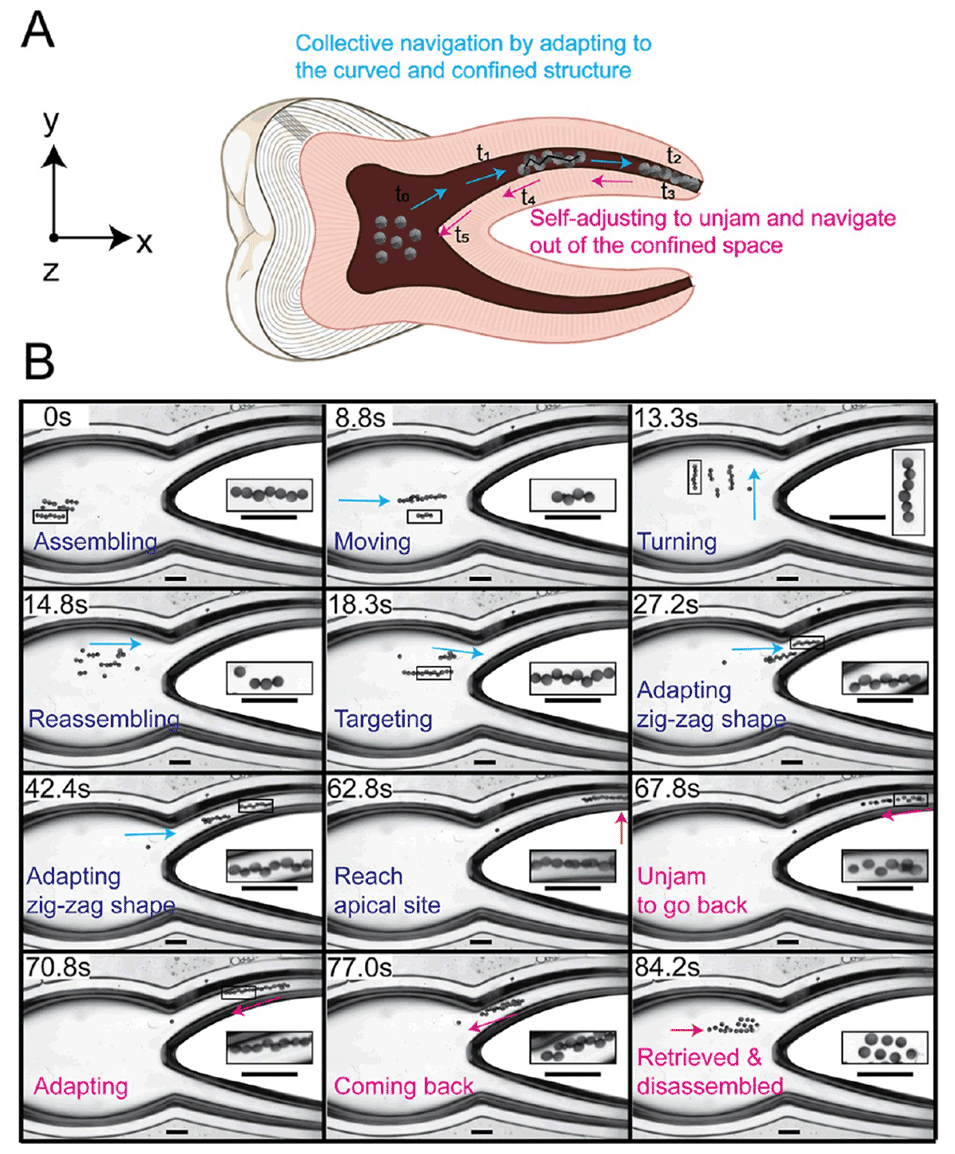
图 5. 不对称微胶囊集合体在弯曲、受限且分支的根管环境中的集体自适应移动能力
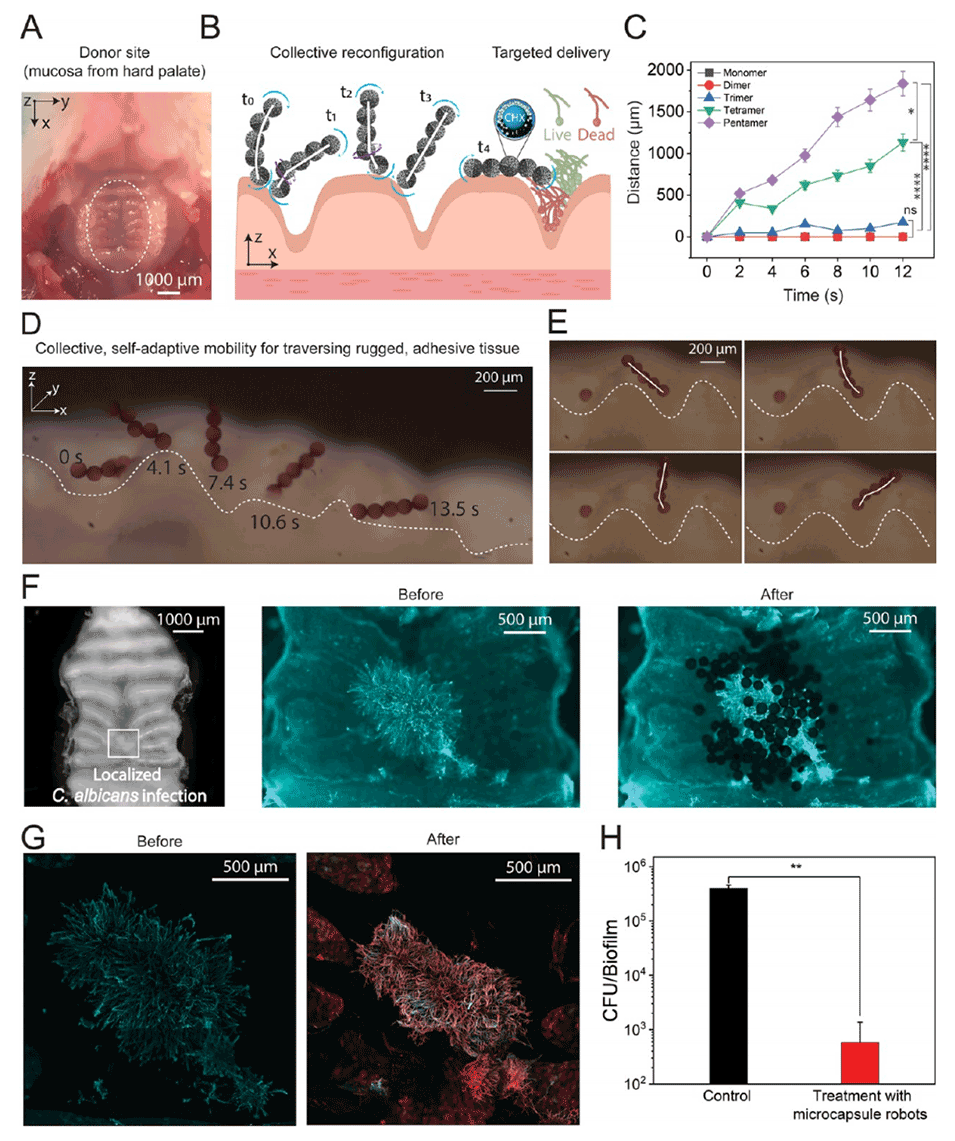
图 6. 具有集体自适应移动能力的不对称微胶囊集合体的潜在靶向生物医学应用
论文链接:https://doi.org/10.1021/acsnano.4c11686
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














