
导读:
骨软骨缺损在临床手术中仍是一大挑战,创伤后修复难度大。组织工程为解决这些问题提供了可行方法,但现有支架无法精准复制复杂的软骨-骨双相微环境。鉴于此,新乡医学院任文杰教授团队与上海交通大学医学院附属第九人民医院整形外科周广东副教授、浙江大学机械工程学院贺永教授合作,开发了一种基于区域脱钙骨框架和预软骨化微球(PCMs)的双相仿生支架,该支架通过区域调控血管化,借助软骨内成骨的双向调节促进软骨形成与骨生成,在兔膝关节骨软骨缺损修复中取得了良好效果。相关研究以“Biphasic biomimetic scaffolds based on a regionally decalcified bone framework and pre-chondrogenic microspheres for osteochondral defect repair”为题目,发表在期刊《Materials Today Bio》上。
本文要点:
1、本研究旨在开发一种基于区域脱钙骨框架和预软骨化微球(PCMs)的双相仿生支架,以修复骨软骨缺损。
2、通过分层脱钙制备出具有区域基质刚度差异的双相脱钙骨基质(DBM)支架,上层修饰阿昔替尼(Axitinib)并结合PCMs,构建了可区域调控血管化的双相仿生支架。
3、以甲基丙烯酰化明胶(GelMA)为原料,通过微流控技术制备直径约115μm的微球,负载骨髓间充质干细胞(BMSCs)后经4周预软骨诱导获得PCMs,其具备稳定的软骨表型。
4、体外研究显示,阿西替尼修饰的软骨层可显著抑制预软骨化细胞的血管内皮生长因子(VEGF)表达,骨层的脱钙骨粉能显著促进PCMs骨化。
5、体内实验表明,这种脱钙骨框架通过区域化血管生成调控PCMs的软骨内骨化,促进兔膝关节骨软骨缺损的整合再生与重建。
6、该双相仿生支架能精准构建骨软骨再生微环境,为各向异性组织损伤的整合再生和修复提供了理论指导。
双相仿生支架在骨软骨缺损修复中的优势主要体现在以下几个方面:
1、精准模拟天然骨软骨的双相微环境
通过分层脱钙处理,使支架上层(软骨层)完全脱钙、下层(骨层)部分脱钙,形成与天然软骨和软骨下骨相似的基质刚度和矿物质含量梯度,精准匹配骨软骨组织的力学特性(如上层弹性模量低、下层弹性模量高)。
多孔结构(孔径 300-400μm)不仅利于营养交换和细胞迁移,还能适配预软骨化微球(PCMs,直径约 115μm)的填充,为细胞提供适宜的生长空间。
2、区域化调控血管生成与组织分化
软骨层:通过聚多巴胺(PDA)修饰负载阿西替尼,可特异性抑制血管内皮生长因子(VEGF)表达,阻断血管侵入,避免软骨钙化,维持稳定的软骨再生微环境,促进 Ⅱ 型胶原(COL2)等软骨特异性蛋白的表达。
骨层:保留部分矿物质的脱钙骨基质具有强骨诱导性,可促进软骨内成骨,通过释放钙、磷离子等成分,上调成骨相关基因(如 ALP、OCN)的表达,加速骨修复。
3、高效结合种子细胞,提升再生效果
支架与预软骨化微球(PCMs)协同作用:PCMs 由骨髓间充质干细胞(BMSCs)经 28 天预软骨诱导形成,具备成熟软骨表型,注入支架后可作为种子细胞来源,在支架调控下分别向软骨和骨定向分化。
支架良好的生物相容性支持 BMSCs 的黏附、增殖(存活率 > 95%)和长期生长,为组织再生提供持续的细胞来源。
4、长效稳定的药物释放与功能维持
阿西替尼通过 PDA 修饰实现高效负载,且能在软骨层长效释放(持续 40 天),持续抑制血管化,解决了单纯药物吸附导致的“突释”问题,保证软骨再生的稳定性。
5、促进骨软骨一体化再生与整合
在兔膝关节缺损模型中,支架可通过区域化血管调控和软骨内成骨调节,使软骨层再生出富含 COL2 的软骨组织,骨层形成新骨并与宿主骨整合,实现骨软骨缺损的协同修复,且修复效果随时间(6-12 周)逐步提升,ICRS 评分显著高于对照组。
6、材料与结构设计的实用性
以天然松质骨为基质,来源广泛且低免疫原性;通过石蜡包埋控制脱钙程度,工艺可控,易于标准化生产;支架可通过微注射方式填充 PCMs,操作简便,适合临床应用场景。
综上,双相仿生支架通过结构仿生、功能分区和精准调控,实现了骨软骨组织的协同再生,为临床骨软骨缺损修复提供了高效、稳定的解决方案。
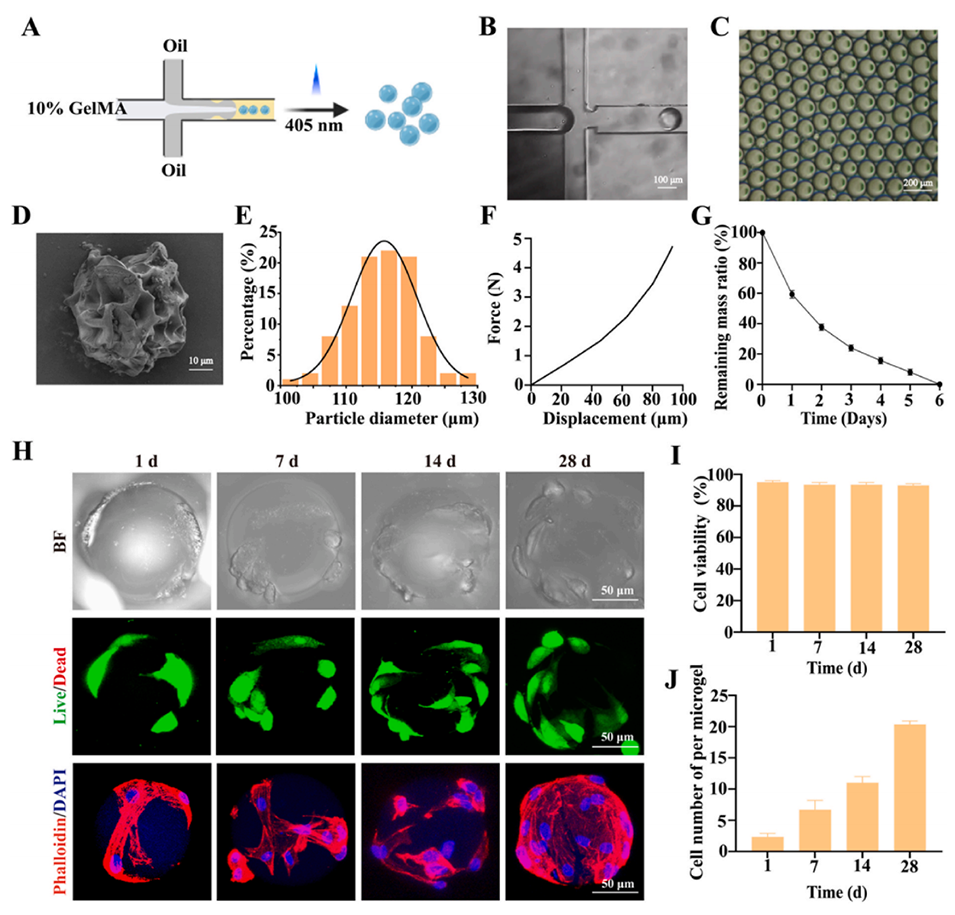
图 1. 甲基丙烯酰化明胶(GelMA)微球的制备与表征。A)微球制备示意图。B)装置生成 GelMA 微球的显微镜图像。C)油相中分散的 GelMA 微球显微镜图像。D)冻干微球的扫描电镜(SEM)图像。E)GelMA 微球的粒径分布。F)GelMA 微球的力-位移曲线。G)GelMA 微球的体外降解情况。H)体外培养 1、7、14 和 28 天时的活/死染色及鬼笔环肽染色结果。I)体外共培养 1、7、14 和 28 天时的细胞存活率。J)1、7、14 和 28 天时每个微球上的细胞数量。
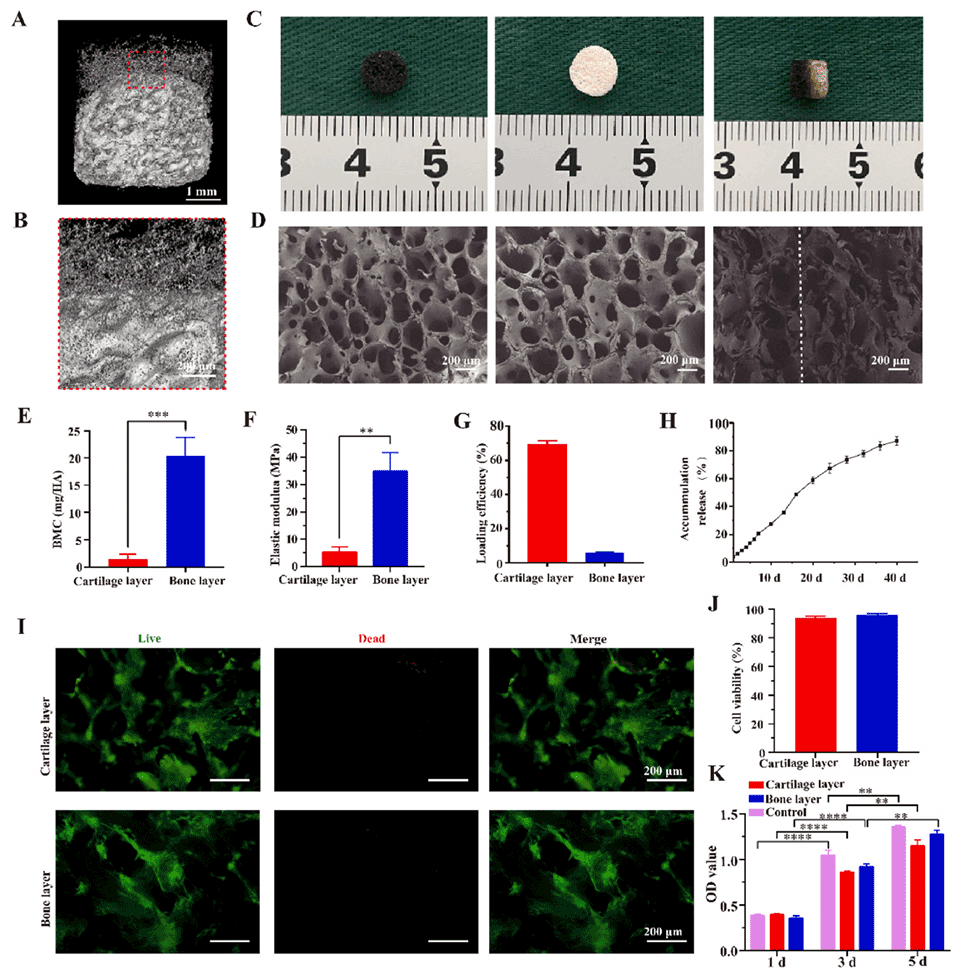
图 2. 双相仿生脱钙骨基质(DBM)支架的制备与表征。A-B)双相 DBM 支架的微计算机断层扫描(Micro-CT)图像。C)双相 DBM 支架的大体观。D)双相 DBM 支架的扫描电镜图像。E)双相 DBM 支架上下层的骨矿物质含量(BMC)分析。F)双相 DBM 支架的弹性模量。G)阿昔替尼的负载效率。H)软骨层支架中阿昔替尼的累积释放曲线。I)支架与骨髓间充质干细胞(BMSCs)共培养 5 天后的活/死染色结果。J)支架与 BMSCs 共培养 5 天后的细胞存活率。K)支架提取物与 BMSCs 共培养 1、3 和 5 天时的 CCK-8 检测结果。
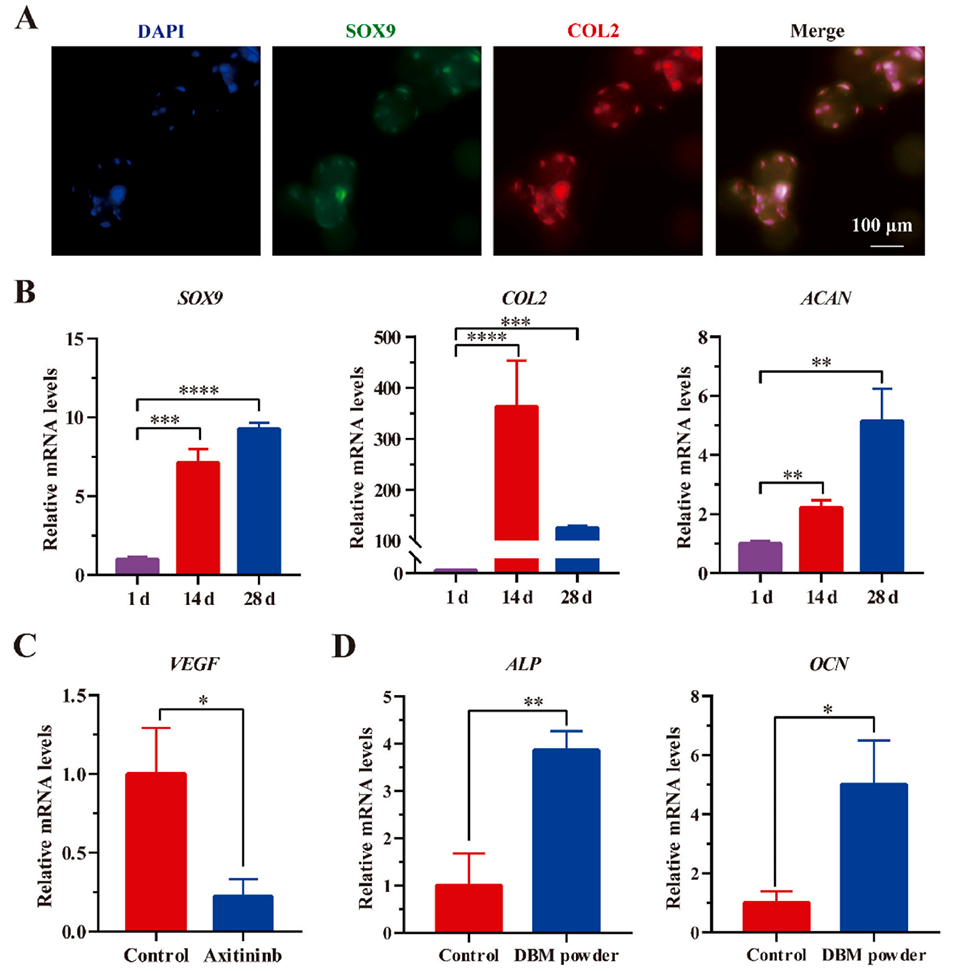
图 3. 预软骨化微球(PCMs)和双相仿生支架的体外生物学功能评估。A)预软骨诱导 28 天的微球上软骨特异性蛋白 SOX9 和 COL2 的免疫荧光染色。B)微球在预软骨诱导 1、14 和 28 天后,软骨特异性基因 SOX9、COL2 和 ACAN 的实时定量聚合酶链反应(qPCR)分析。C)预软骨化 BMSCs 与支架上层共培养 14 天后血管内皮生长因子(VEGF)的表达情况。D)预软骨诱导后的 BMSCs 加入脱钙骨粉后,成骨特异性基因 ALP 和 OCN 的 qPCR 分析。
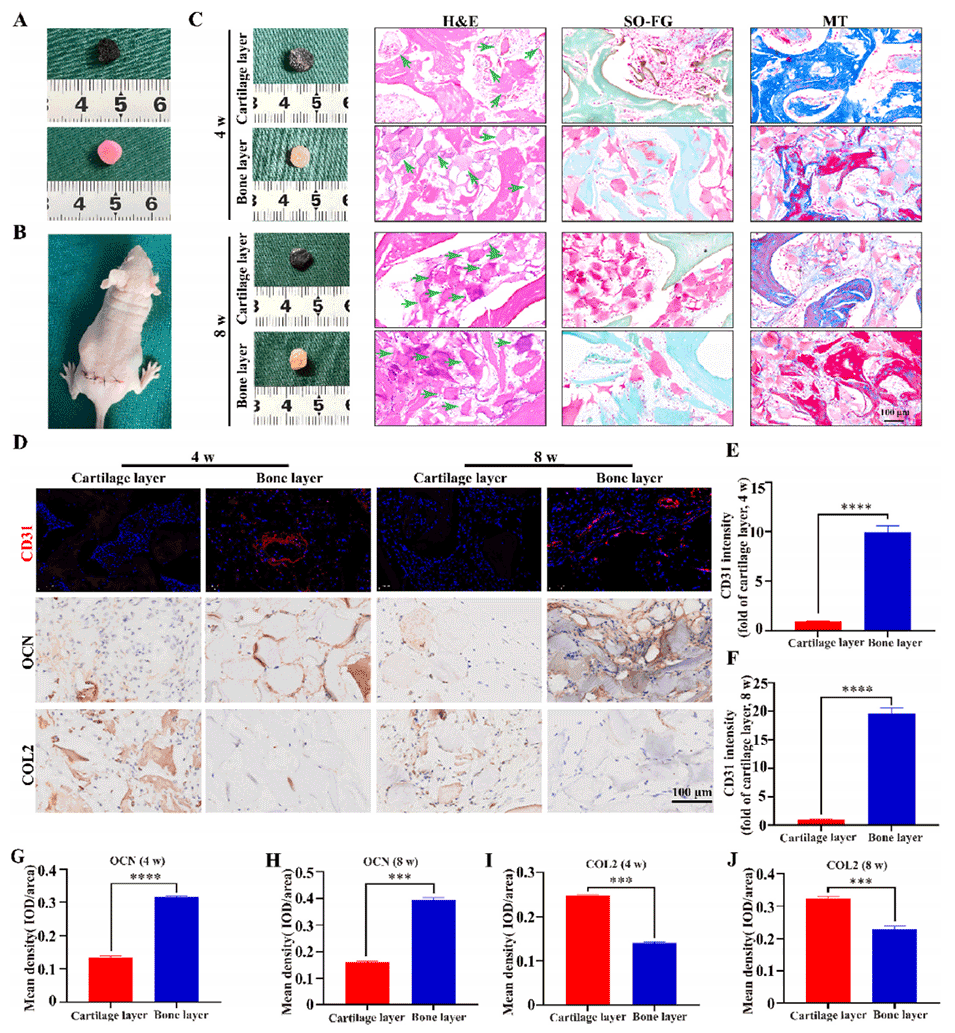
图 4. 负载 PCMs 的双相仿生支架可在体内促进软骨和骨再生。A、B)负载 PCMs 的双相仿生 DBM 支架的大体观及皮下植入情况。C)植入 4 和 8 周后的大体观及苏木精-伊红(H&E)、番红 O - 固绿(SO-FG)和马松三色(MT)染色结果。绿色箭头指示 PCMs。D)植入 4 和 8 周后的 CD31 免疫荧光染色及骨钙素(OCN)、Ⅱ 型胶原(COL2)免疫组织化学染色结果。E、F)4 和 8 周时 CD31 荧光强度的代表性图像。G、H)4 周和 8 周时 OCN 免疫组织化学染色的定量分析。I、J)4 周和 8 周时 COL2 免疫组织化学染色的定量分析。
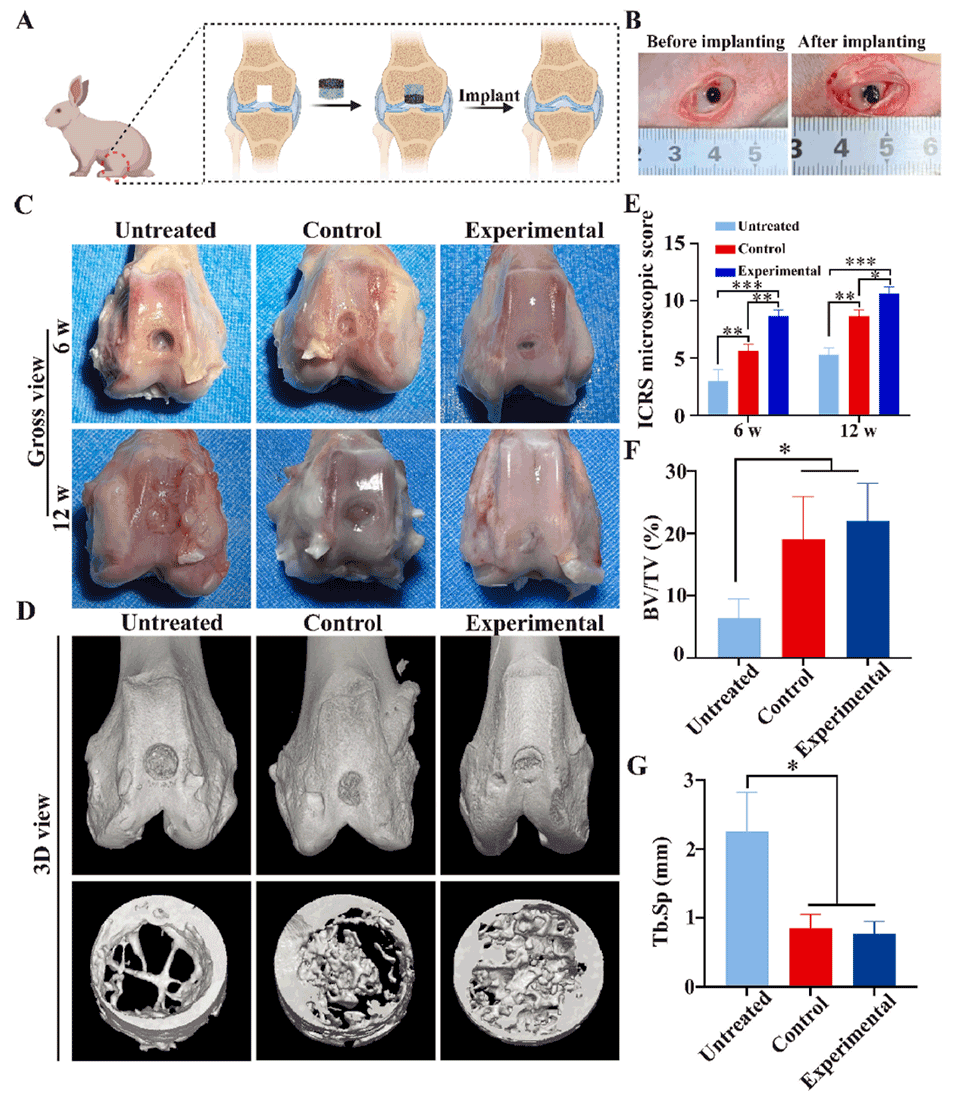
图 5. 在兔膝关节模型中进行的骨软骨缺损体内修复(术后 6 周和 12 周)。A)兔膝关节模型手术过程示意图。B)支架植入前后骨软骨缺损的大体观。C)术后 6 周和 12 周关节软骨的大体观。D)各组 6 周时修复的骨软骨缺损的 Micro-CT 图像。E)各组 6 周和 12 周时的国际软骨修复协会(ICRS)显微镜评分。F、G)6 周时基于 Micro-CT 图像分析的新骨体积与缺损区域总体积之比(BV/TV)和骨小梁间距(Tb.Sp)。
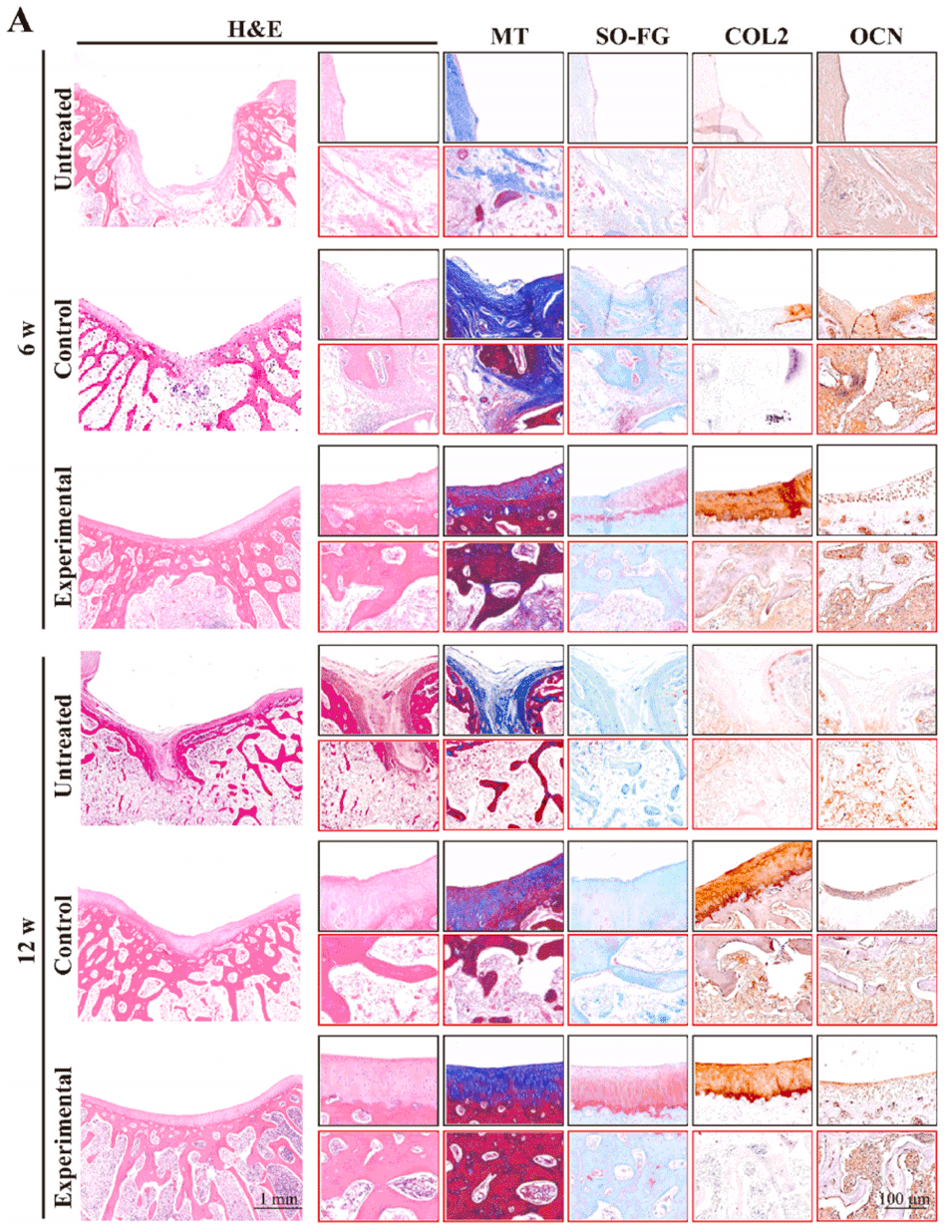
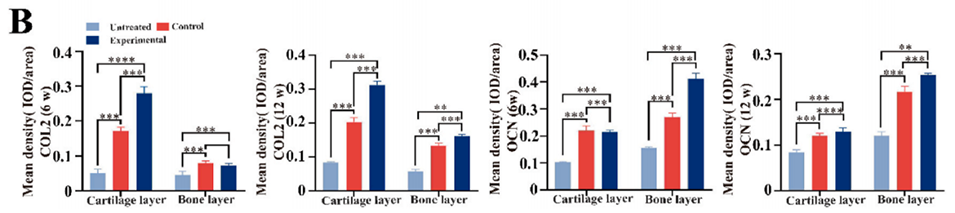
图 6. 组织学染色分析。A)术后 6 周和 12 周样本的组织学检查(H&E、MT、SO-FG 染色及 OCN、COL2 免疫组织化学染色)。B)术后 6 周和 12 周 OCN 和 COL2 免疫组织化学染色的定量分析。
论文链接:https://doi.org/10.1016/j.mtbio.2025.101494
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














