结直肠癌作为全球高发恶性肿瘤,亟需可靠的临床前模型以加速药物研发。传统模型(如细胞系和患者来源异种移植)难以重现肿瘤异质性且难以规模化;患者来源类器官虽能保留肿瘤病理特征,但受限于标准化、重复性及高通量兼容性等技术瓶颈。

近期,中山大学刘杰教授团队开发出一种微流控工程平台,该平台采用层粘连蛋白增强的脱细胞小肠黏膜下层细胞外基质(dSISML),能够制备出均一的载类器官微球。相关研究以“Engineered tumor microspheres via microfluidics and decellularized extracellular matrix for high-throughput organoid-based drug screening”为题目,发表在期刊《Biofabrication》上。
本文要点:
1、本研究开发了一种基于猪小肠黏膜下层的脱细胞基质材料dSISML,旨在替代Matrigel用于结直肠癌类器官培养,并结合微流控技术制备负载类器官的微球,以实现高通量药物筛选。
2、以猪小肠黏膜下层为原料,经多步脱细胞处理保留大量蛋白质和糖胺聚糖,去除大部分DNA,制得脱细胞小肠黏膜下层(dSIS);通过添加层粘连蛋白优化得到dSISML,其物理性能优良,凝胶温度较高且机械强度可调节。
3、dSISML能支持结直肠癌类器官生长,类器官在形态、增殖能力及基因表达等方面表现良好,与Matrigel培养的类器官特性相似,且部分指标更优。
4、利用微流控技术可制备尺寸可控、稳定性好的dSISML微球,负载的类器官活性和增殖能力良好,且微球较大的比表面积利于物质交换。
5、药物筛选实验显示,微球培养的类器官对水溶性药物敏感性更高,对疏水性药物也有更好的渗透效果。
6、总之,dSISML是Matrigel的有效替代品,结合微流控技术的微球制备系统为大规模、高通量的类器官模型构建和药物筛选提供了高效稳定的平台。
在该研究中,微流控技术是实现类器官负载微球制备及高通量药物筛选的核心技术支撑,具体作用如下:
1、高效制备均一微球:通过油相剪切水相,快速生成尺寸可控的类器官负载微球,且批次稳定性高。
2、精准调控微球尺寸:调节油相和水相流速比,可精确控制微球直径,满足不同实验需求。
3、简化操作流程:结合温控系统实现微球连续化、自动化制备,操作简便,无需复杂设备。
4、支撑高通量药物筛选:微球比表面积大,利于药物渗透和物质交换,可批量用于多种药物及浓度的敏感性测试。
5、优化类器官培养:为类器官提供仿生微环境,促进其增殖和功能稳定,提升实验模型可靠性。
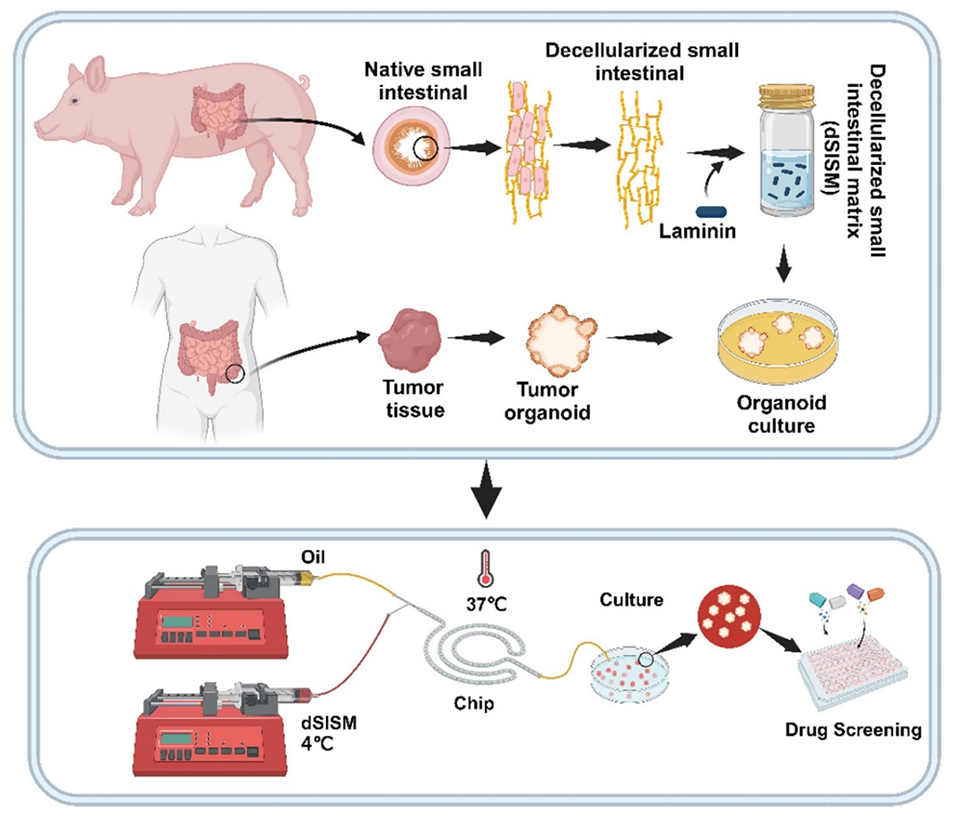
图1. 示意图展示了脱细胞细胞外基质的制备、类器官的培养,以及利用微流控芯片技术制备负载类器官的微球用于药物筛选的过程。
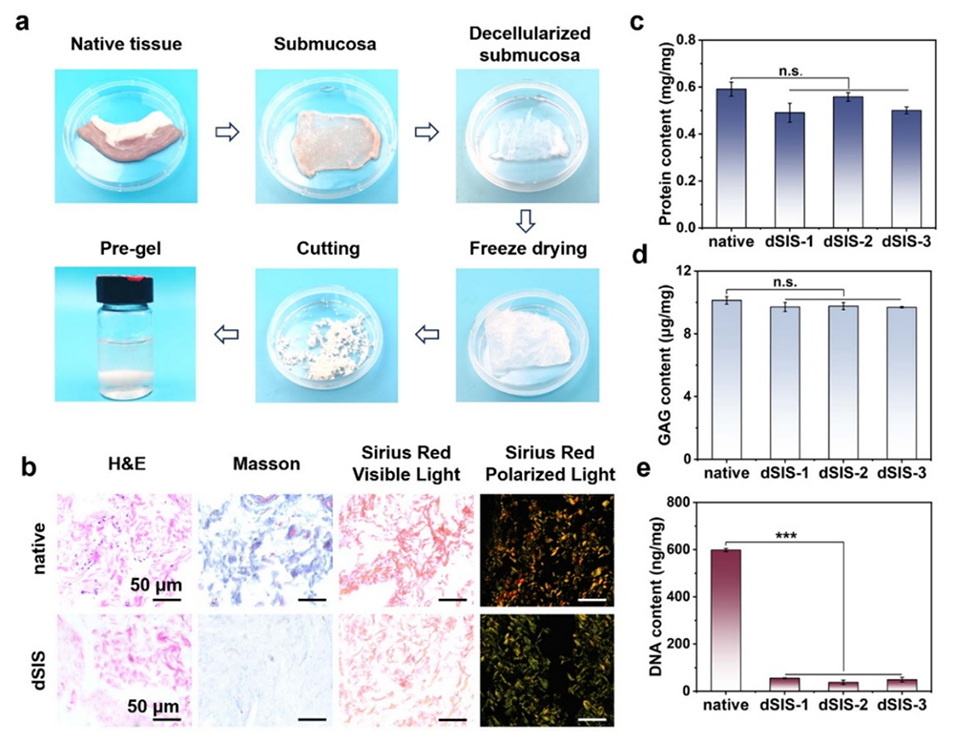
图2. 脱细胞效果分析。(a) 脱细胞小肠黏膜下层(dSIS)的简要制备流程包含猪小肠脱细胞处理的几个关键步骤。(b) dSIS的苏木精-伊红(H&E)染色、马松染色及天狼星红染色结果。(c) 蛋白质浓度、(d) GAG浓度和 (e) DNA浓度检测结果。
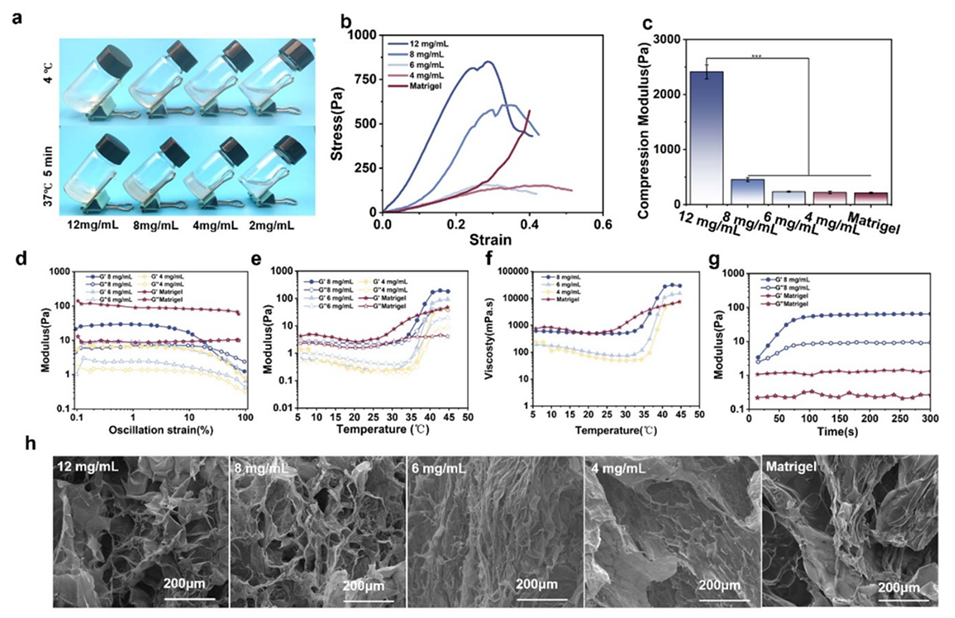
图3. 脱细胞小肠黏膜下层细胞外基质(dSISM)的表征。(a) dSISM的温敏凝胶化过程。(b) 应力-应变曲线和(c) 压缩刚度测试结果。(d)-(g) 流变学特性:(d) 通过振幅扫描(振荡应变范围0.01%-100%)确定线性粘弹区(LVR);(e) 模量变化和(f) 粘度变化(温度扫描范围4℃-50℃);(g) 37℃下的时间扫描模量变化。(h) dSISM与Matrigel的扫描电镜(SEM)图像。
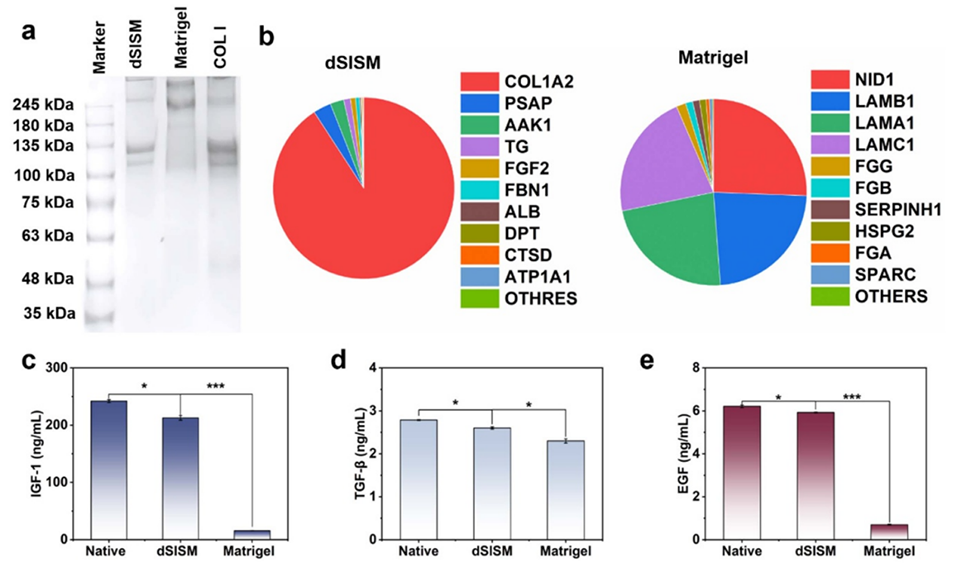
图4. dSISM的成分表征分析。(a) dSISM的SDS-PAGE电泳结果图。(b) dSISM与Matrigel的蛋白质组学分析。(c) IGF-1、(d) TGF-β和 (e) EGF的浓度检测结果。
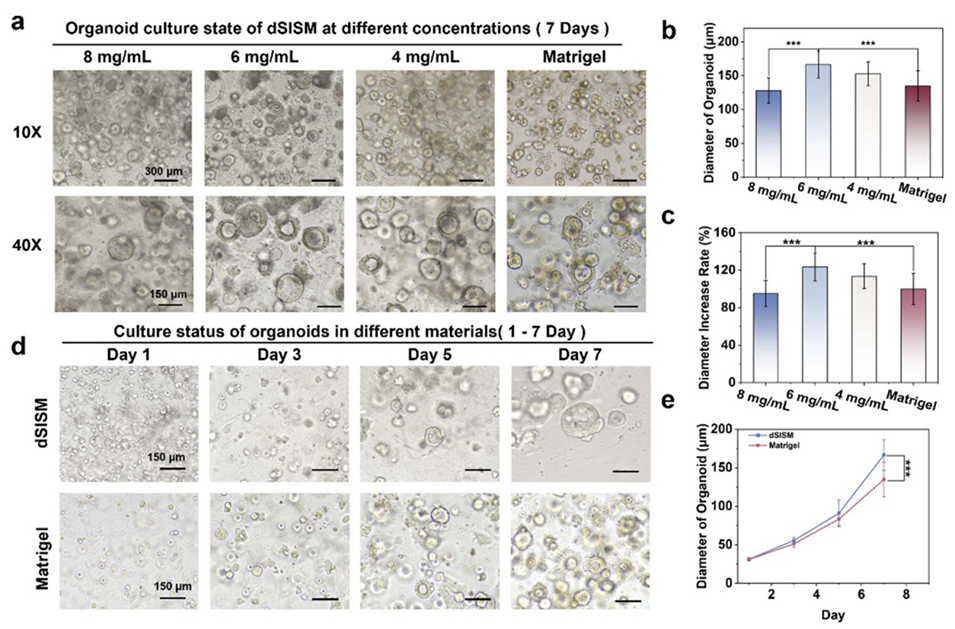
图5. 类器官在不同材料中的培养状态。(a) 不同浓度(4-8 mg/ml)dSISM中类器官的培养状态(7天)。(b) 类器官直径和 (c) 直径增长率。(d) 6 mg/ml dSISM与Matrigel中类器官的培养状态。(e) dSISM与Matrigel中类器官直径随时间的变化。
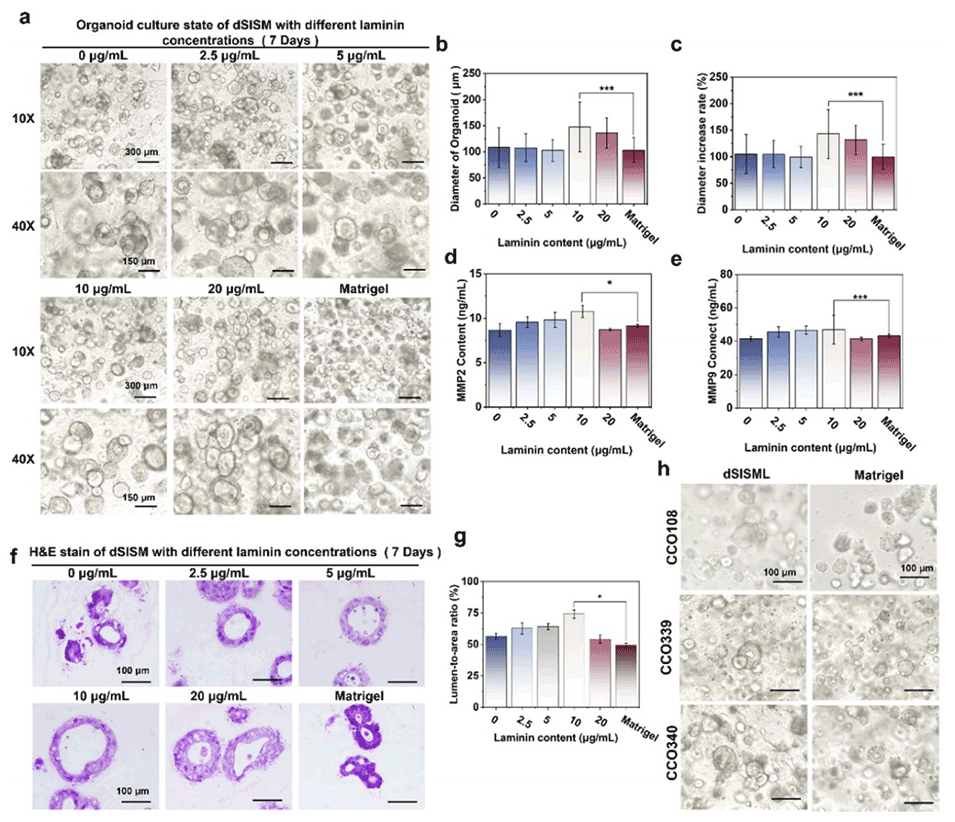
图6. (a) 不同层粘连蛋白浓度(0-20 μg/ml)的dSISM中类器官的培养状态(7天)。(b) 类器官直径和 (c) 直径增长率。(d) MMP2和 (e) MMP9的含量。(f) 不同层粘连蛋白浓度的dSISM中类器官的H&E染色结果。(g) dSISML中培养的类器官腔面积比。(h) 不同结直肠癌病例来源的类器官在dSISML中的培养状态。
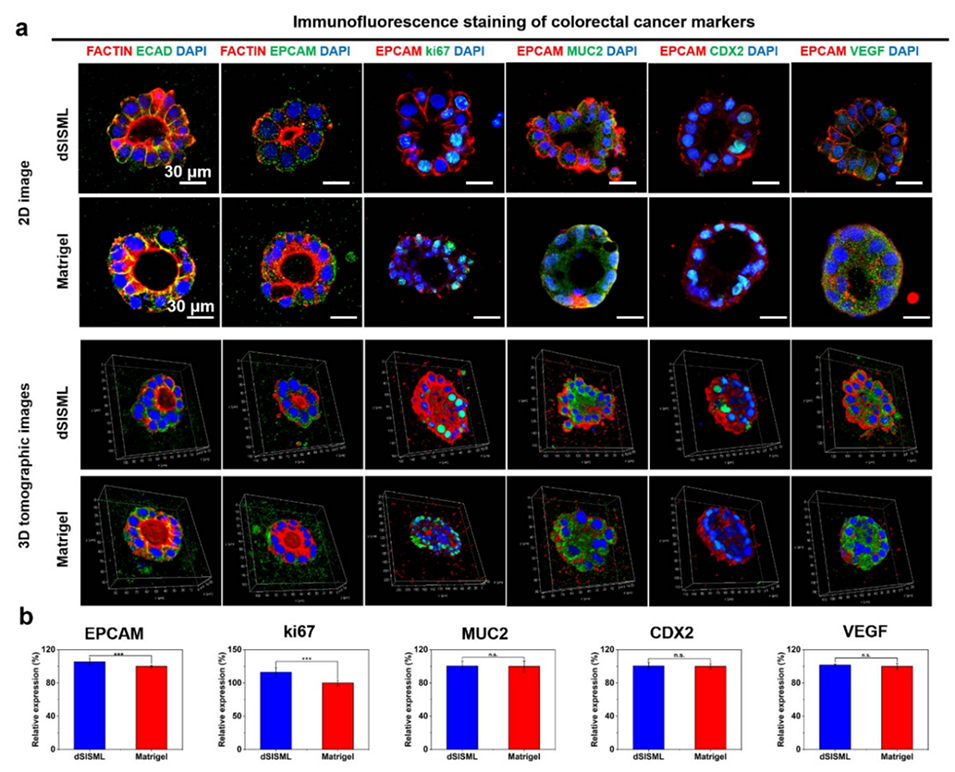
图7. (a) dSISML中培养的结直肠癌类器官的免疫荧光染色(肿瘤标志物)。(b) 类器官相关标志物的相对表达定量结果。
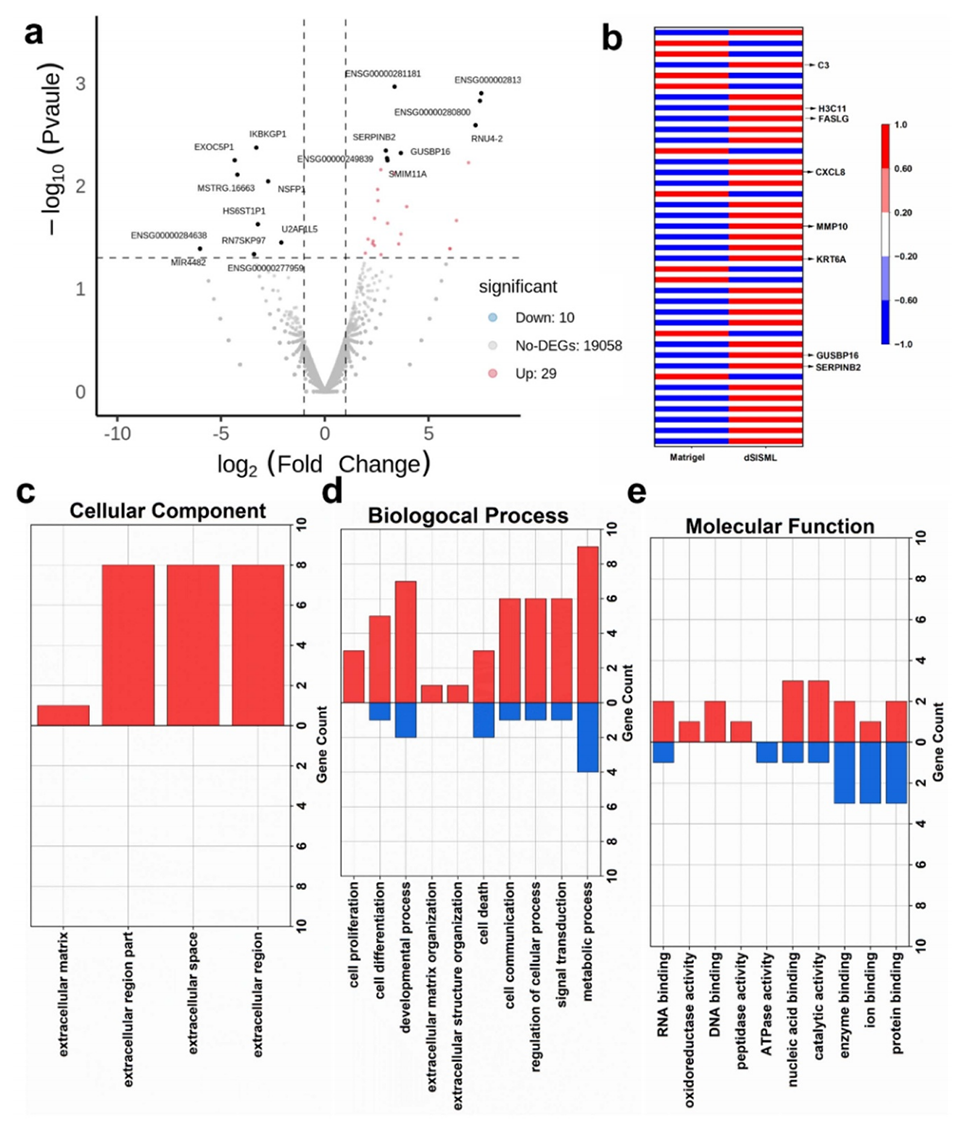
图8. dSISML与Matrigel中培养的类器官的转录组学分析。(a) 差异表达基因火山图。(b) 差异表达基因热图(标记基因为与细胞外基质相关的差异表达基因)。(c)、(d) 和 (e) 基因本体论(GO)富集分析结果。
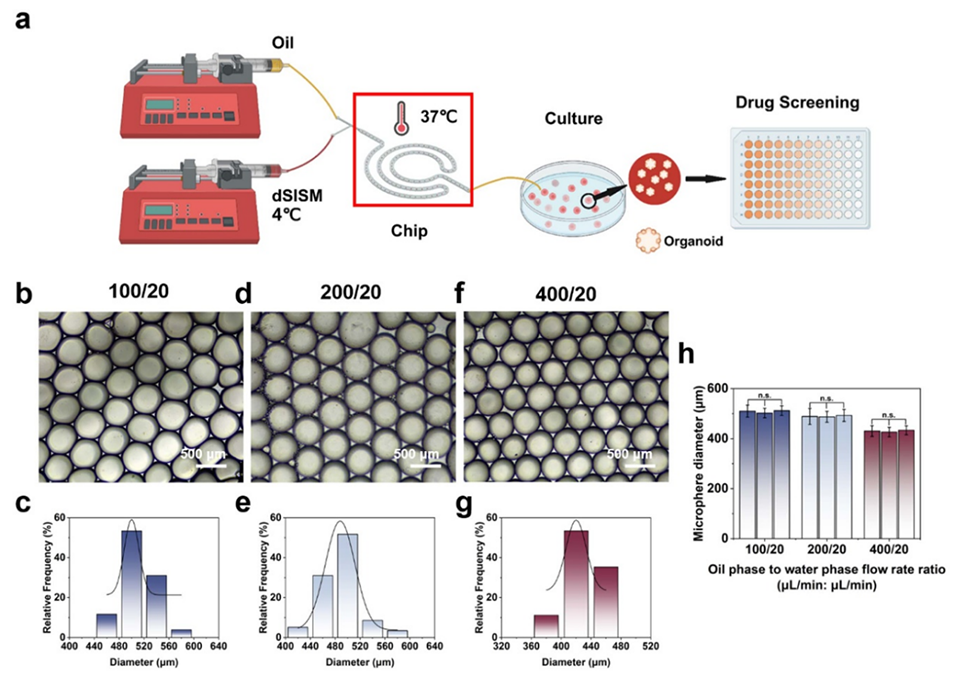
图9. 利用微流控芯片技术制备负载类器官的凝胶微球。(a) 微流控制备类器官微滴及后续培养、药物筛选的操作示意图。不同油相-水相流速比条件下的微球制备状态及直径分布:(b)、(c) 100 μl/min : 20 μl/min;(d)、(e) 200 μl/min : 20 μl/min;(f)、(g) 400 μl/min : 20 μl/min。(h) 不同油相-水相流速比下的微球直径。
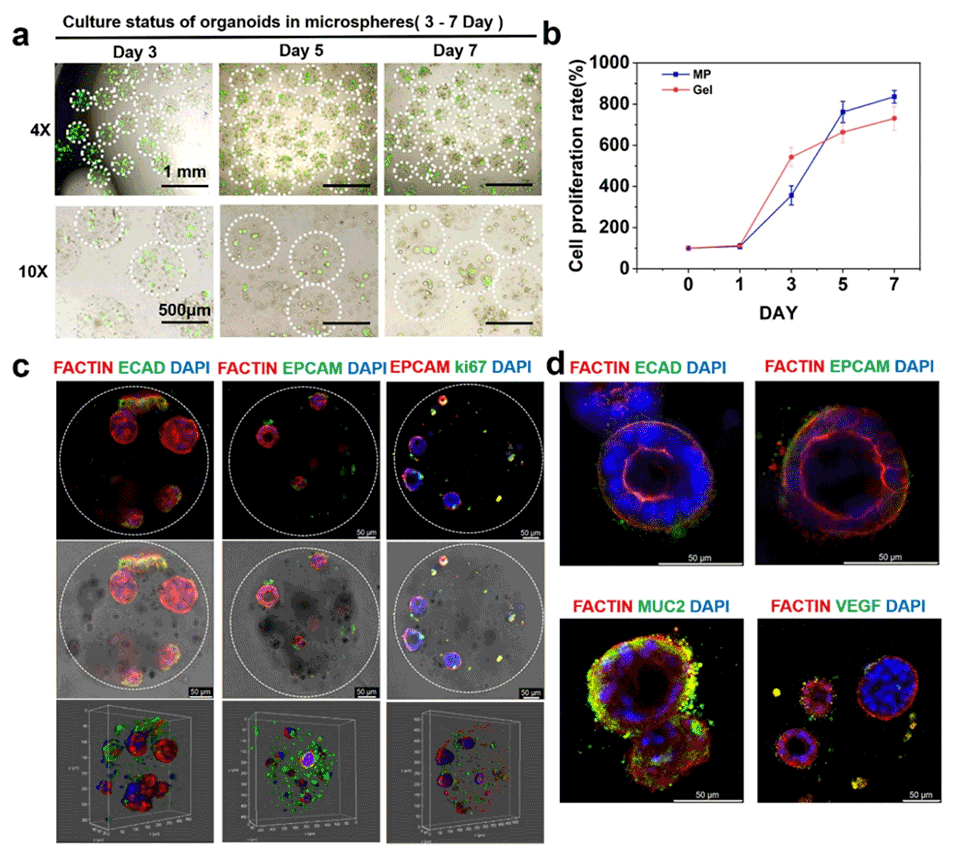
图10. 类器官微球的培养结果。(a) 微球中类器官的培养状态(钙黄绿素染色)。(b) 凝胶滴与微球中培养的类器官的CCK-8检测结果。(c)、(d) 微球内类器官的免疫荧光图像。
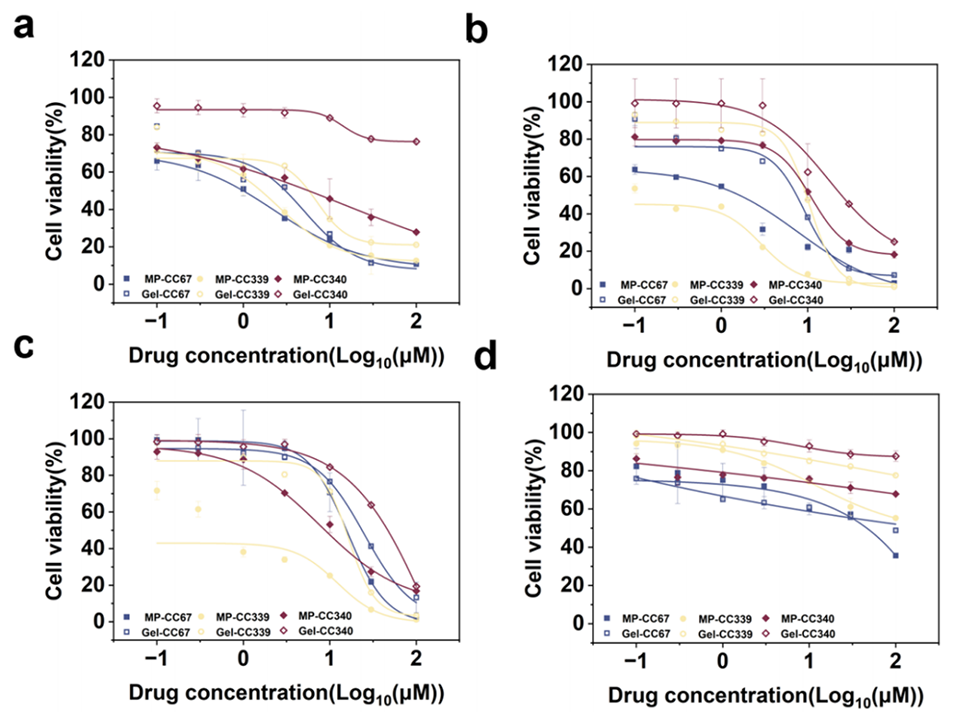
图11. 类器官微球的药物筛选结果。选取3个类器官病例(CCO67、CCO339、CCO340)和4种药物进行实验,分别为 (a) 5 - 氟尿嘧啶(5-FU)、(b) 顺铂(DDP)、(c) 奥沙利铂(OXA)和 (d) 紫杉醇(PTX)。
论文链接:https://doi.org/10.1088/1758-5090/adf099 (本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














