器官芯片(Organ-on-a-chip,OoC)是一种利用微流体技术模拟人体器官微生理环境的体外平台,能够重建组织结构、机械微环境和生化信号传导。自问世以来,OoC技术已从2D静态培养发展为3D动态仿生模型,广泛应用于生理和疾病建模、药物研发与筛选以及个性化医疗。
近年来,随着材料科学和制造技术的飞速发展,具有优异生物相容性和可调性能的水凝胶微球(HMs)已成为生物医学研究的重点。HMs可以模拟细胞外基质(ECM)的特性,解决传统OoC系统中缺乏生化和生物物理信号的问题,极大地推动了OoC技术的发展,并赋予其新的能力,如精准模拟细胞生态位微环境、构建复杂的系统模型和三维组织网络、封装和递送靶细胞或治疗剂,以及研究细胞间和器官间串扰等。

近期,重庆医科大学附属第一医院骨科黄伟教授、雷一霆博士团队联合香港中文大学生物医学工程系Prof. LI Zhong Alan等人发表综述,系统探讨了水凝胶微球在器官芯片系统中的应用创新及其在模拟人体器官微环境方面的显著作用。文章详细介绍了水凝胶微球的制备材料和方法,以及它们如何增强器官芯片系统的生理相关性和功能性,为未来的生物医学研究和个性化医疗提供了新的方向。相关研究成果以“Hydrogel Microspheres Empowering Organ‐on‐a‐Chip Systems: Innovations and Applications”为题目,发表在期刊《Small》上。
本文要点:
1、介绍了器官芯片(OoC)系统的概念、特点和制造策略。
2、讨论了水凝胶微球(HMs)的制备材料和方法,以及与OoC系统的集成策略。
3、探讨了HMs在OoC平台中的最新应用,并对其未来发展进行了展望。
一张图读懂全文
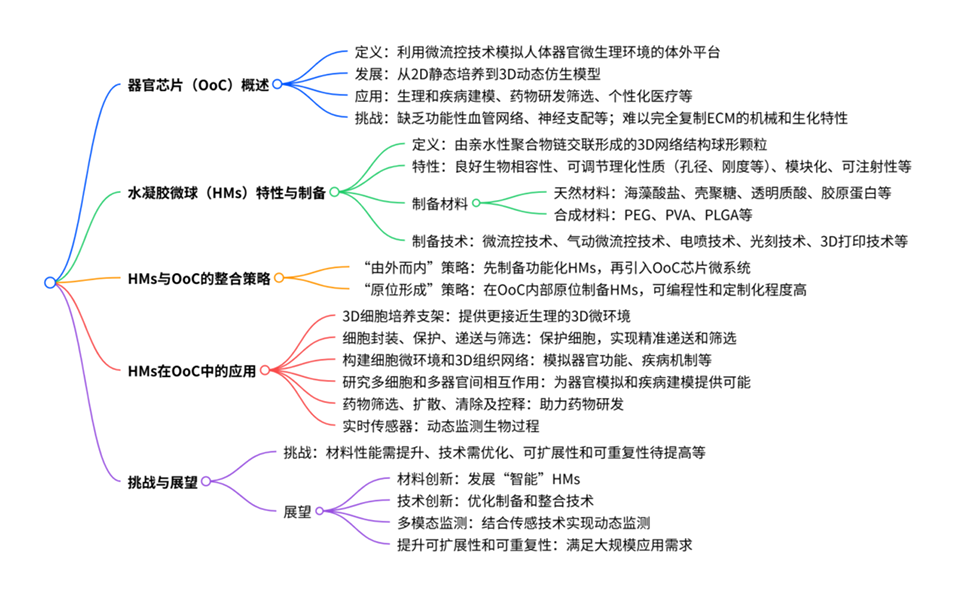
这些水凝胶微球制备技术有哪些优缺点?
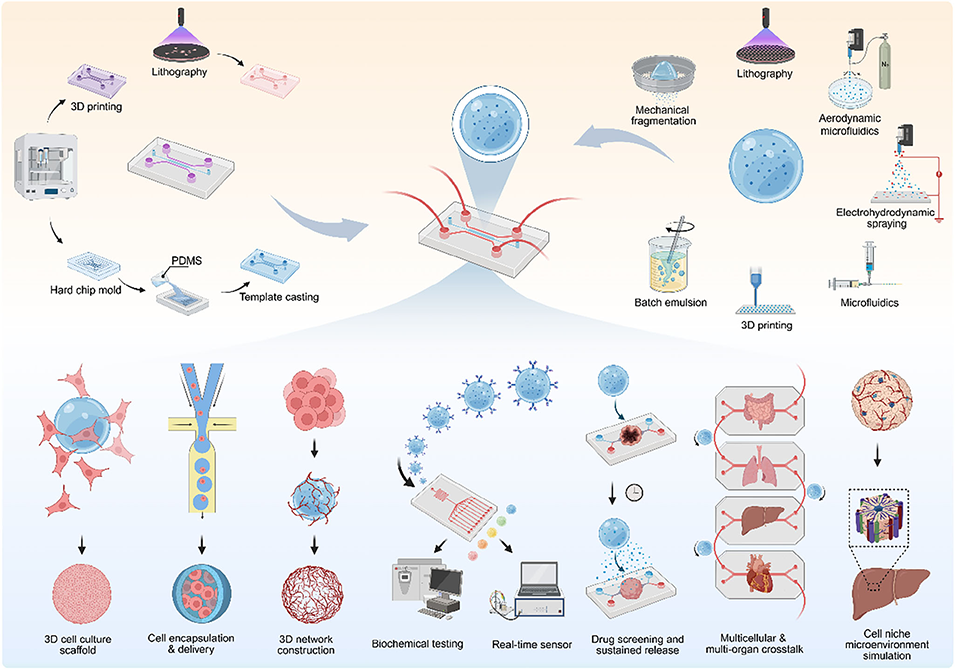
图1.水凝胶微球在器官芯片平台中的整合与应用
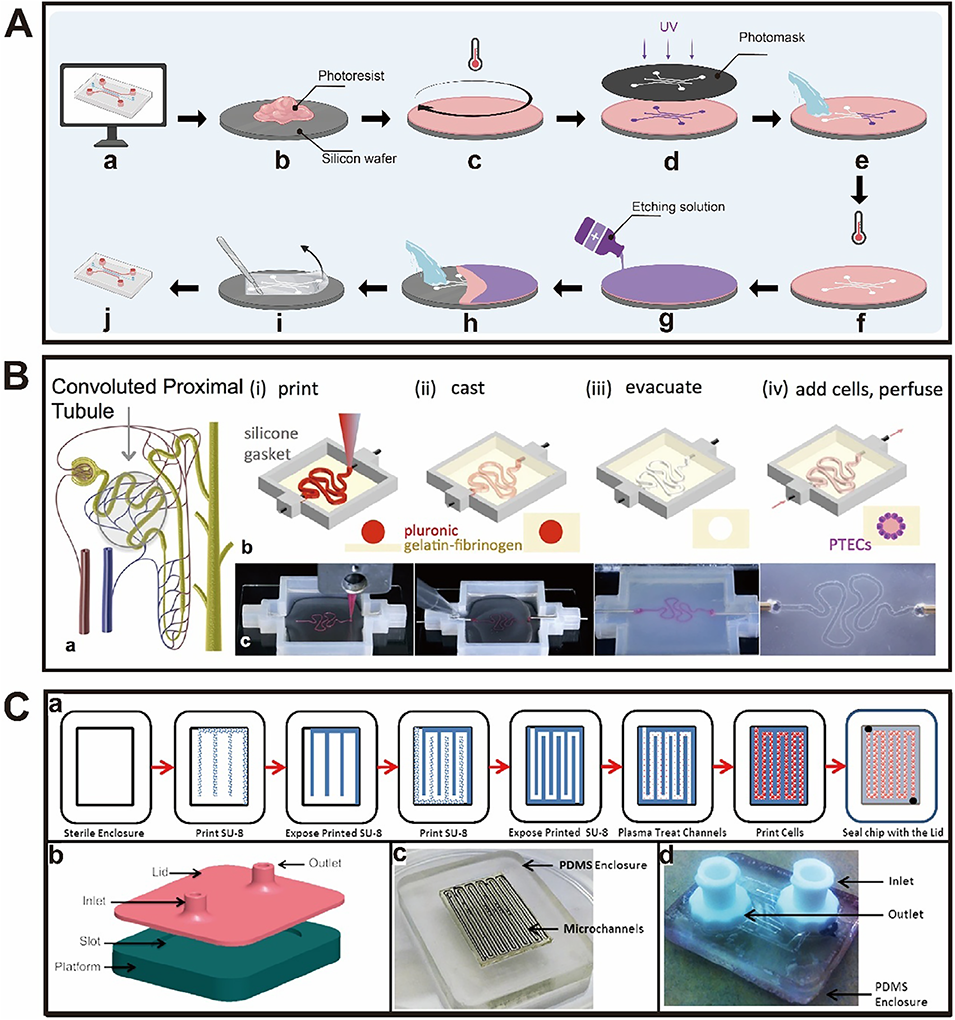
图2.器官芯片(OoC)的常见制备策略。A)软光刻制备微流控芯片的示意图。B)3D卷曲肾近端小管芯片。a)突出显示卷曲近端小管的肾单位示意图;b)和c)3D卷曲可灌注近端小管的制备步骤示意图及图像:i)先将牺牲墨水打印在明胶-纤维蛋白原细胞外基质(ECM)上;ii)在打印结构周围浇筑额外的ECM;iii)移除牺牲墨水以形成开放小管;iv)在小管内接种近端肾小管上皮细胞(PTEC)并进行长期灌注培养。C)a)细胞负载微流控芯片的制备步骤示意图;b)PDMS外壳模型;c)PDMS外壳槽内制备的微通道图像;d)带有盖子及进出口的完整细胞负载微流控芯片图像
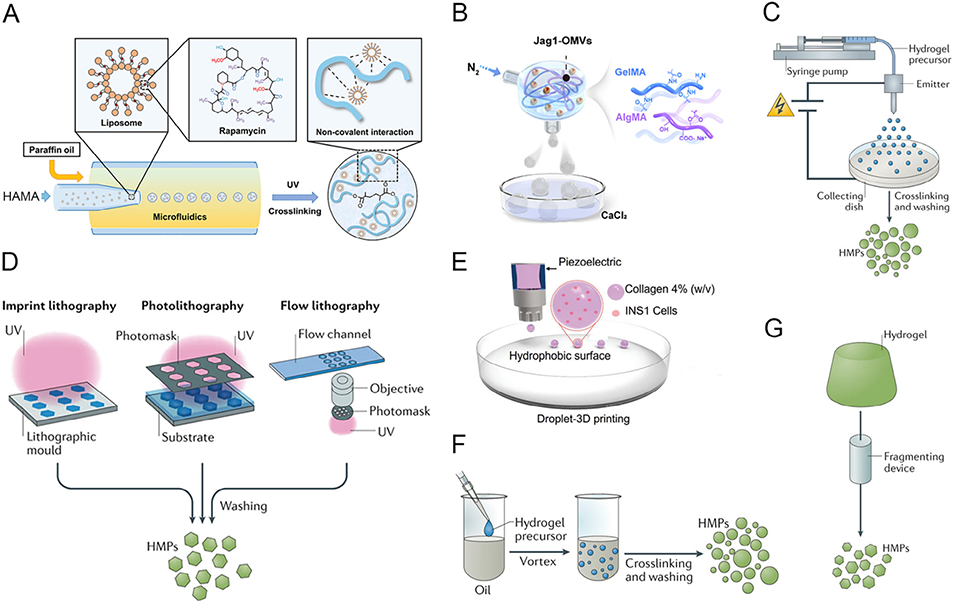
图3.水凝胶微球(HMs)的常见制备策略。A)微流控技术用于制备雷帕霉素脂质体(RAPA@Lipos)、光交联HAMA基质及微流控雷帕霉素脂质体-水凝胶微球(RAPA@Lipo@HMs)。B)气动微流控技术用于制备矿化水凝胶微球(MHMs)的过程。C)电流体喷雾技术:利用电场力使流动的溶液带电形成液滴,随后交联成水凝胶。D)光刻技术:以掩模或模具为模板制备微米级水凝胶。E)3D生物打印技术:示意图展示使用不同浓度单宁酸(TA)溶液交联制备INS-1E细胞负载球状体的过程。F)批量乳化技术:将互不相溶的液体(如油水)混合形成液滴,随后交联形成水凝胶微球。G)机械破碎技术:利用机械力将预制水凝胶破碎成更小颗粒。蓝色阴影表示未交联溶液,绿色阴影表示交联的水凝胶微粒或水凝胶。UV:紫外线
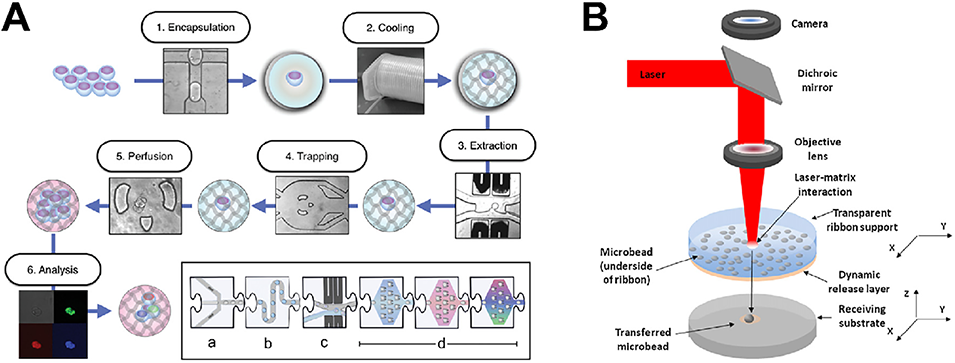
图4.水凝胶微球(HMs)整合到器官芯片(OoC)中的常见策略。A)本研究建立的克隆胚胎干细胞集落培养工作流程,步骤包括:1)a)使用基于液滴的微流控技术将单细胞包封到水凝胶液滴中(频率为291±11Hz);2)b)在冷却管路中孵育,使微液滴内形成水凝胶(以灰色图案表示);3)c)包封单细胞的水凝胶微球液滴在芯片上通过电聚结进行在线破乳,该步骤在包封后连续进行;4)水凝胶微球的空间固定;5)长期灌注培养及延时显微镜观察;6)d)在捕获装置中进行分析(如荧光检测、免疫染色、实时定量PCR)。B)激光直写(LDW)系统同步定位并打印微球到基底预设图案位点的示意图。单个激光脉冲作用于紫外透明带,使目标微球所在的动态释放层(DRL)局部蒸发;产生的蒸汽腔将含目标微球的液滴喷射到接收基底上。每次微球转移后,基底平台根据g代码蓝图移动到下一个图案位置
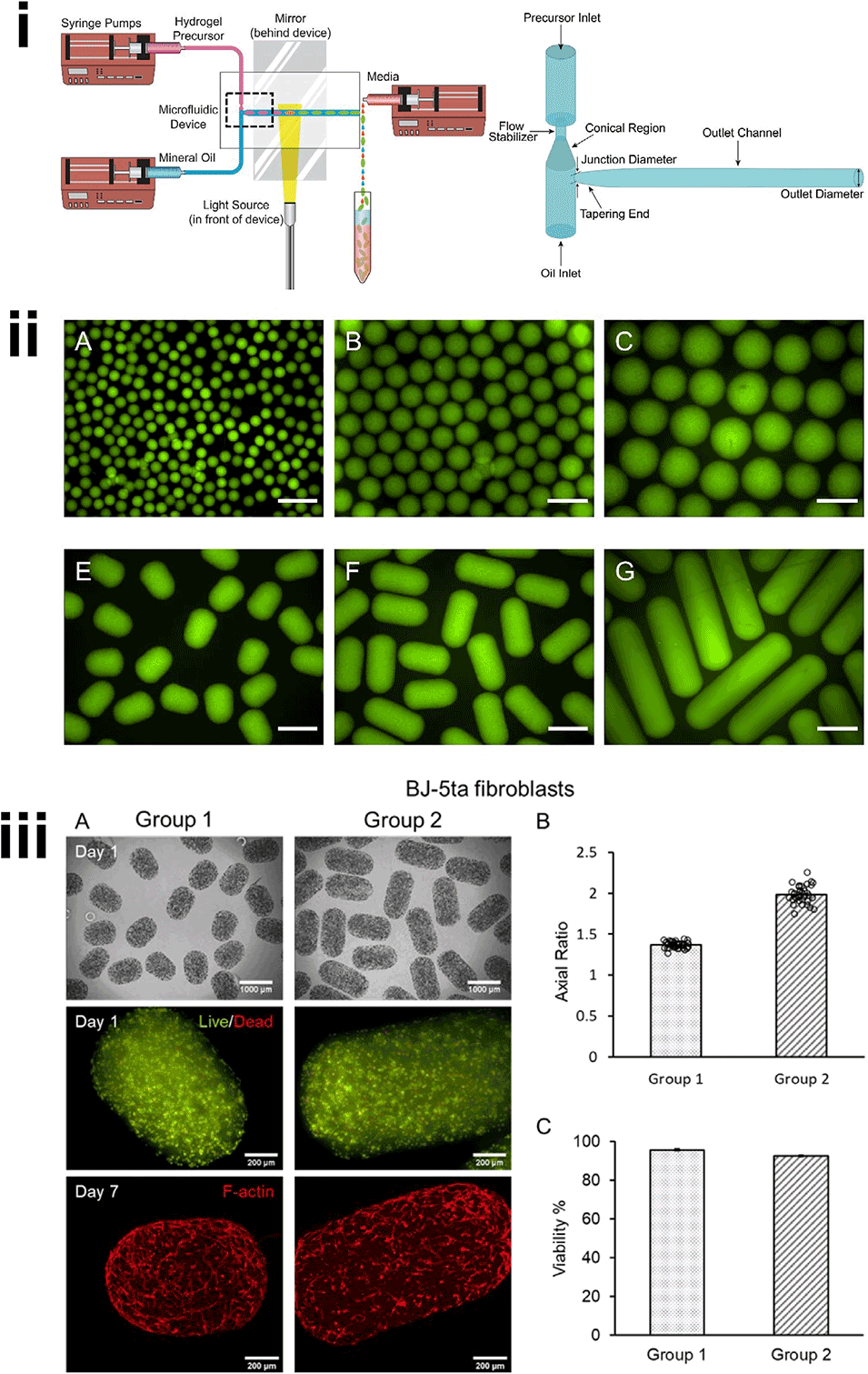
图5.(i)具有改进T型接头设计的微流控平台可对大型水凝胶微球(HMs)进行几何控制。(ii)不同几何形状的水凝胶微球。A-C)荧光显微镜图像显示,水凝胶微球具有高均一性、高圆度及较广的直径范围(水凝胶光交联所用光引发剂曙红Y的绿色自发荧光)。E-G)水凝胶微球具有高均一性及较广的纵横比(ARs)范围。比例尺=1000μm。(iii)不同纵横比的细胞负载水凝胶微球支持包封后细胞的正常活动。A)成纤维细胞负载水凝胶微球具有均一的几何形状和均匀的细胞分布(相差显微镜图像);包封的细胞在包封后保持高活性,并形成肌动蛋白丝网络(荧光图像)。B)成纤维细胞负载水凝胶微球在包封后1天,两组的纵横比分别为1.37±0.04(变异系数=0.03)和1.98±0.10(变异系数=0.05)(每组n>37个微球)。C)包封的成纤维细胞在包封后1天的存活率分别为96±1%和93±1%(每组n=3个微球)
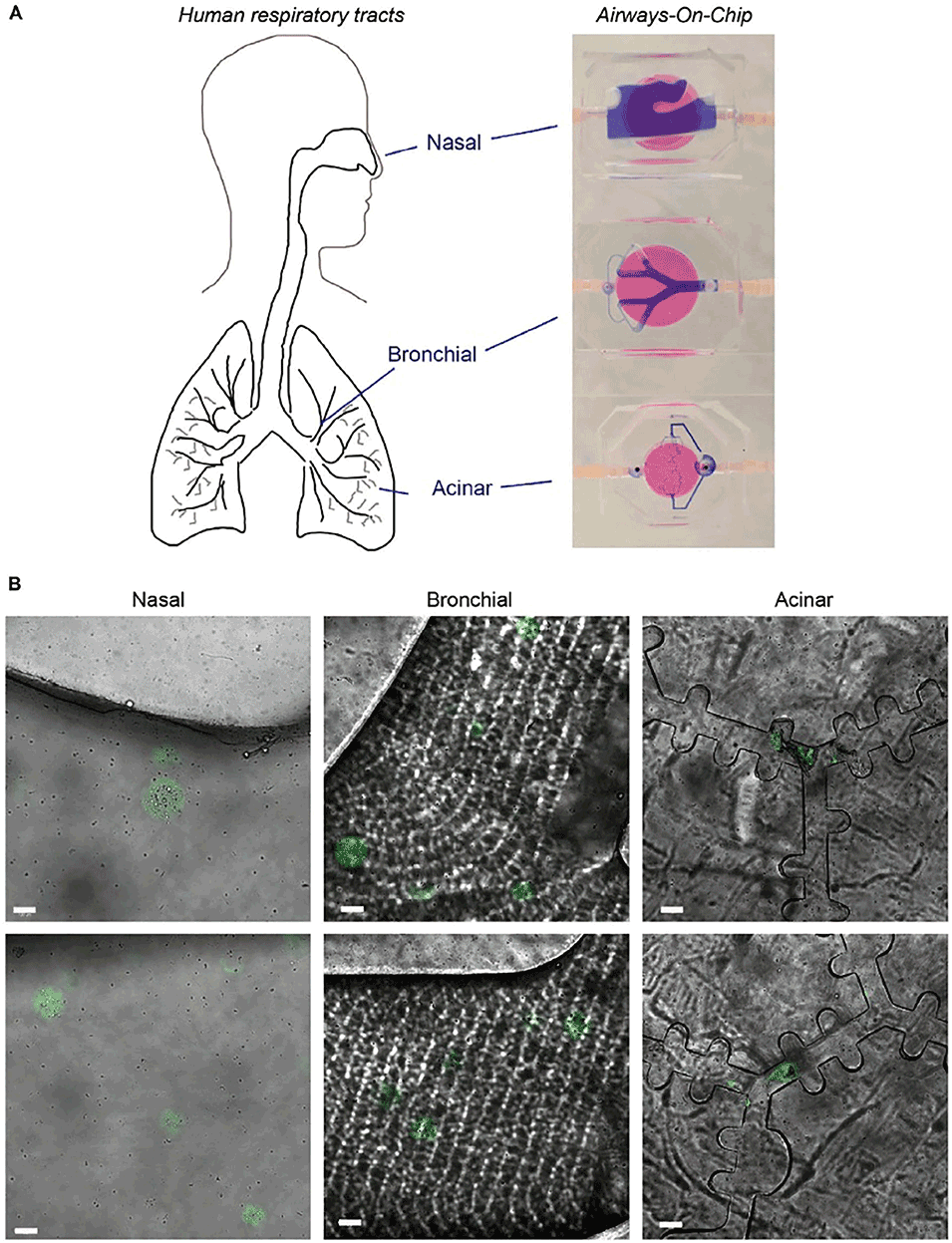
图6.微球递送至人体呼吸道模型。A)人体呼吸道(鼻腔、支气管和肺泡)及对应的呼吸道芯片模型示意图。模型中注入台盼蓝以显示腔室内的流动情况。B)鼻腔、支气管和肺泡腔室的共聚焦图像,显示钙黄绿素染色的微球(绿色)。展示三个独立实验中每个腔室的两张代表性图像。比例尺100μm
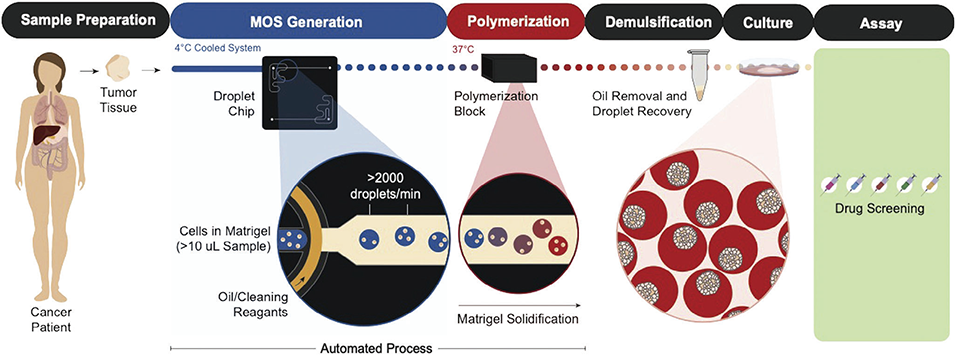
图7.结直肠癌微器官球(CRC MOS)的建立及其在药物筛选与临床验证中的应用。结直肠癌微器官球的制备及药物筛选流程
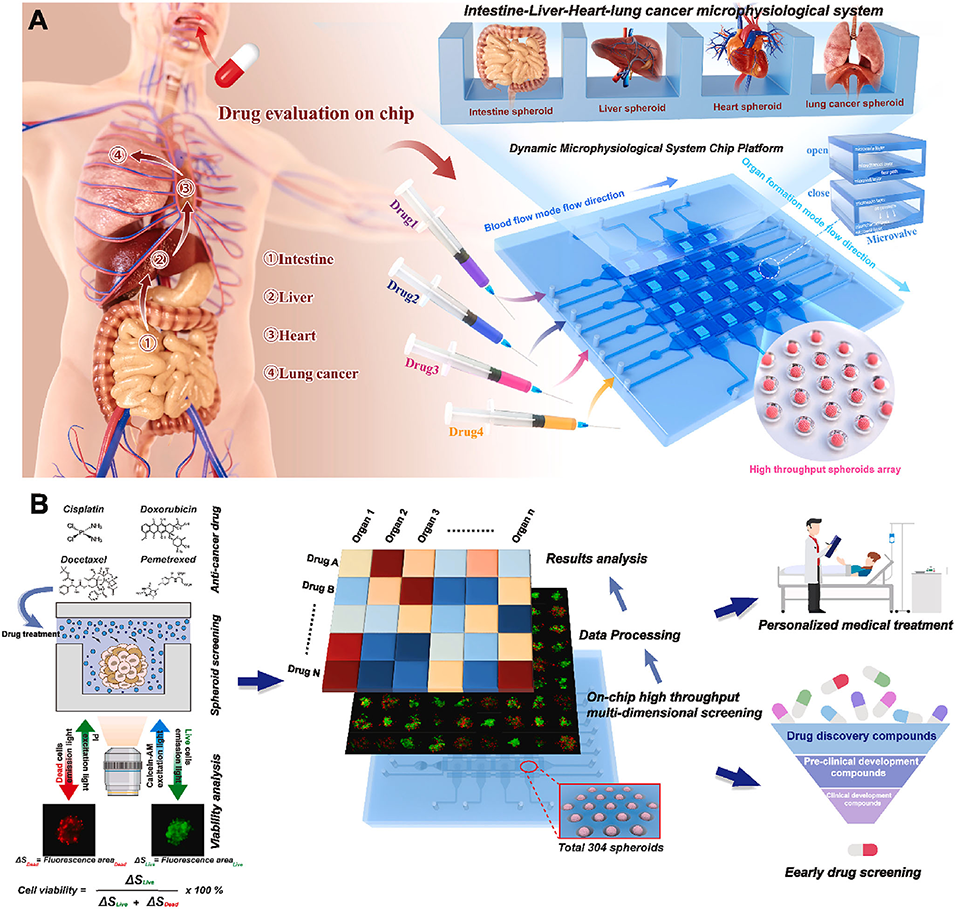
图8.微生理系统芯片平台(MSCP)可构建微生理系统并进行全面药物筛选。A)左:口服抗肺癌药物吸收过程示意图,显示药物在肠道吸收后通过血管流经肝、心、肺等重要器官;右:MSCP可构建高通量肠-肝-心-肺癌微生理系统,同时评估四种不同药物。该芯片微生理系统模拟左图所示的体内过程,实现高通量、多药物同步测试的全面药物评估。B)基本检测原理、平台应用流程及前景示意图。抗癌药物作用于微孔中的球状体,通过显微镜检测活/死染色荧光反映球状体的细胞活力。MSCP集成4×4微孔阵列,可同时培养304个球状体。球状体活力数据经处理分析后,全面的药物筛选结果将以热图呈现。高通量微生理系统结合多药物同步评估,使MSCP成为个性化医疗和药物开发的便捷高效平台
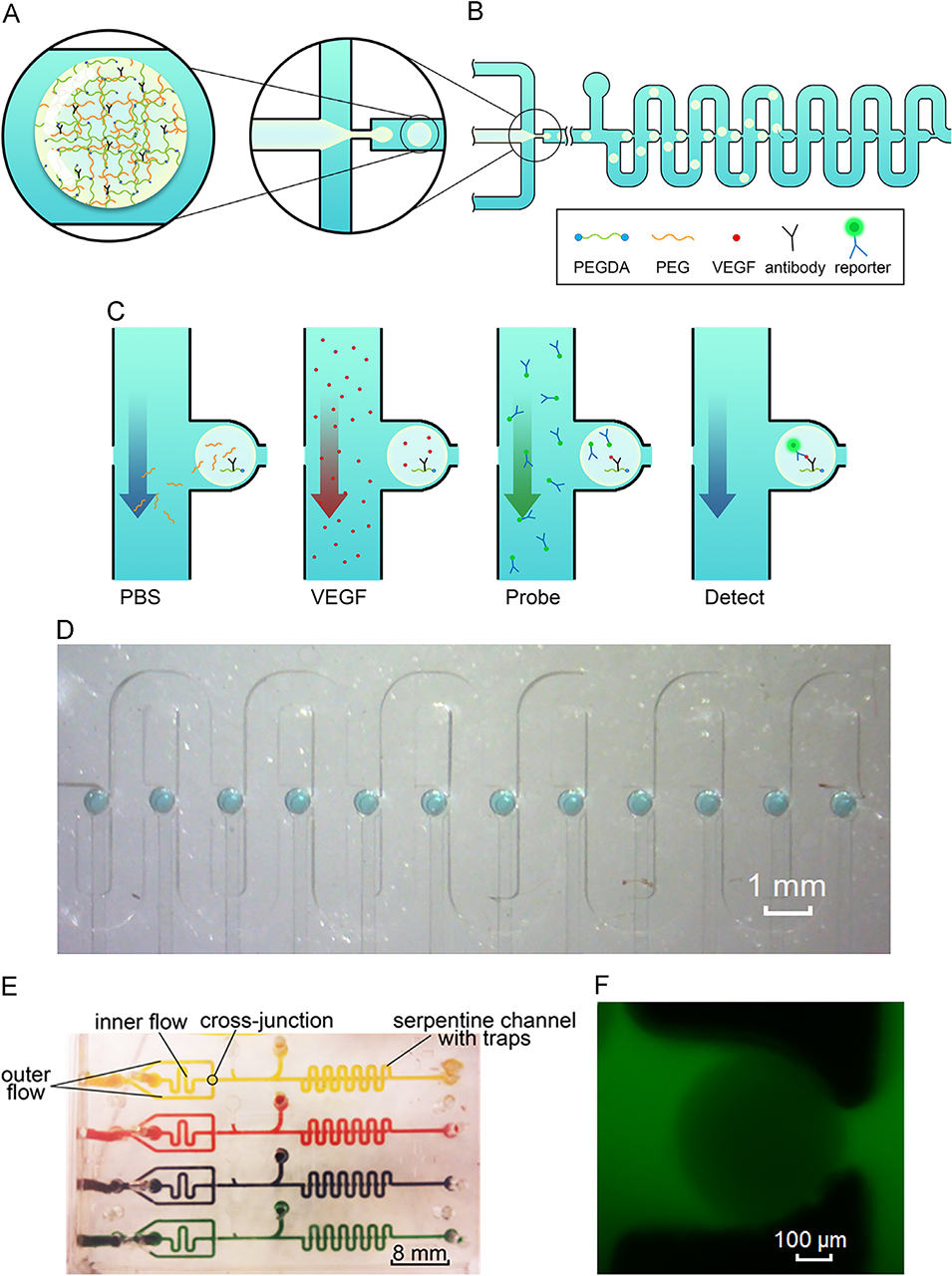
图9.检测系统示意图。A)微流控液滴生成器可在芯片上生成并调节多孔水凝胶液滴,其球形和体积可控。B)液滴生成器与蛇形捕获阵列集成,可精确定位生成的水凝胶液滴。C)此外,该系统可使捕获的液滴免受蛇形通道中试剂流的影响,实现可预测的微流控增强传质,以满足检测流程需求。D)形成一排用于蛋白质检测的捕获液滴(用食用蓝色染料染色)。E)在原型中,实现了4行12列共48个捕获位点,以展示阵列的可扩展性(实际装置中通道内有黄、红、紫、绿四种食用染料)。F)每个捕获位点包含单个多孔水凝胶液滴,其检测动力学可预测,如250kDa异硫氰酸荧光素(FITC)染料的渗透所示
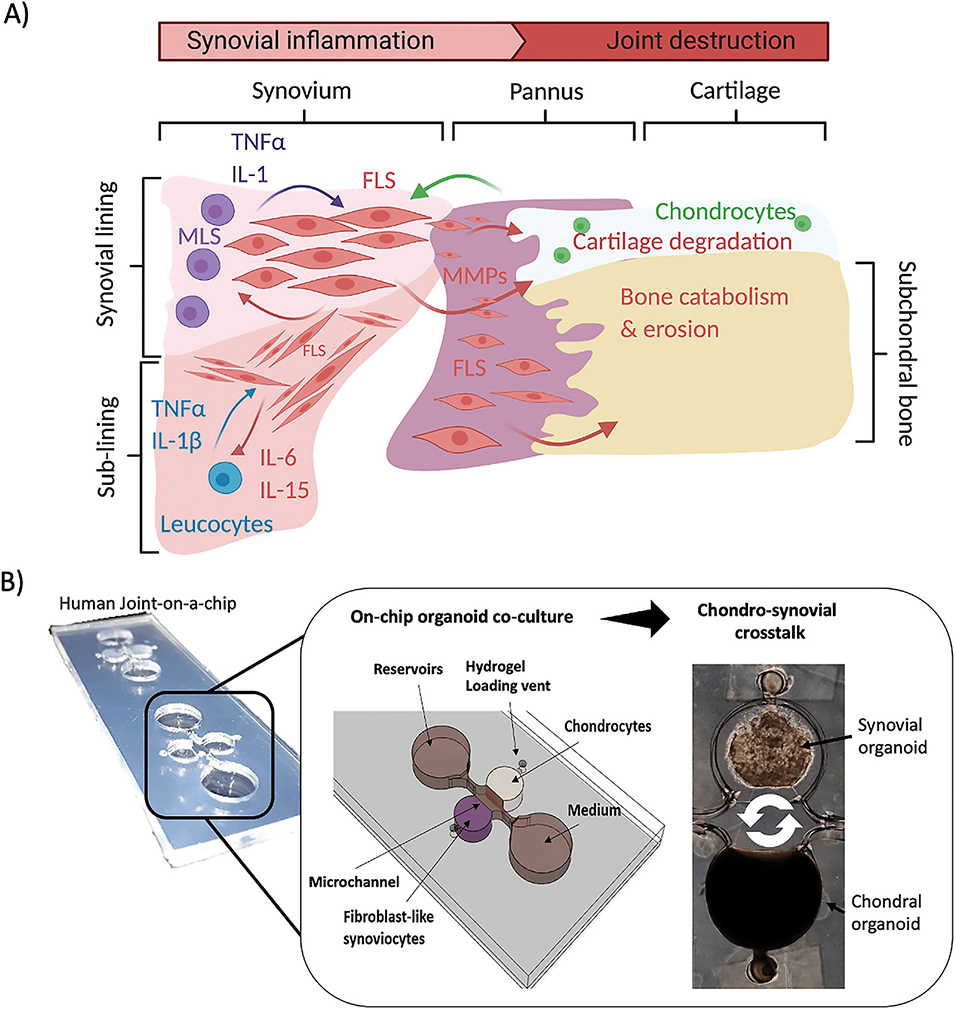
图10.A)滑膜活动影响滑膜膝关节软骨和软骨下骨的示意图。B)基于类器官的关节芯片共培养系统概述,该系统包含软骨和滑膜腔室,用于研究相互的炎症交叉对话
论文链接:https://doi.org/10.1002/smll.202504563














