尽管微流控连续流聚合酶链反应(CF-PCR)具有简化热管理和加速传热等优点,但通过CF-PCR处理多个靶标仍然存在挑战,尤其是在空间多路复用方面。将目标样本分割为液滴作为独立反应单元是实现空间多路复用的有效方法。然而,传统液滴生成技术需同时操控油水两相,增加了多目标检测时通道设计和操作的复杂性。

近期,青岛科技大学马翠萍教授团队提出了一种基于水相自驱动的新型液滴生成方法,该方法利用拉普拉斯压力原理和分时流体加载生成液滴,简化了芯片设计与操作,并成功将其应用于多重连续流PCR,实现了多目标的快速检测。相关研究以“A novel method of droplet generation based on the self-propelling of water phase and its potential application in multiplexing continuous flow PCR”为题目,发表在期刊《Biosensors and Bioelectronics》上。
本文要点:
1、本文介绍了一种基于水相自驱动的新型液滴生成方法及其在多重连续流PCR(CF-PCR)中的潜在应用。
2、该方法利用拉普拉斯压力原理,通过流体加载的时间顺序而非同时管理流体,实现水相自驱动生成液滴,一次只需操作一种流体,简化了芯片设计、设备配置和操作。
3、通过兼具样品目标溶液分割和液滴生成功能的多个微结构,可生成空间多重液滴。
4、四种由含PCR混合液的目标溶液复溶预加载特异性引物所生成的液滴,在10分钟内通过蛇形通道完成了连续流PCR扩增。
水相自推进液滴生成机制如何突破传统微流控技术的操作瓶颈?
传统液滴生成需同时调控油/水两相的流速与压力,导致多通道并行检测时系统复杂度剧增(如阀门控制、通道交叉污染风险)。本研究创新性地利用拉普拉斯压力差驱动的被动式流体控制:
1、时序操作替代同步操控:先加载样本溶液至微结构捕获区,再注入油相,通过油-水界面曲率差异(ΔP=2γ(1/R2−1/R1))驱动水相自发迁移,仅需调控油相压力即可生成液滴;
2、几何结构主导液滴均一性:三角形障碍物与圆形反应室协同控制液滴断裂点,使液滴体积变异系数<5%(55±2.7 nL),避免传统主动驱动造成的尺寸波动。
该机制将流体动力学与界面科学结合,为开发"无泵式"微流控系统提供新思路,尤其适用于资源受限场景。
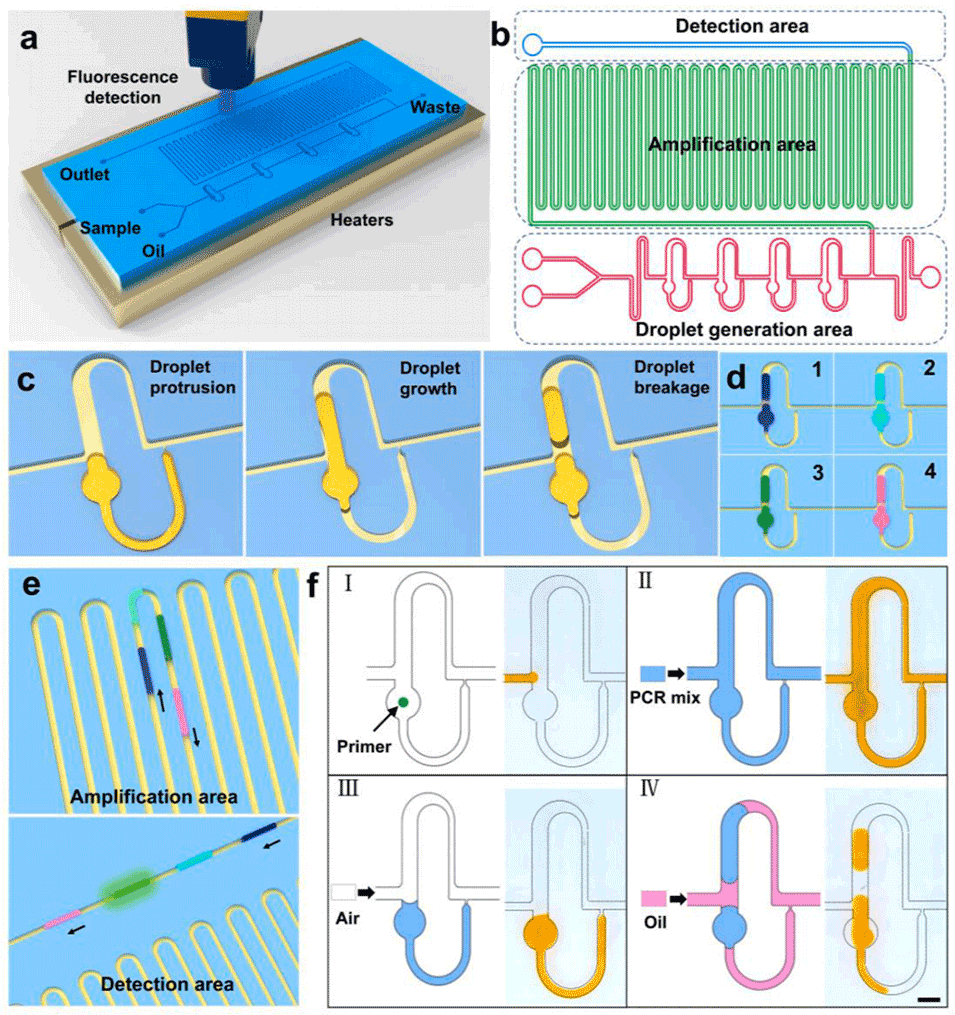
图1.设备设计概述及机构说明

图2.液滴生成微结构的描述及影响气塞形成的因素
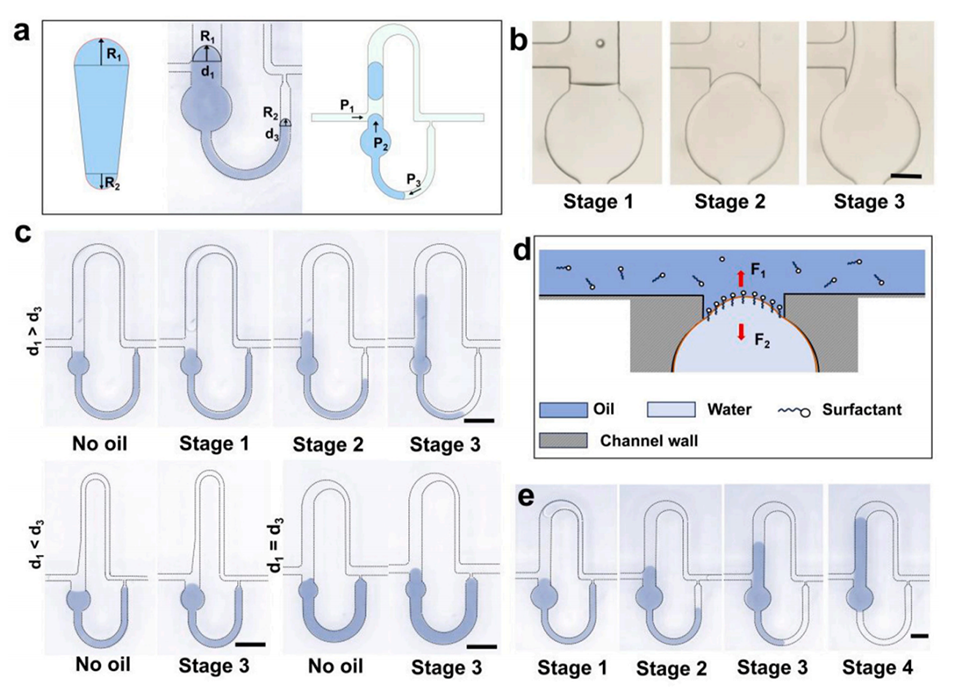
图3.液滴生成机理及影响液滴突出的因素演示
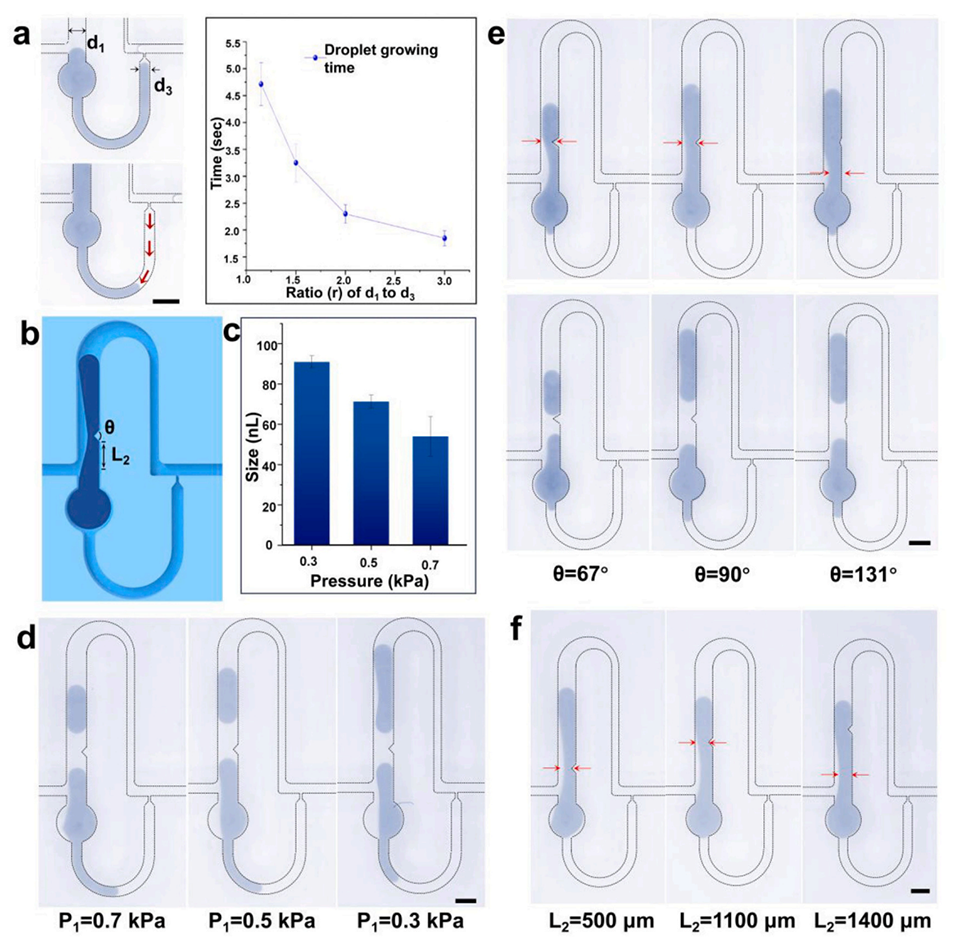
图4.生长通道尺寸和油相流速对液滴生成的影响
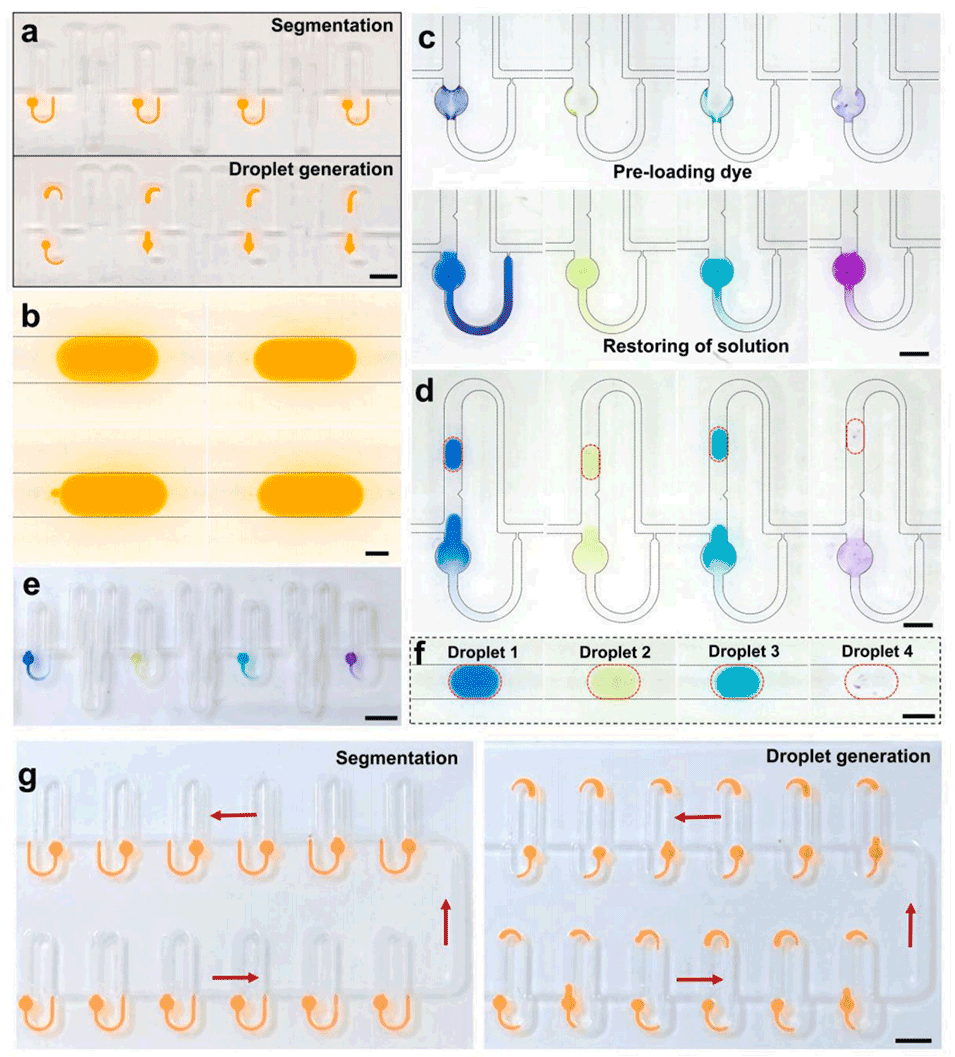
图5.多重液滴的生成过程
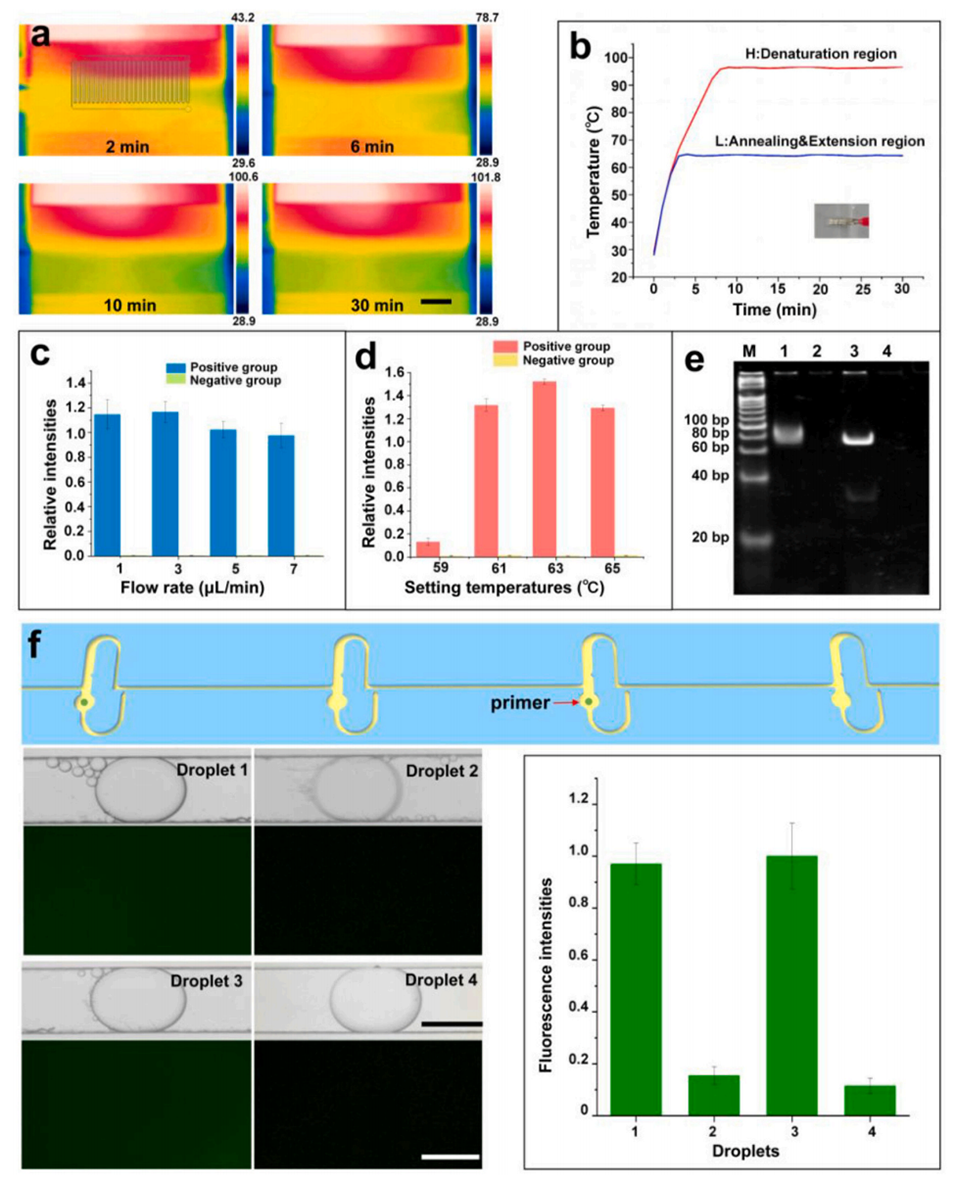
图6.热管理、流速优化及大肠杆菌基因组DNA扩增的结果
论文链接:https://doi.org/10.1016/j.bios.2025.117400














