
导读:
近期,山西农业大学生命科学学院申少斐教授团队发表综述,聚焦机器学习增强微流控细胞分选技术的前沿进展,系统梳理了主动式(磁激活、介电泳、声学流体、光镊)和被动式(确定性横向位移、惯性、粘弹性)两类微流控分选技术的原理、效率与应用场景,深入分析了传统机器学习(如支持向量机、K近邻)和深度学习(如卷积神经网络、YOLO、残差网络)在流场优化、细胞分类、误差校正中的融合应用,指出了模型泛化性、软硬件集成等核心挑战,同时展望了片上智能系统、多模态数据融合等未来方向,为精准医学的发展提供了关键技术参考。相关研究成果以“Advances in machine learning–enhanced microfluidic cell sorting”为题目,发表在期刊《Science Advances》上。
本文要点:
1、该综述聚焦机器学习增强的微流控细胞分选技术,系统阐述微流控与机器学习的融合应用及发展前景。
2、微流控细胞分选技术分为主动式(依赖外部场调制)和被动式(基于通道几何或流体动力学优化),前者包括磁激活、介电电泳等技术,后者涵盖确定性横向位移、惯性微流控等,两类技术各具优势但面临样本异质性、通道堵塞等问题。
3、机器学习的融合应用中,传统机器学习(如支持向量机、K近邻)需手动设计特征,在细胞分类中提升了自动化程度和客观性;深度学习(如卷积神经网络、YOLO框架)可自动提取复杂特征,显著提高分选精度和效率,尤其适用于稀有细胞识别。
4、挑战与未来方向方面,当前存在模型泛化性不足、软硬件集成复杂等挑战,未来需推动微流控系统功能集成、机器学习算法创新,以及多模态数据融合,助力精准医疗和个性化治疗发展。
一张图读懂全文
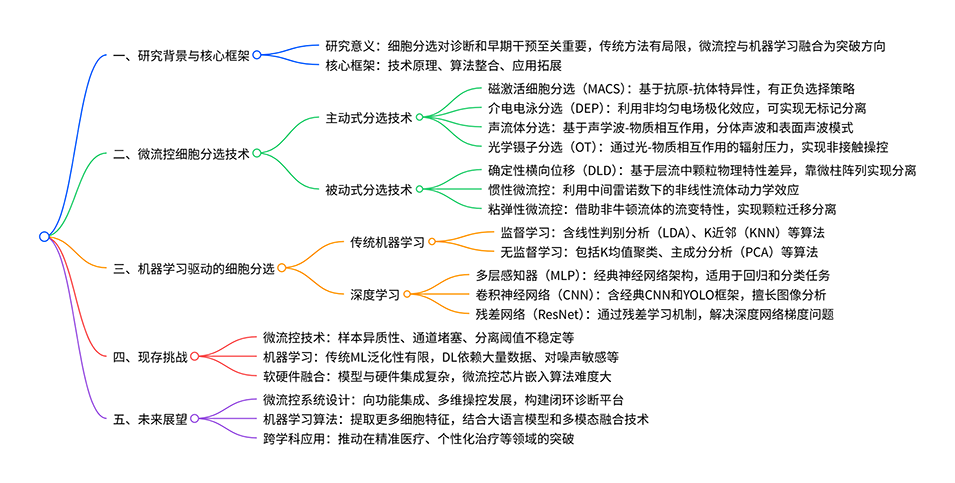
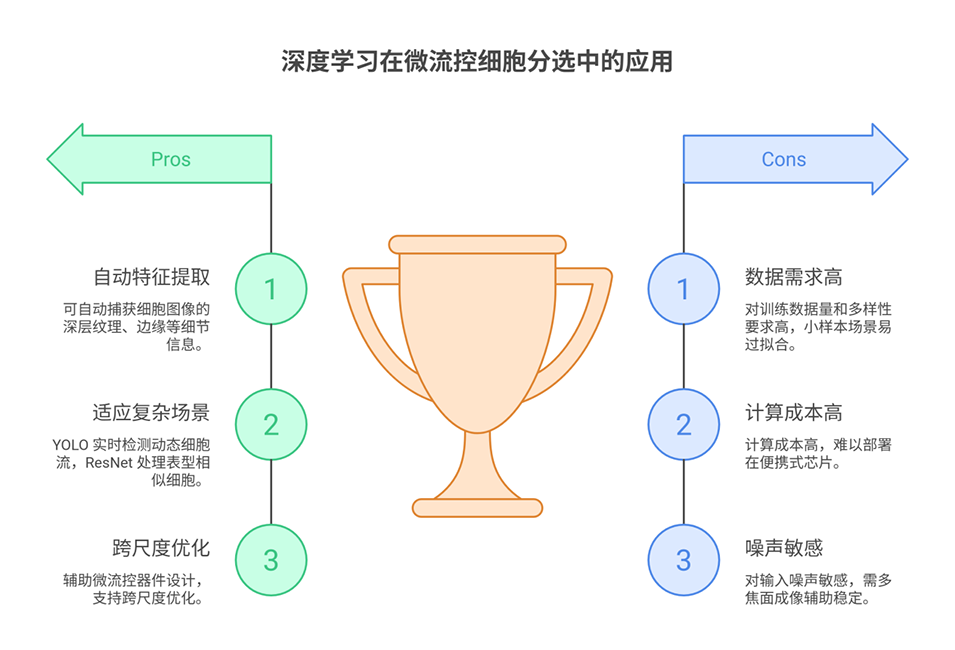
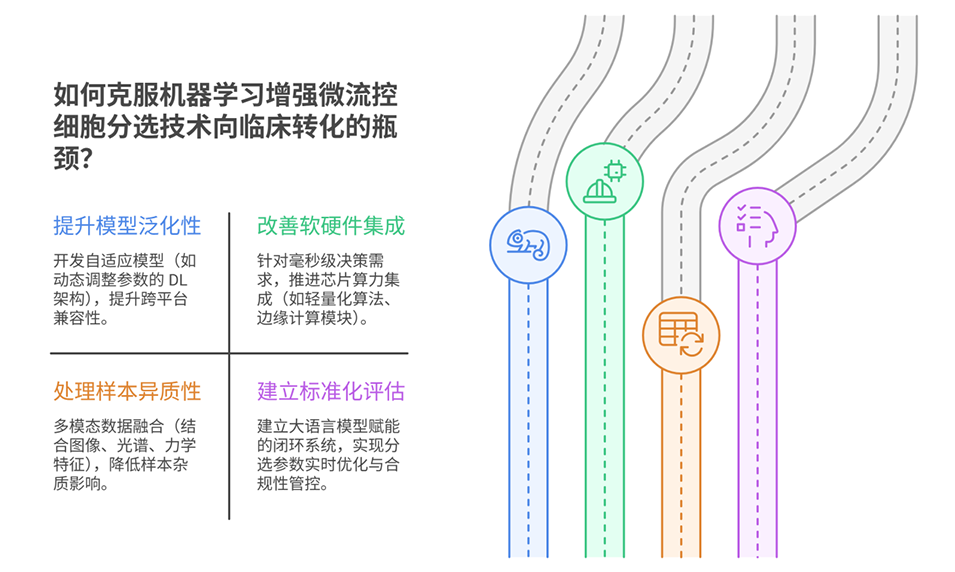
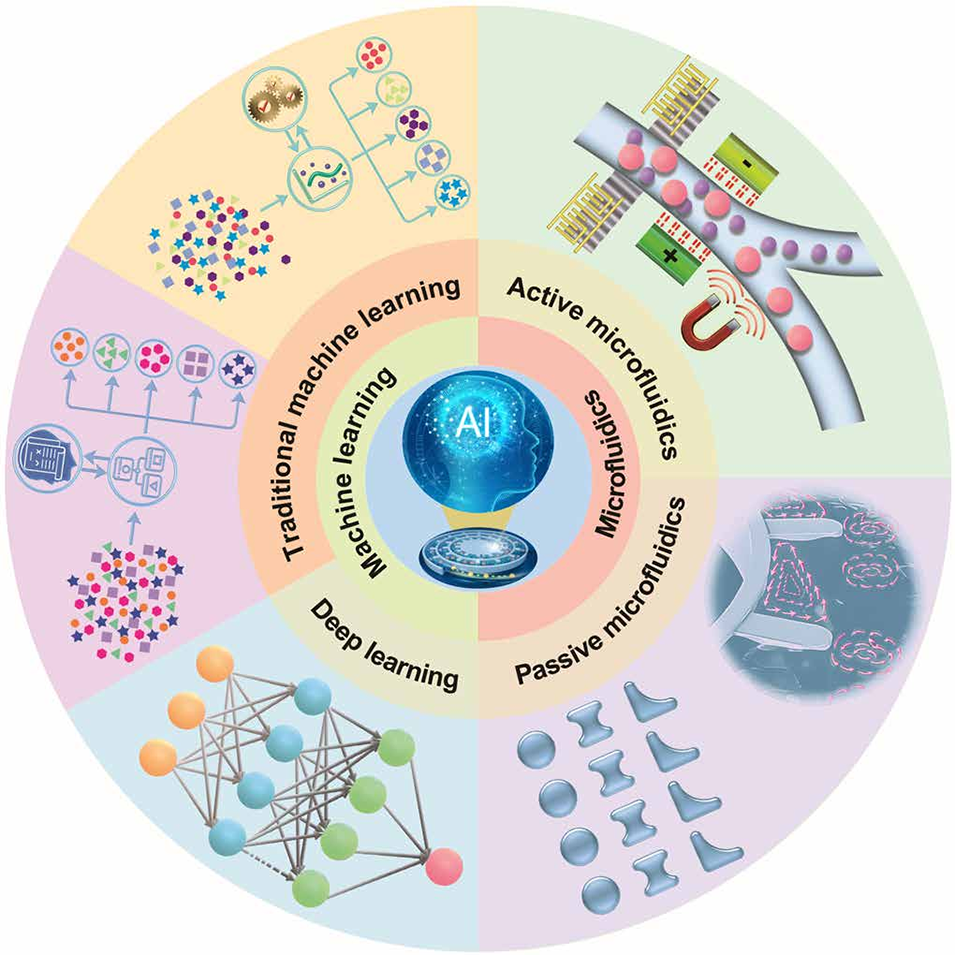
图1. 主动式和被动式微流控分选技术的进展概述,以及传统机器学习与现代深度学习在智能细胞分选中的融合应用,阐释了 “机器学习增强微流控细胞分选” 的核心主题。
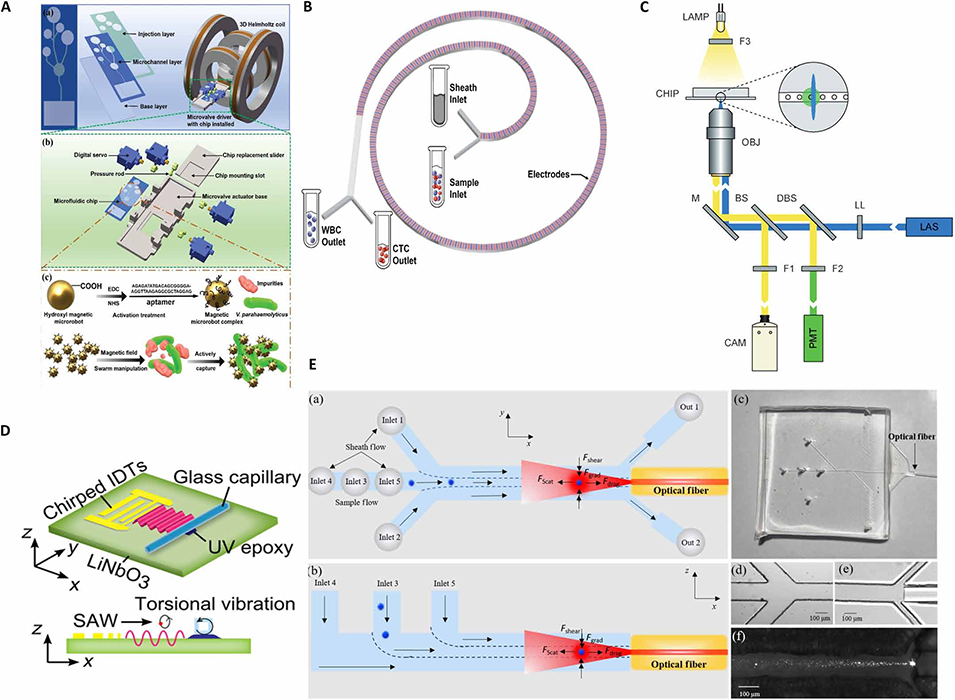
图2. 主动式细胞分选技术。(A)基于毛细管的微流控芯片集成免疫磁珠,其结构设计经过优化,可用于磁珠制备和目标细胞捕获。(B)针对尺寸重叠的细胞,介电泳-惯性微流控器件结合介电泳力和惯性聚焦机制,实现基于尺寸的分离。(C)单细胞微流控液滴的荧光激活介电泳分选。(D)声学微腔平台,通过声学辐射力与单涡旋流动诱导的粘性效应协同作用,实现亚微米/纳米颗粒的富集。(E)光流体动态镊子通过光驱动的流体动力学场实现对颗粒的精准操控,在非接触分选应用中展现出多功能性。
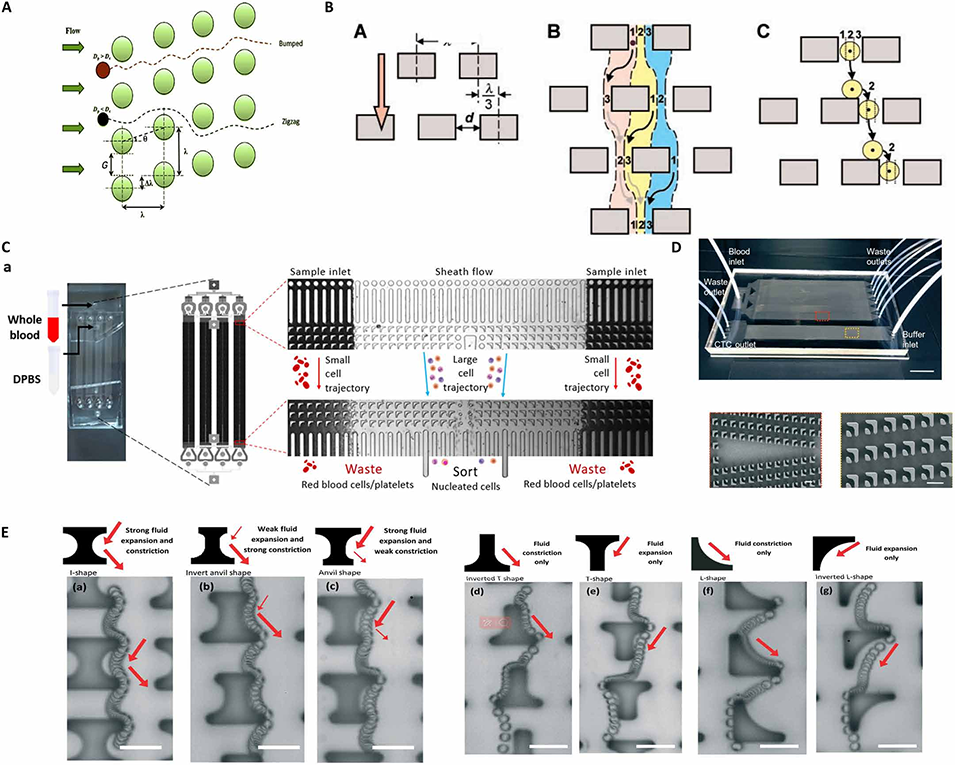
图3. 确定性横向位移(DLD)技术。(A)DLD 器件中微柱结构的多种配置形式。(B)DLD 技术原理示意图,展示微米级周期性微柱阵列。(C)用于全血中有核细胞分选的平行倒 L 形 DLD 芯片结构及性能表征:有核细胞收集于 “分选” 流道,废液流道包含红细胞和血小板。(D)基于过滤器的高集成级联芯片(CFD-Chip),用于提升分离效率。(E)相同微球在不同微柱几何结构中的序列位置和流体流动变化:(a)I 形、(b)砧形、(c)倒砧形、(d)倒 T 形、(e)双倒 T 形、(f)L 形、(g)倒 L 形。
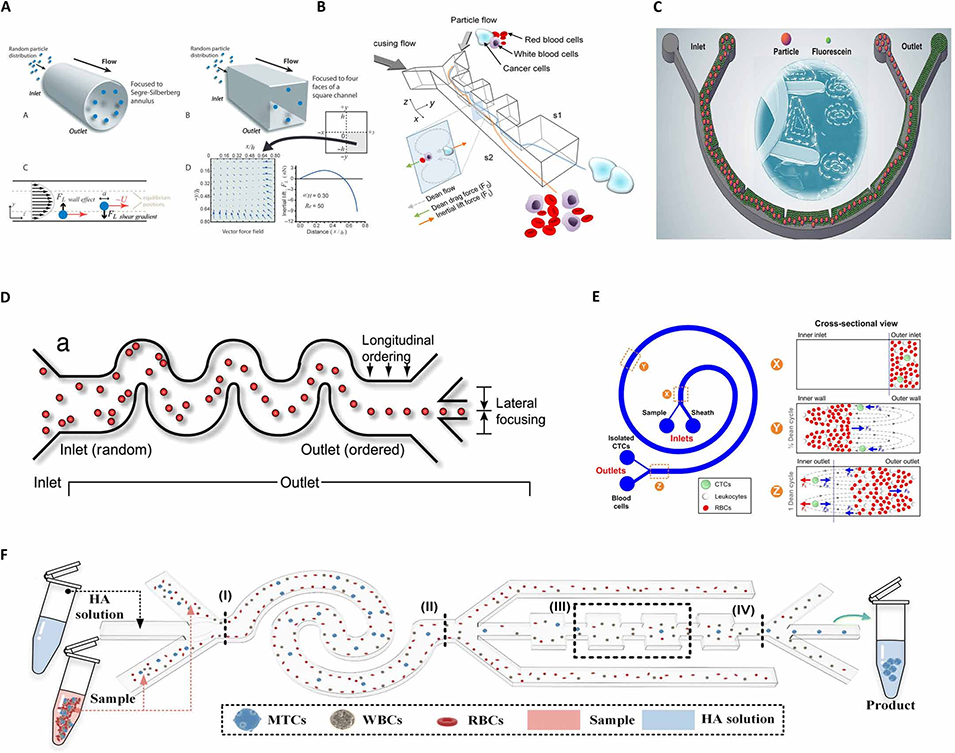
图4. 惯性微流控技术。(A)惯性微流控基本原理,突出颗粒聚焦和尺寸依赖性迁移特性。(B)低剪切应力下基于惯性微流控的血液中癌细胞分离。(C)基于带有序列微障碍物的半圆形微通道的高通量缓冲液交换系统。(D)用于提升颗粒聚焦和分离效率的蛇形惯性微流控通道。(E)用于高通量循环肿瘤细胞(CTCs)分离的迪安流分馏(DFF)技术示意图。(F)用于生物颗粒尺寸选择性分选的级联弹性-惯性细胞分离器件。
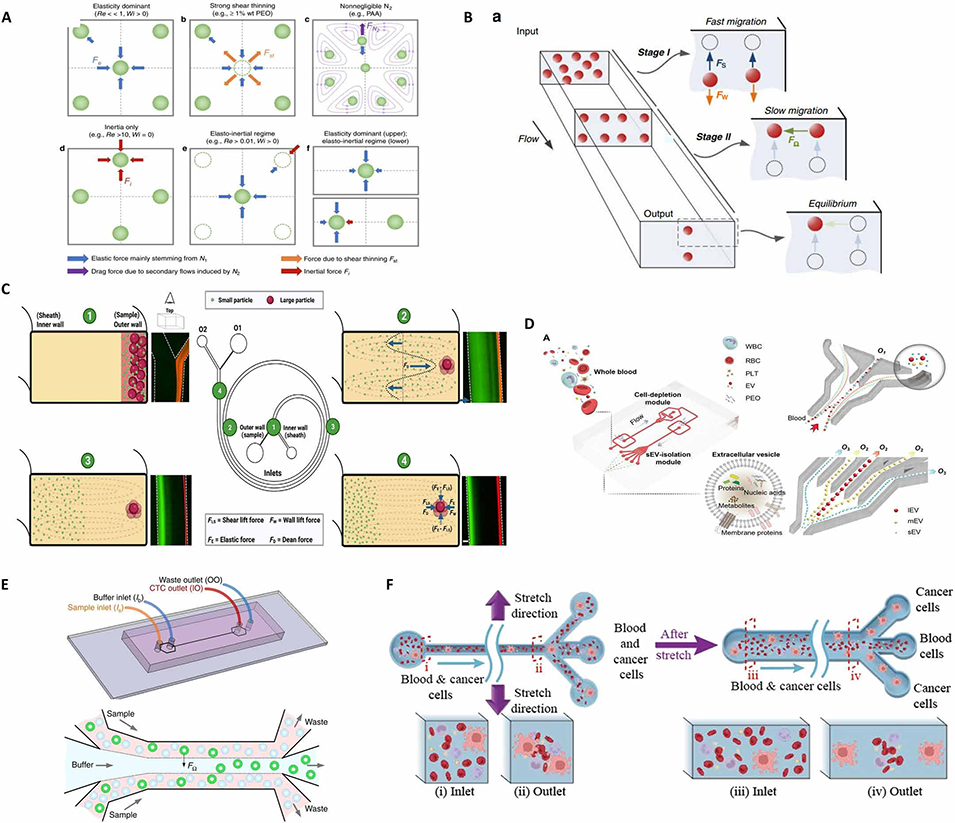
图5. 粘弹性微流控技术。(A)惯性微流控中微球的雷诺数依赖性聚焦行为。(B)粘弹性微流控流动中微球受到的流体动力学力。(C)用于从全血中直接分选细菌的螺旋惯性-粘弹性微流控技术。(D)基于粘弹性的微流控芯片实现小细胞外囊泡(sEVs)的无标记分离策略,无需生物标志物或外部场辅助。(E)通过粘弹性聚焦从血液中富集循环肿瘤细胞(CTCs)的示意图,其中 CTCs 被选择性对齐并与造血细胞分离。(F)超拉伸粘弹性微流控器件基于变形性实现肿瘤细胞分选,扩展了极端流动条件下稀有细胞分离的适用性。
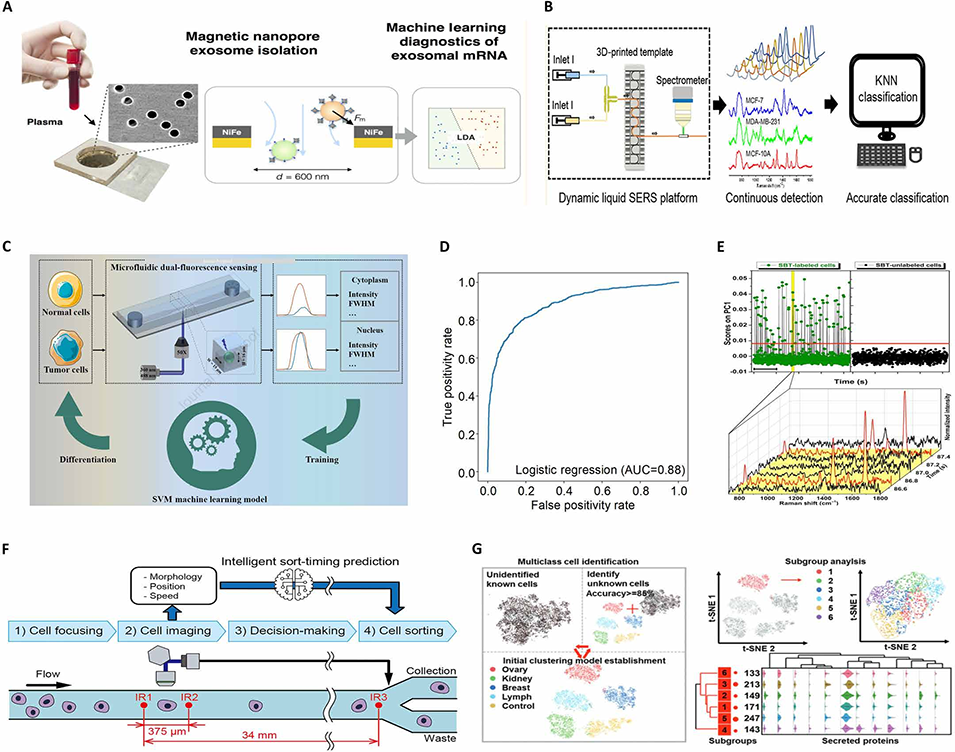
图6. 传统机器学习算法已广泛与微流控系统集成,以提升诊断和分析能力。(A)线性判别分析(LDA)结合微流控技术实现胰腺癌诊断的高特异性外泌体分析。(B)K 近邻(KNN)算法用于微流控成像数据的实时模式识别,优化细胞分选准确率。(C)支持向量机(SVM)辅助双荧光流式细胞术(FCM),基于微流控平台中的形态学特征实现膀胱肿瘤细胞检测。(D)受试者工作特征(ROC)曲线和曲线下面积(AUC)指标验证了逻辑回归(LR)模型在动态流动条件下细胞表型分类的性能。(E)通过广义主成分分析(PCA)得到的 PC1 分数,区分带有表面增强拉曼散射(SERS)标记的细胞信号与背景噪声信号。(F)集成学习框架(包括极限梯度提升树 XGBoost 模型)利用纳米流控分离系统的外泌体衍生数据,实现胰腺癌细胞标志物的智能分类和时间分辨预测。(G)通过机器学习驱动的图像处理自动化肿瘤细胞聚类和亚群分析,为癌症群体的表型异质性研究提供支持。
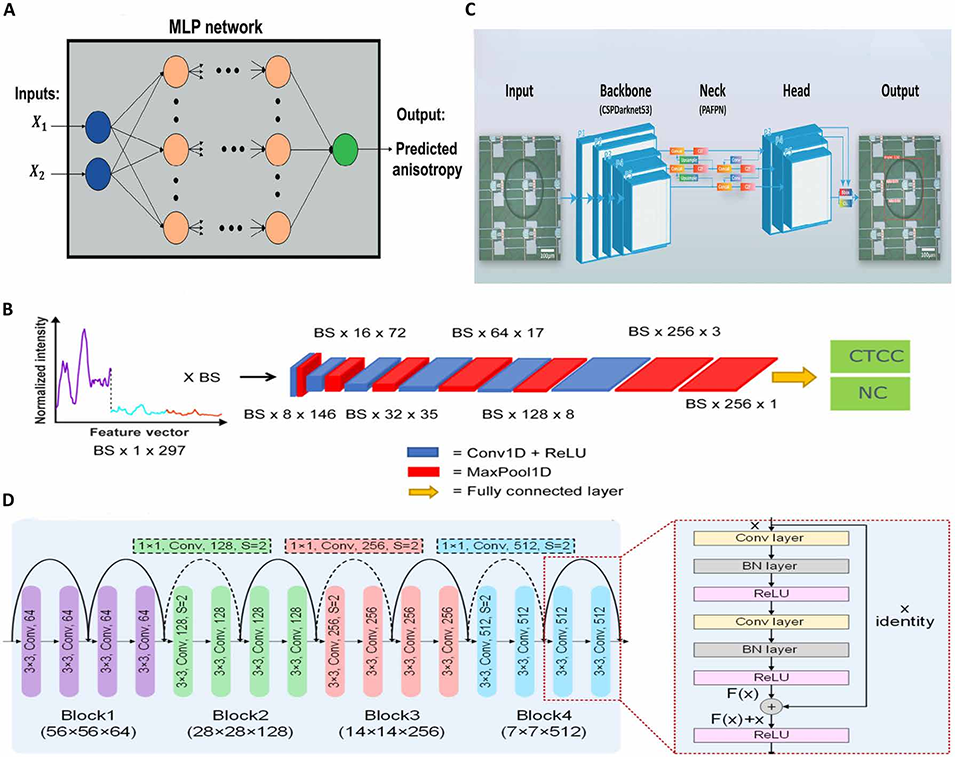
图7. 深度学习(DL)架构。(A)多层感知器(MLP)。(B)利用三种不同波长的归一化散射强度的一维特征向量,结合卷积神经网络(CNN),实现循环肿瘤细胞集群(CTCC)峰与非 CTCC 峰的区分。(C)YOLOv8 用于从红细胞中分选 HeLa 细胞、从白细胞(WBCs)中分离癌细胞,以及区分白细胞亚型。(D)残差块设计旨在促进复杂特征学习,并缓解深度网络中的梯度衰减问题。
论文链接:https://www.science.org/doi/10.1126/sciadv.aea6007
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














