糖尿病与代谢功能障碍相关脂肪性肝炎(MASH)同属代谢综合征,MASH患者患2型糖尿病的风险是常人的2倍。加之,胰腺与肝脏在解剖结构上相互关联,但现有体外培养系统难以模拟二者的交叉对话,且传统微流控微生理系统较为复杂、实验通量低。

近期,有研究人员开发了一种基于同轴流动聚焦微流控技术的多室水凝胶微胶囊系统,成功实现了胰腺β细胞与肝细胞在空间隔离条件下的三维共培养。该系统不仅能维持细胞高活力与球体形成,还观察到共培养后两类细胞功能显著增强,为器官间相互作用研究提供了高通量、可规模化的新型平台。相关研究以“Multicompartment hydrogel microcapsules for creating spatially patterned cell co-cultures”为题目,发表于期刊《Microsystems & Nanoengineering》。
本文要点:
1、该研究聚焦于糖尿病中胰腺与肝脏的相互作用,旨在开发适用于多器官串扰相关机制研究和治疗测试的胰腺-肝脏共培养系统。
2、研究团队利用同轴流聚焦微流控装置,成功制备出多室水凝胶微胶囊,其包含两个水相隔室,分别装载胰腺β细胞和肝细胞,且细胞会逐渐聚集形成对应的细胞球体。
3、通过对微流控装置的流动参数,如核心、外壳、屏蔽油相的流速等进行优化,实现了对微胶囊几何结构的精确调控,确保了隔室的稳定性和独立性。
4、实验结果表明,与单种细胞培养的微胶囊相比,胰腺-肝脏共培养的微胶囊中,肝细胞的白蛋白分泌量显著增加,胰腺β细胞的葡萄糖刺激胰岛素分泌功能更优,展现出明显的功能协同效应。
5、该多室微胶囊作为一种新型微生理系统,克服了传统微流控系统复杂、测试通量低的缺陷,在疾病建模、发育生物学研究和药物研发等领域具有广阔应用前景,未来还可进一步增加隔室数量以实现三种及以上细胞的共培养。
该多室水凝胶微胶囊的制备主要基于同轴流动聚焦微流控技术,其核心过程可分为以下关键步骤:
1、微流控芯片设计与制备
使用 AutoCAD 设计具有多层通道结构的微流控芯片。
通过软光刻技术,以 SU 8 光刻胶在硅片上制作具有不同高度(60 μm、100 μm、150 μm)的母模。
浇注聚二甲基硅氧烷(PDMS)于母模上,固化后经氧等离子体处理完成芯片键合。
2、四相流体系统配置
芯片中共有四个独立的流体通道,分别输送以下成分:
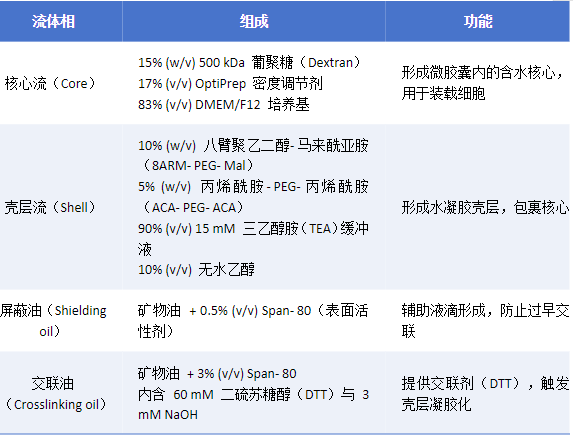
3、微胶囊形成与交联过程
液滴生成:核心流与壳层流在“屏蔽油”交汇处被剪切形成液滴。两个独立的核心流(可分别装载不同细胞或标记物)并排流入,形成双核心结构。核心流中的葡聚糖与壳层流中的聚乙二醇(PEG)因双水相系统(ATPS)互不相溶,从而自然分离,避免交叉污染。
壳层交联:液滴向下流动至“交联油”通道,DTT 扩散进入壳层,通过硫醇 迈克尔加成反应 使 PEG Mal 与 ACA PEG ACA 交联,形成稳定的水凝胶壳层。
几何控制:通过调节各相流速,可控制胶囊直径(约 280–434 μm)和核心大小(约 87–132 μm)。
4、细胞封装与收集
细胞(如 HepG2 肝细胞、MIN6 胰腺β细胞)分别悬浮于核心流溶液中。
生成的微胶囊收集于含培养基的离心管中,经 100 μm 滤网清洗去除油相,转移至培养板中继续培养。
封装后,核心内的高分子葡聚糖在 6–24 小时内逐渐扩散出来,最终形成纯水核心,细胞在其中自由聚集为球体。
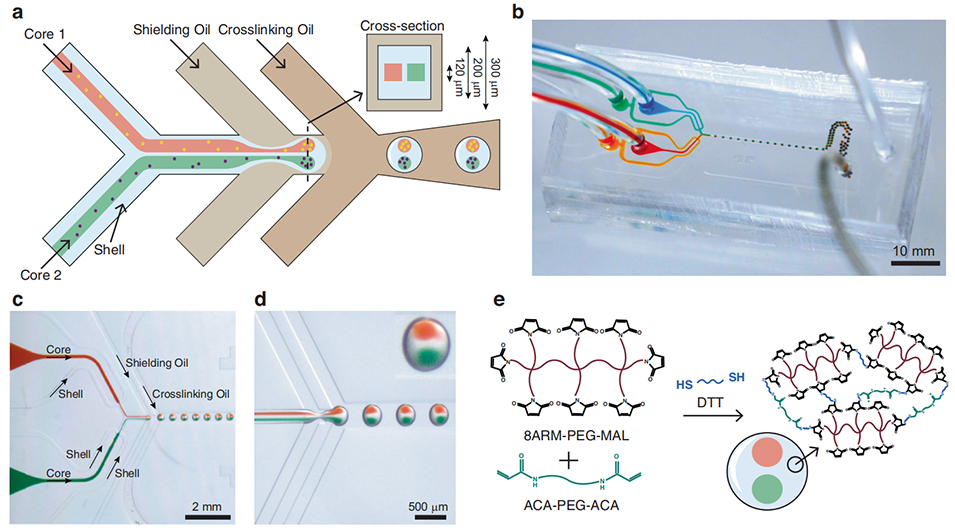
图1 多室水凝胶微胶囊的制备流程
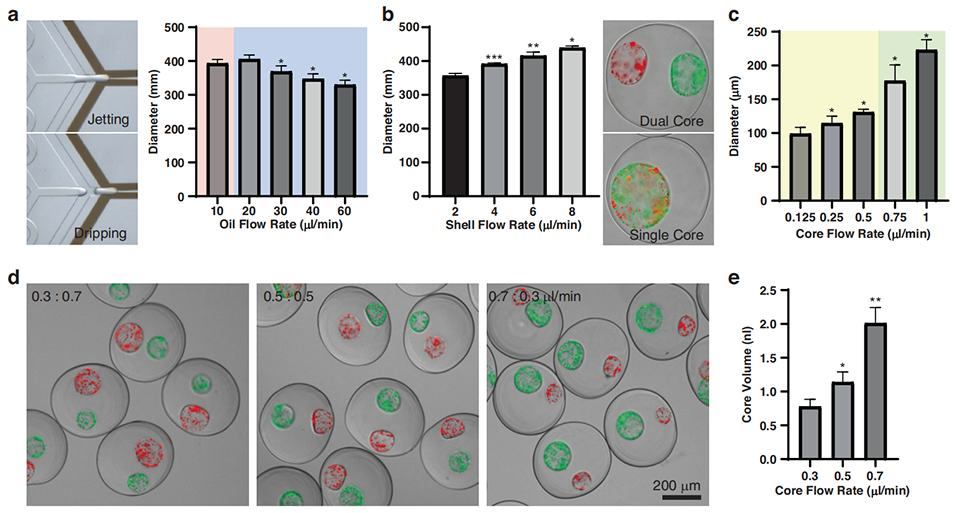
图2 优化流动参数以实现多室微胶囊的可重复、可调控制备
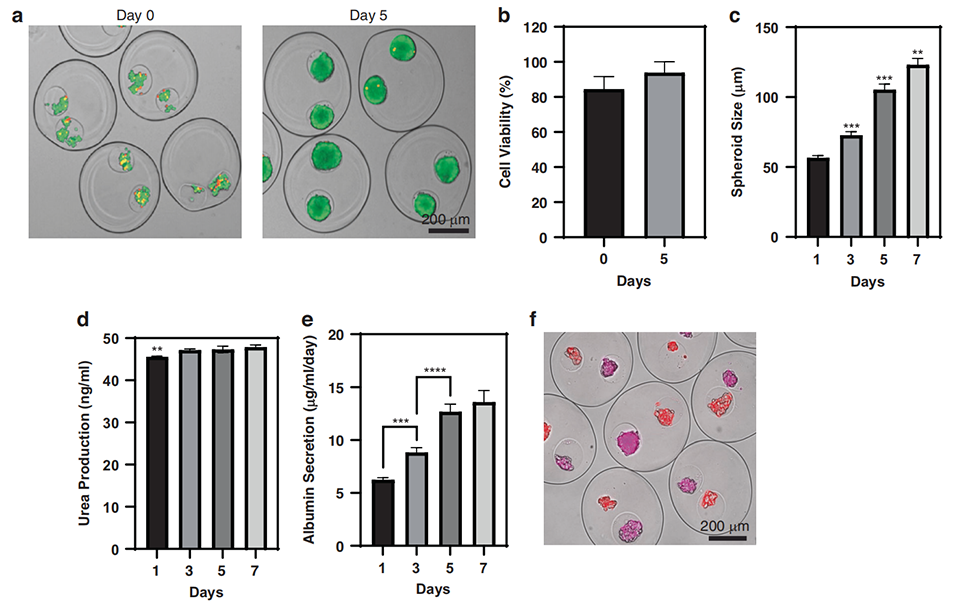
图3 多室微胶囊中细胞的装载、活性及功能评估
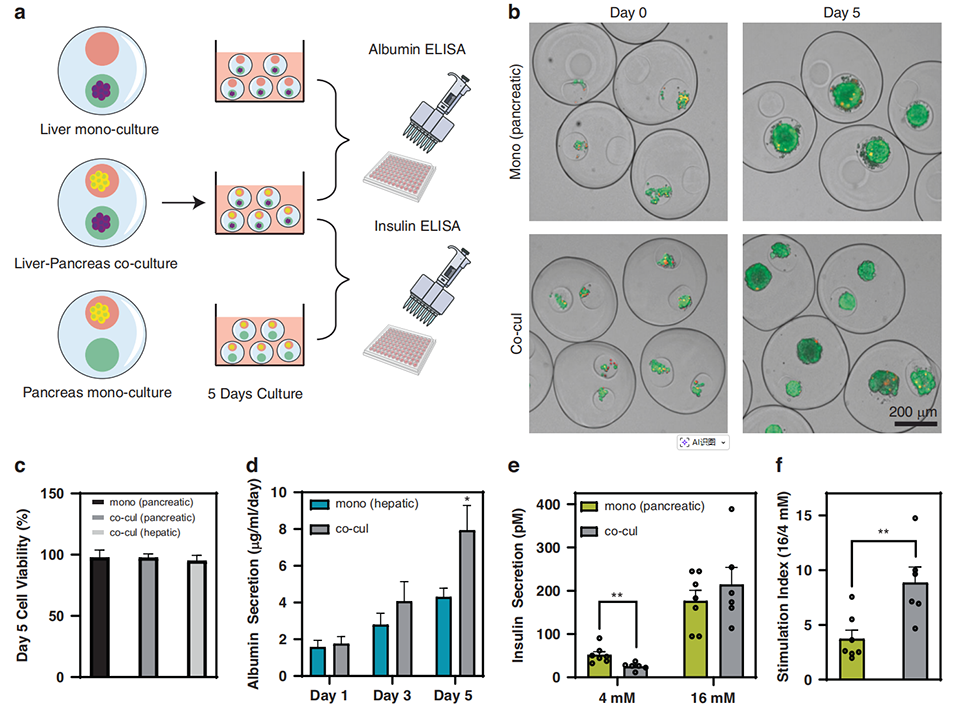
图4 构建肝-胰共培养体系并评估微胶囊内细胞的功能协同作用
论文链接:https://doi.org/10.1038/s41378-025-01140-w
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














