水凝胶支架在组织工程和再生医学中应用广泛,但传统本体水凝胶受限于纳米级分子交联网络,会阻碍营养扩散与细胞迁移,降低再生效率。3D 生物打印技术虽能精准调控水凝胶结构以提升细胞浸润效果,却存在挤出式打印的机械剪切力损伤细胞活性的问题。
微凝胶凭借微尺度尺寸和高比表面积成为极具潜力的生物材料,其负载细胞作为生物墨水可减轻打印过程中的剪切损伤,但传统微凝胶(如海藻酸盐体系)的高交联网络会限制细胞迁移和细胞外基质重塑。现有多孔微凝胶制备方法(如冷冻干燥、化学合成)多依赖油相,存在细胞毒性风险,且面临亲水性物质包封难、多孔结构不稳定等问题。双水相系统(ATPS)虽能温和构建多孔结构,但传统微流控制备仍需引入有机相,影响生物相容性,且纯微凝胶的打印精度受颗粒特性限制,易导致层间结合强度不足。

与此同时,缺血性心脏病是全球主要死因,急性心肌梗死(MI)作为其严重表现,会引发心肌细胞不可逆丢失、纤维化瘢痕形成和血管生成不足等问题。传统药物和介入疗法无法逆转心室重构,干细胞疗法则受限于细胞滞留率低、植入效率差等瓶颈。生物材料虽能提供结构支持,但现有体系难以同时满足孔隙结构调控、血管生成微环境构建、机械性能匹配及心脏组织动态适应性等多重需求,因此亟需开发兼具细胞迁移促进、血管生成诱导和动态组织重塑支持功能的多功能生物修复支架。
鉴于此,广州医科大学唐国胜教授、余细勇教授联合杭州电子科技大学徐铭恩教授等人,提出了一种基于微凝胶的模块化制造策略,通过气剪微流控与双水相系统结合制备多孔微凝胶,并经3D生物打印构建兼具粘附性与弹性的层级多孔水凝胶贴片(HPMP)。该贴片负载的诱导多能干细胞(iPSCs)可在其层级多孔微环境中定向分化为功能成熟的心肌细胞,在心肌梗死修复中实现抗粘连、促血管生成与心功能改善的协同效果。相关研究以“Microgel‐Based Hierarchical Porous Hydrogel Patch with Adhesion and Resilience for Myocardial Infarction”为题目,发表于期刊《Advanced Science》。
本文要点:
1、该研究提出一种基于微凝胶的模块化制造策略,用于构建具有粘附性和弹性的分层多孔水凝胶贴片(HPMP),并重点验证其在心肌梗死治疗中的应用价值。
2、结合气剪微流控技术与双水相系统(ATPS),制备出孔隙率可调、生物相容性良好的多孔微凝胶;以甲基丙烯酰化明胶(GelMA)为连续相、聚环氧乙烷(PEO)为牺牲相,混合海藻酸盐(Alg)多孔微凝胶作为生物墨水,通过3D生物打印(挤出式/DLP打印)构建HPMP,其分层多孔结构可促进营养扩散和细胞迁移。
3、HPMP具备优异的机械弹性(100次压缩循环后应力保留率达94.6%)、组织粘附性(可稳定粘附于心脏及多种器官表面),且生物相容性良好,能支持多种细胞(如HUVEC、心肌细胞、诱导多能干细胞iPSC)的增殖、迁移及功能表达。
4、在心肌梗死治疗中,负载iPSC的多孔微凝胶可定向分化为心肌细胞,为心肌修复提供功能细胞来源。同时,设计了Janus结构的抗粘连HPMP(JHPMP),单侧粘附心肌组织、另一侧(甲基丙烯酸酯化透明质酸HAMA层)防止胸腔粘连。
5、大鼠心梗模型验证显示,JHPMP可显著改善心脏功能(提高射血分数、缓解心室扩张),减少梗死面积和纤维化,促进血管新生及心肌细胞间缝隙连接形成,且无明显全身毒性。
6、该微凝胶模块化制造策略整合了细胞分化、机械支撑和组织修复功能,为心肌梗死等组织损伤的再生治疗提供了新型平台,有望进一步推动组织工程和再生医学的发展。
该研究制备的多孔微凝胶,其孔隙率可通过哪些参数调控?
1、葡聚糖(Dex)浓度(连续相)
Dex作为连续相核心组分,其浓度变化会影响双水相系统(ATPS)的相分离程度与均匀性。Dex浓度升高会增强连续相的黏度和分子排斥力,促使牺牲相(PEO)形成更密集、分布更均匀的液滴。
2、PEO浓度(牺牲相)
PEO是多孔微凝胶孔隙的“模板”,其浓度直接决定ATPS中分散相液滴的数量与体积分布。更高浓度的PEO会在连续相中形成更多离散液滴,这些液滴被连续相包裹,为后续孔隙形成提供基础。
3、连续相与牺牲相的体积比
两相体积比决定牺牲相液滴在连续相中的分布密度和填充效率。比例失衡会导致液滴融合、分布不均或数量不足,进而影响孔隙形成的完整性。
4、ATPS静置时间
ATPS混合后需经历自发相分离过程,静置时间不足会导致相分离不完全,牺牲相液滴形态不稳定、分布不均,影响孔隙模板的完整性。
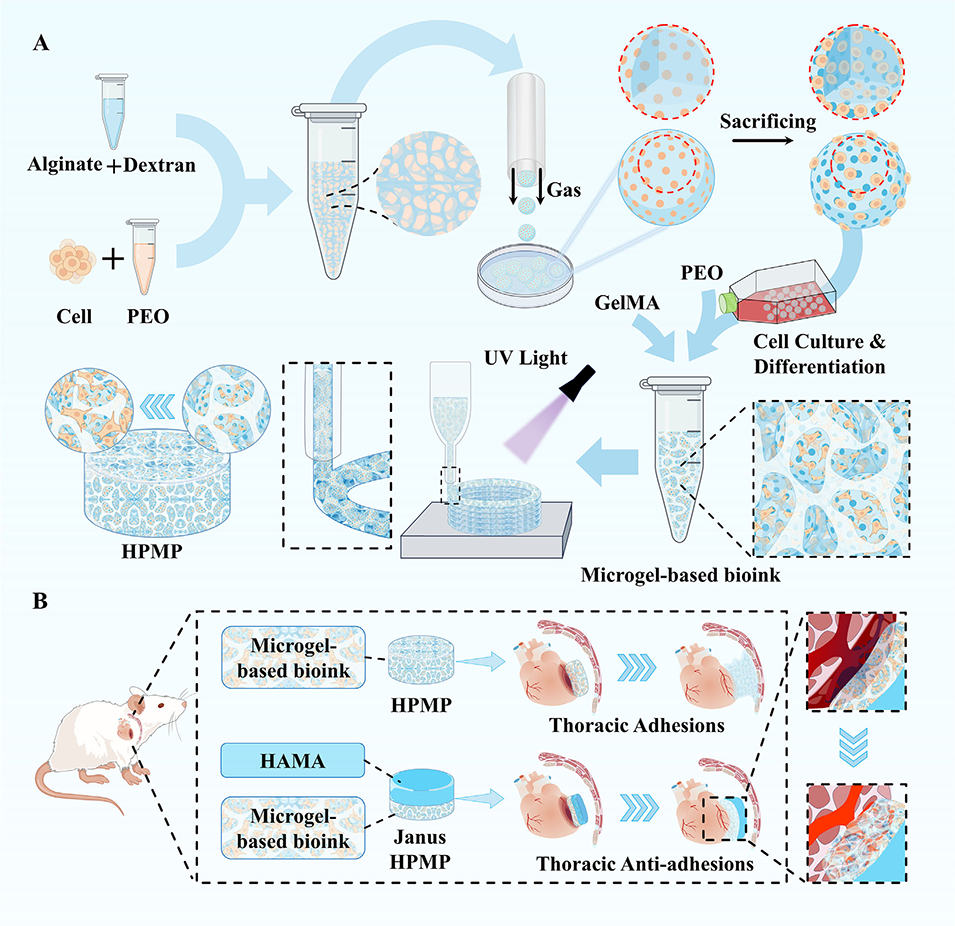
图1. 模块化制备策略用于组织再生的示意图
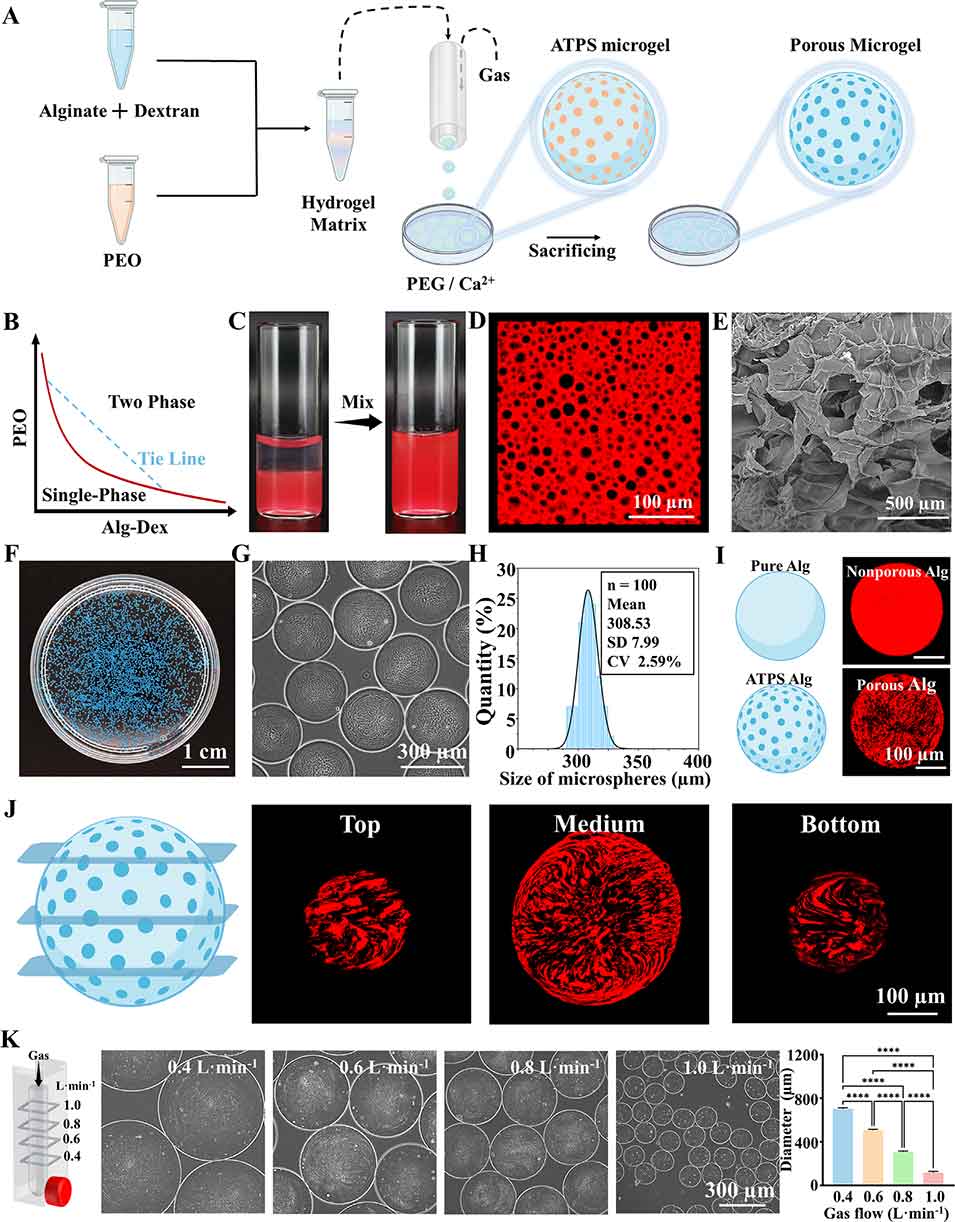
图2. 气体剪切微流控结合双水相系统制备微孔微凝胶流程图
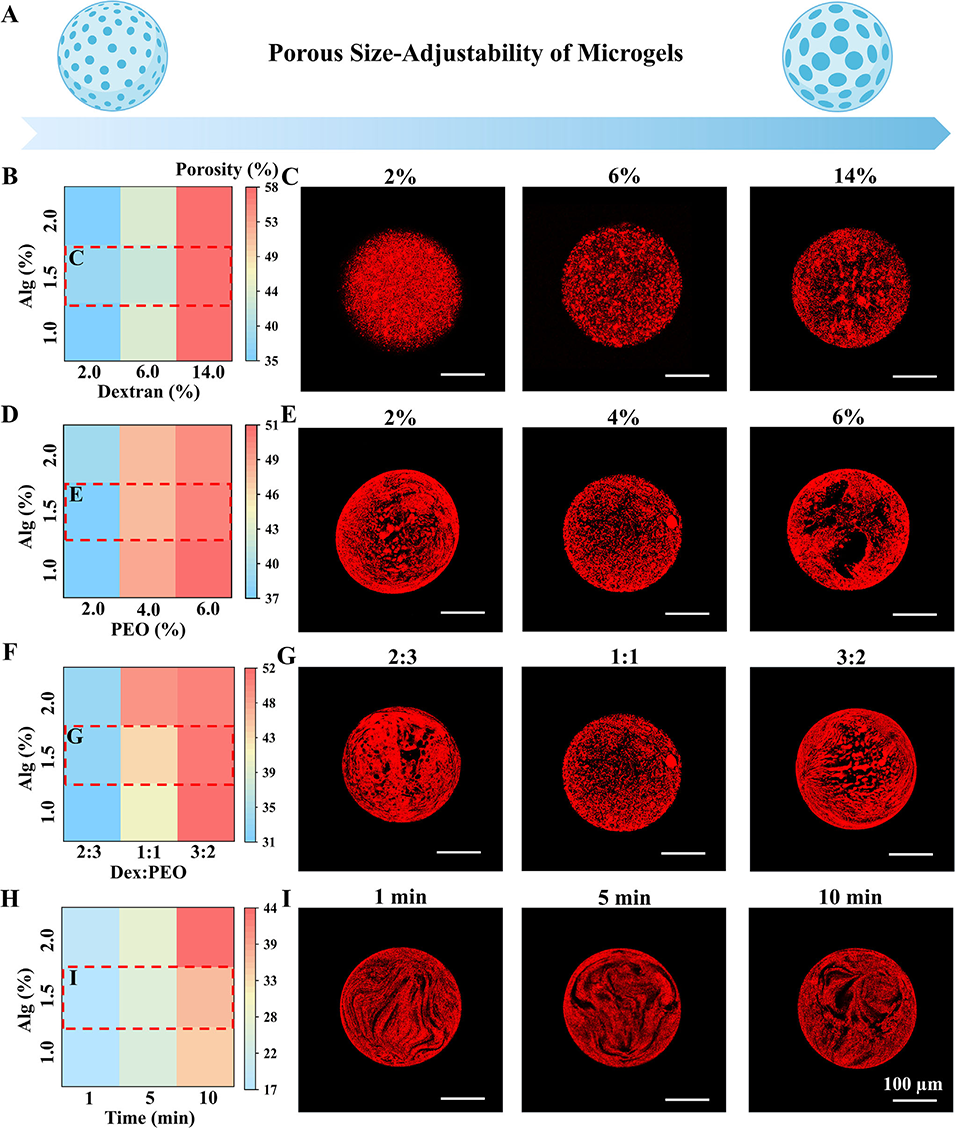
图3. 双水相系统调控微孔微凝胶的孔径与孔隙率
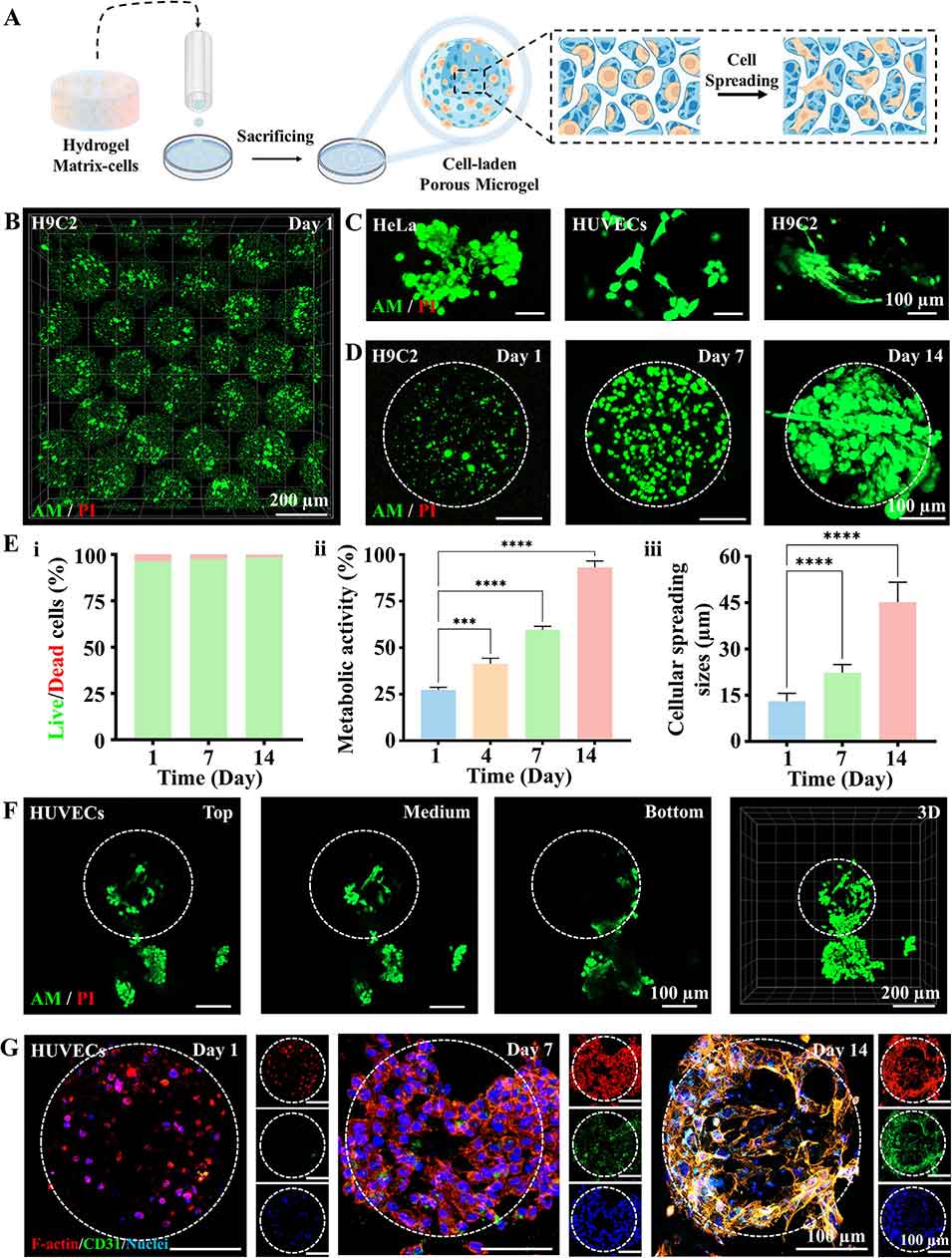
图4. 双水相体系微孔微凝胶的细胞行为表征
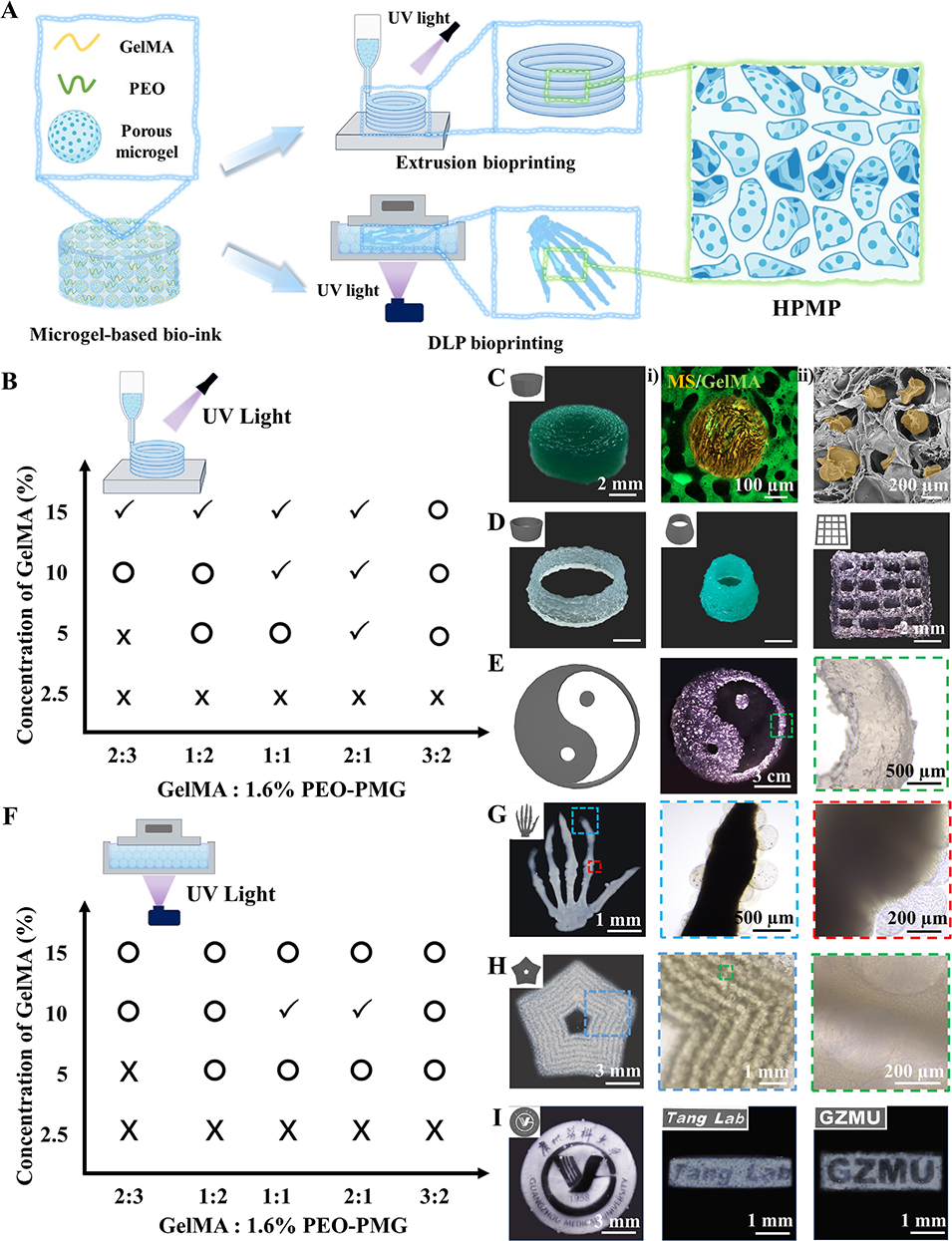
图5. 基于微凝胶的3D生物打印制备层级多孔水凝胶流程图
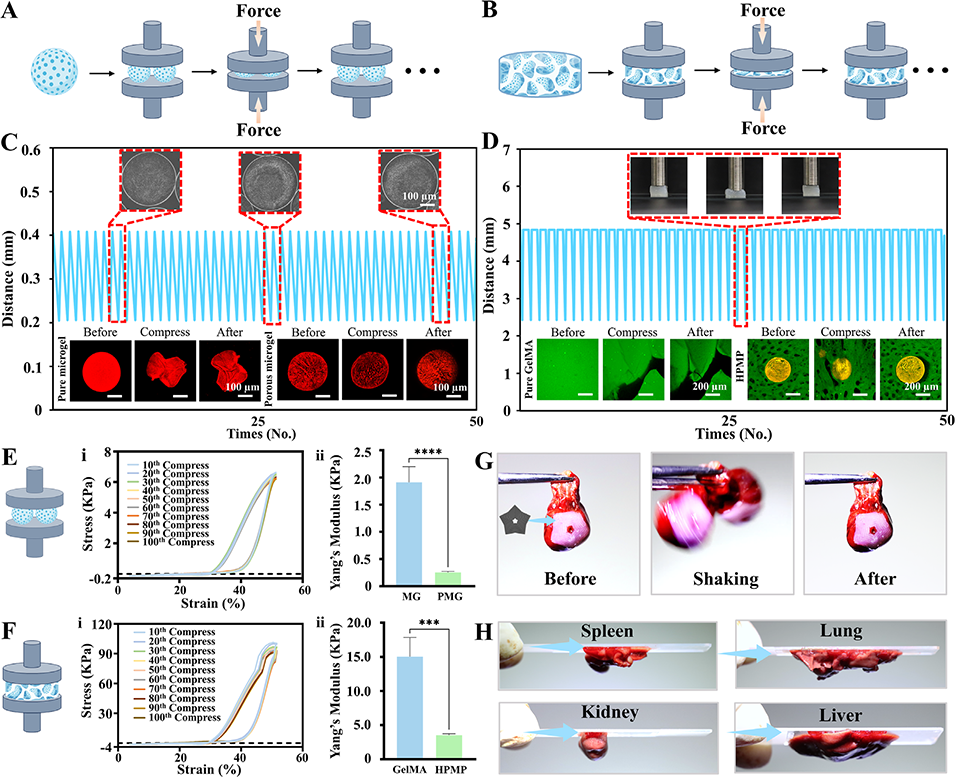
图6. 多孔微凝胶及层级多孔水凝胶结构的力学性能表征
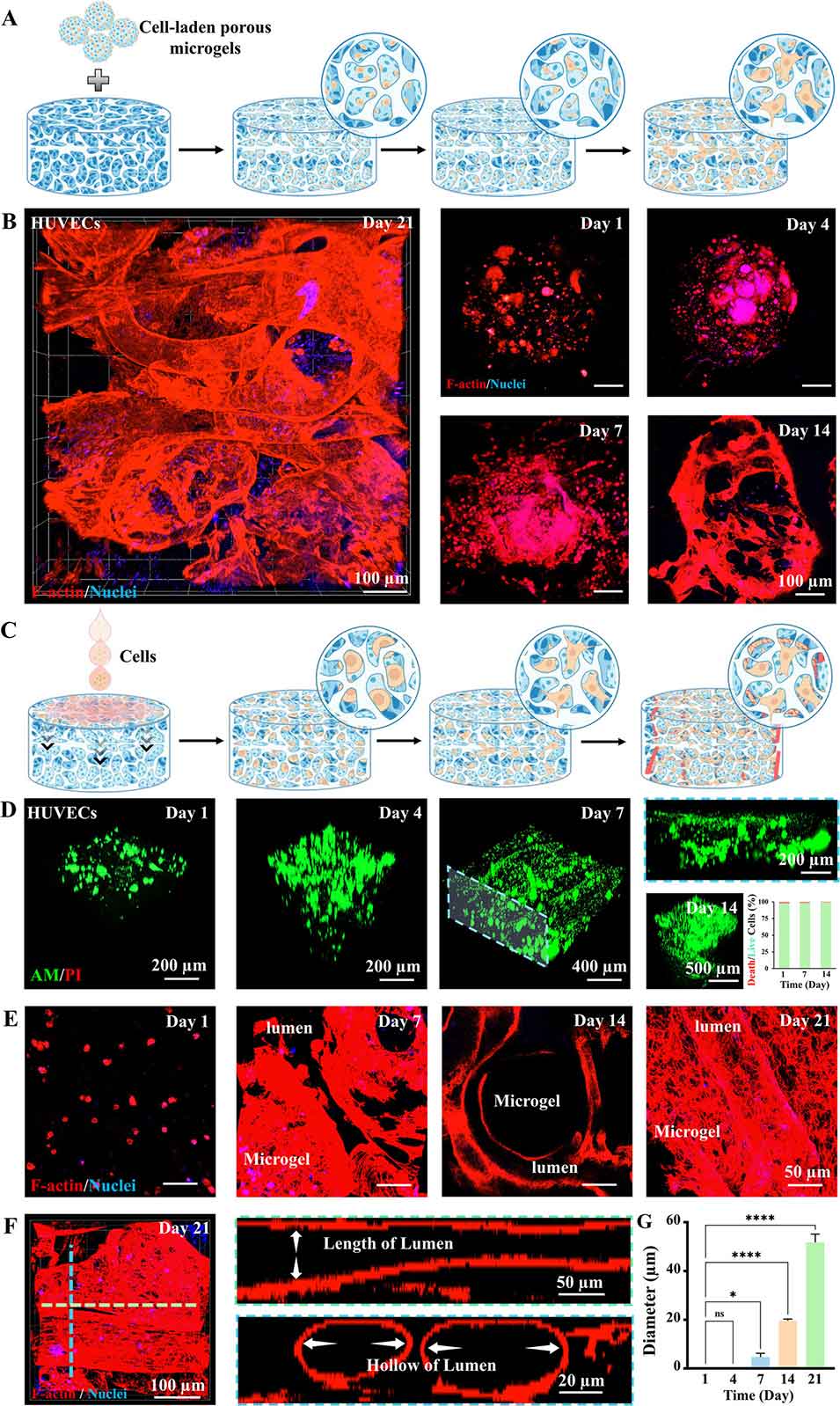
图7. 层级多孔水凝胶中的细胞行为及血管化
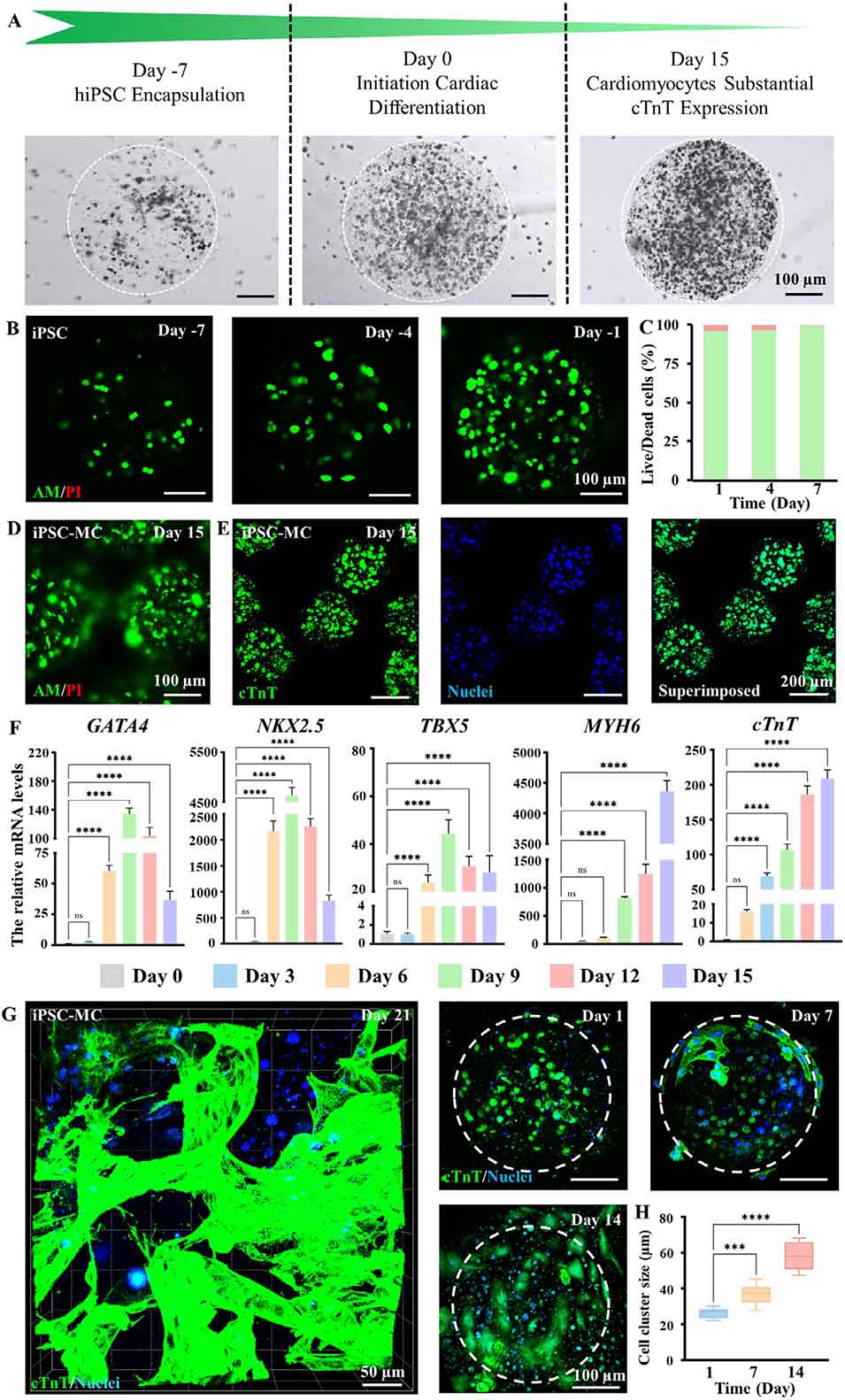
图8. 负载诱导多能干细胞(iPSC)的多孔微凝胶的细胞行为及分化特性
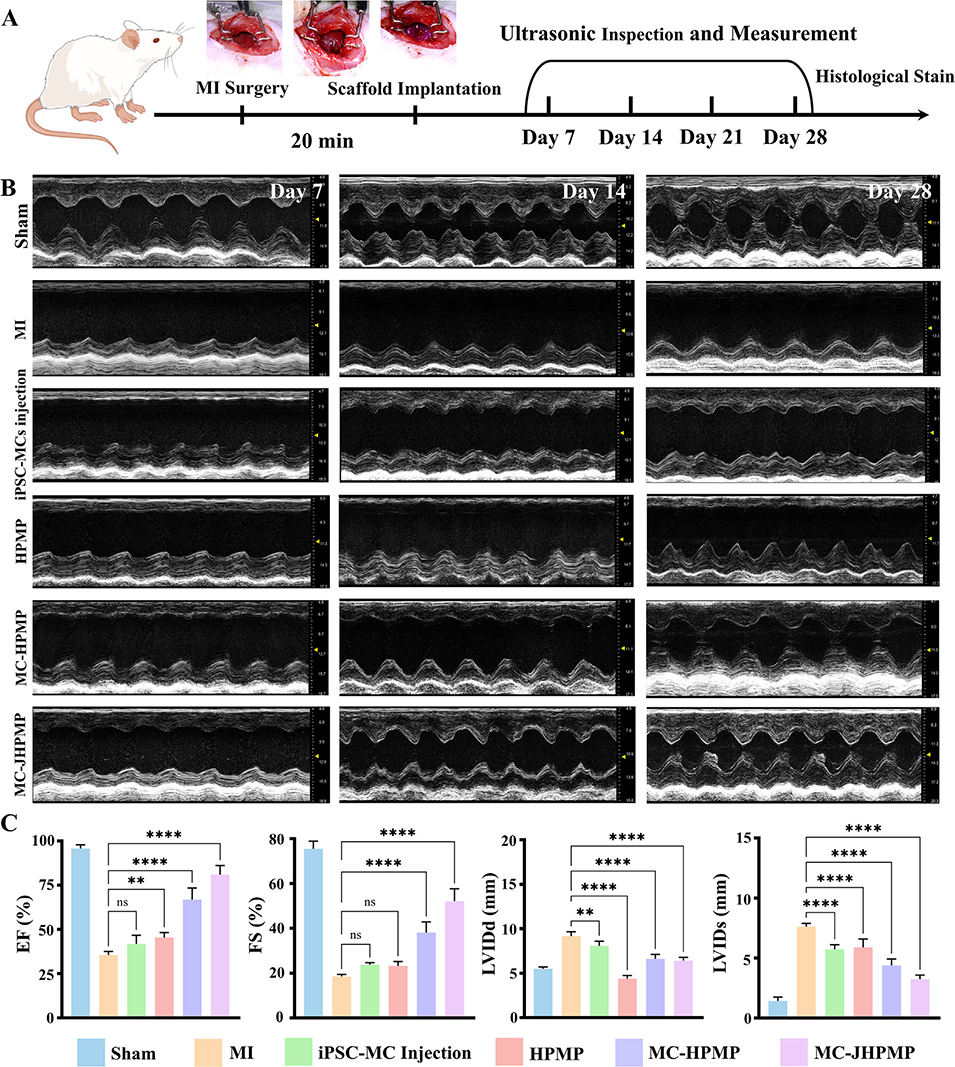
图9. 负载iPSC来源心肌细胞(iPSC-MCs)的层级多孔水凝胶对心肌梗死大鼠心功能的影响
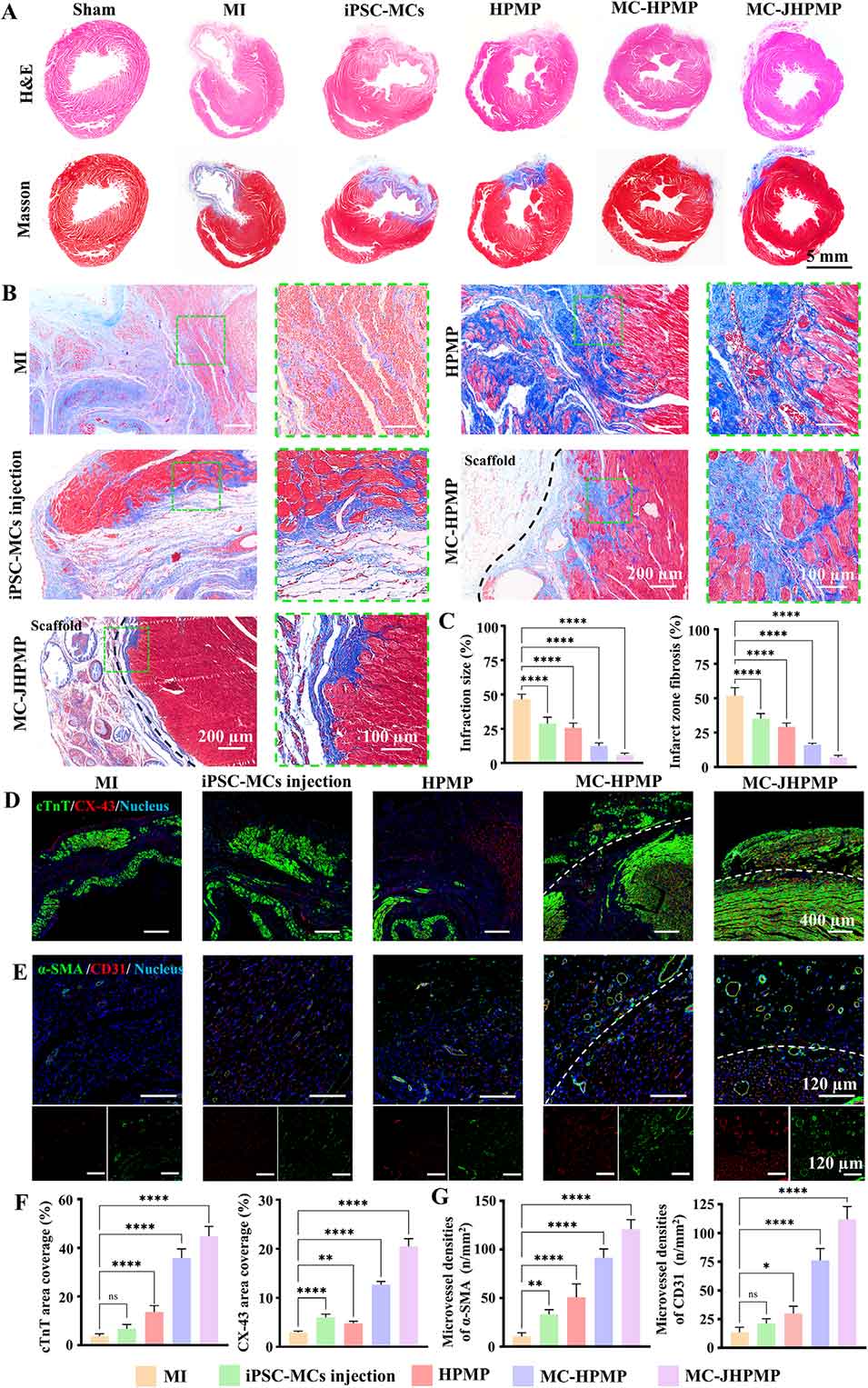
图10. 心肌梗死大鼠术后4周再生修复及血管生成的组织化学评估
论文链接:https://doi.org/10.1002/advs.202518646
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














