研究背景
1、类器官研究意义:类器官是生物医学创新的前沿工具,能精准模拟人体组织功能,为疾病机制研究和药物研发提供重要模型。
2、传统培养的核心痛点:
基质问题:Matrigel等基质温度敏感、液滴稳定性差;合成水凝胶(如GelMA)难以支持类器官生长。
操作局限:手动脱油导致细胞损失、油残留,且液滴中细胞分布不均。
异质性高:生长因子/氧气梯度导致类器官尺寸、形态差异大,CV值达50%。

导读
近日,罗氏制药研究和早期开发中心团队研发出一种集成微流控平台,可实现水凝胶微球的高通量生成并均匀封装原代成人肠道干细胞,有效解决了传统类器官培养中可重复性和可扩展性不足的难题。该平台通过优化细胞分布系统、水凝胶配方及自动化脱油模块,成功培养出健康和肿瘤来源的肠道类器官,且类器官在尺寸、细胞组成上均一性更高,为药物筛选、疾病建模及个性化医疗提供了标准化解决方案。相关研究以“Integrated Microfluidic Platform for High‐Throughput Generation of Intestinal Organoids in Hydrogel Droplets”为题目,发表在期刊《Advanced Science》上。
本文要点
1、该研究推出了一种集成微流控平台,旨在解决类器官研究中可重复性与可扩展性不足的问题,实现肠道类器官的高通量、标准化生成。
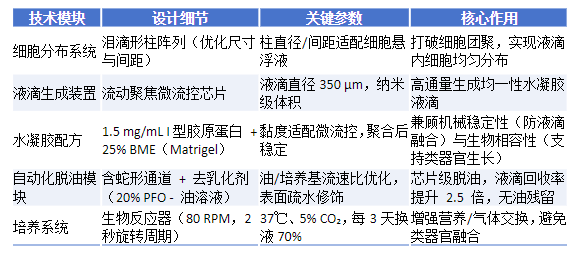
2、平台核心设计包括:一是采用泪珠状柱阵列的细胞分布系统,破解细胞团聚难题,确保水凝胶微球内细胞均匀分布;二是优化水凝胶成分,将1.5mg/mL I型胶原蛋白与25%(v/v)基底膜基质(BME)混合,在保障类器官生长的同时,提升微球稳定性,便于后续操作;三是集成微流控脱油模块,通过破乳剂与特定通道设计,实现油相到水相的高效转换,减少手动操作导致的细胞损失与污染。
3、实验验证显示,该平台生成的健康肠道类器官在尺寸、形态及细胞分化上均具有高均一性,相比传统穹顶培养,其干性标志物与分化标志物表达更均衡,缺氧相关基因表达降低,细胞活力更高;同时,该平台可成功培养患者来源的肿瘤类器官,且肿瘤类器官对SN-38等化疗药物表现出剂量依赖性反应,具备药物筛选潜力。此外,平台可与自动化液体处理工具结合,实现类器官向微孔板的高效转移,进一步适配高通量应用场景。
4、该平台为类器官的规模化生产提供了新方案,在疾病建模、药物研发及个性化医疗等领域具有重要应用前景。
核心技术方案
该集成微流控平台主要通过三方面设计攻克传统类器官培养的异质性问题:
① 细胞分布系统:采用泪滴形柱阵列结构,打破细胞团聚,使液滴内细胞密度CV值从23%降至3%;
② 均一液滴生成:流动聚焦技术精准控制液滴直径(350µm),体积变异系数极低;
③ 优化水凝胶配方:1.5mg/mL I型胶原蛋白 + 25%BME的混合物消除了生长因子/氧气梯度,使类器官尺寸CV值降至20%(传统培养为50%),且单个类器官内同时存在增殖与分化细胞,避免区域功能割裂。
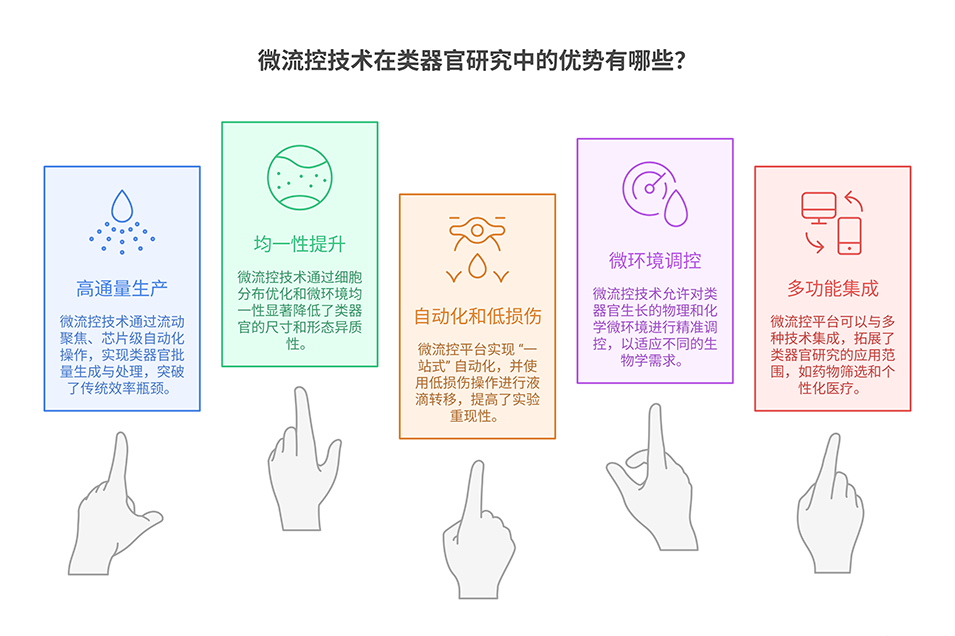
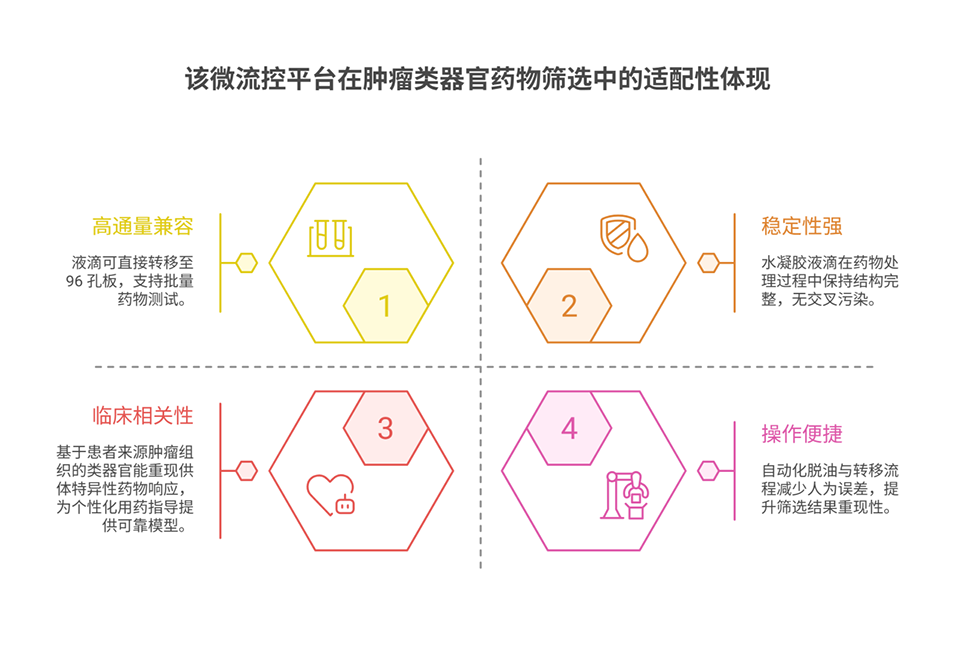
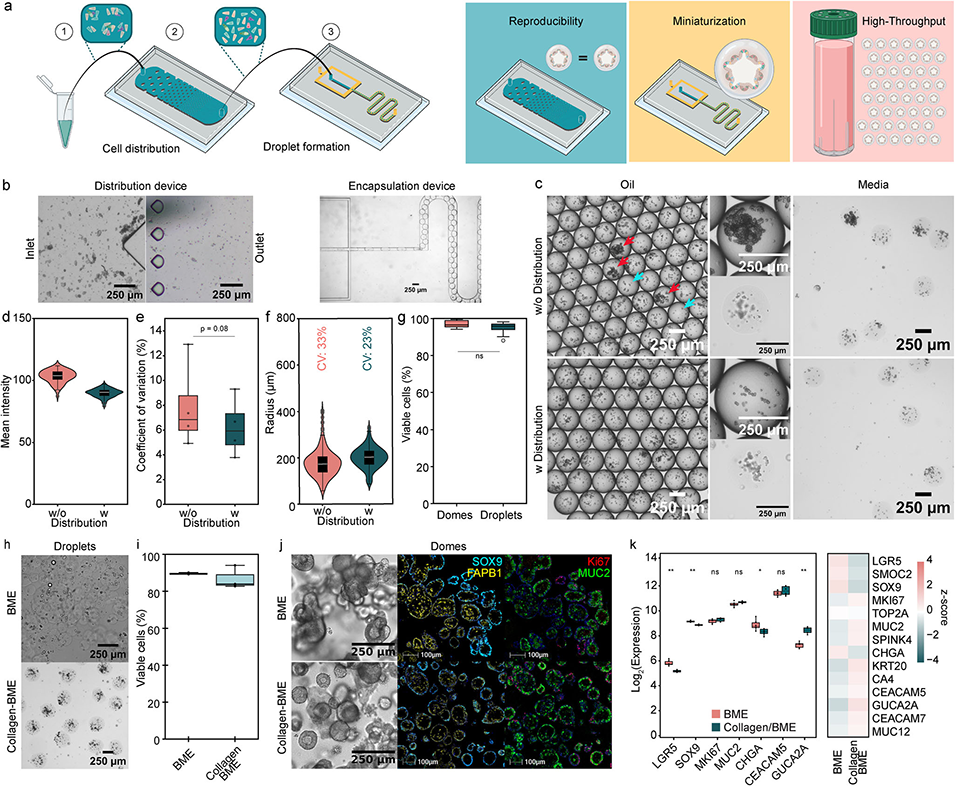
图1. 类器官液滴的生成
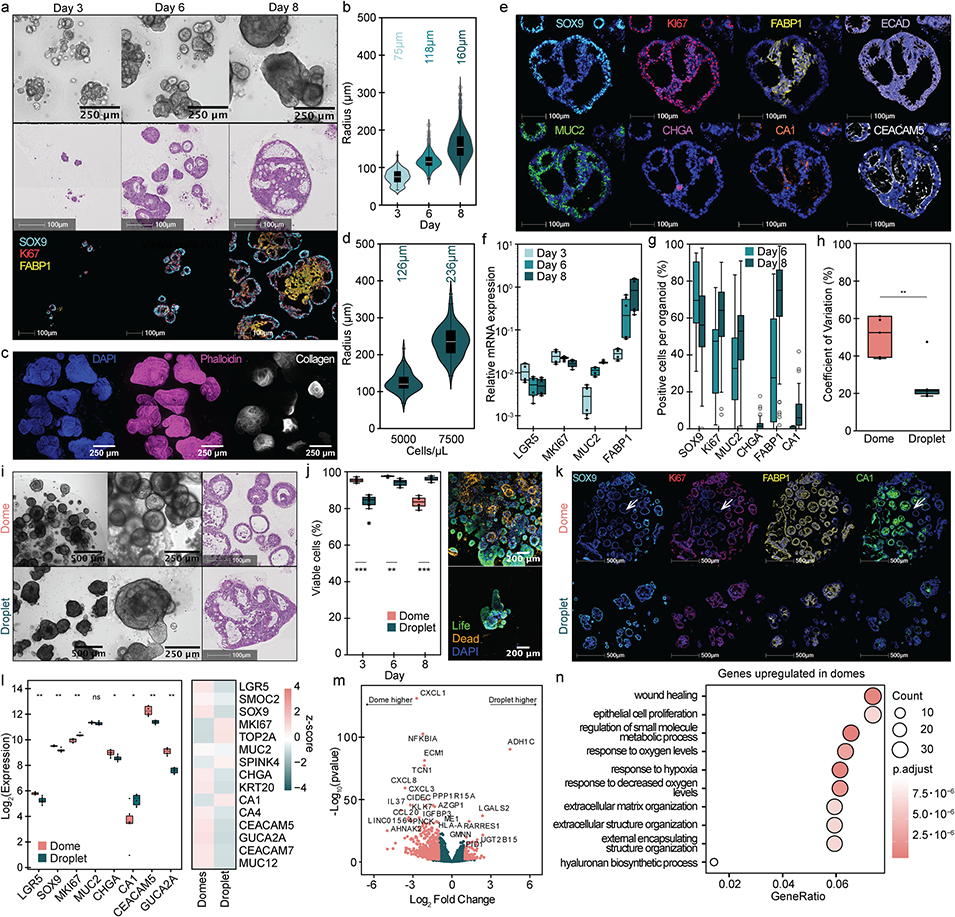
图2. 液滴中结肠类器官的发育及与传统穹顶培养的对比
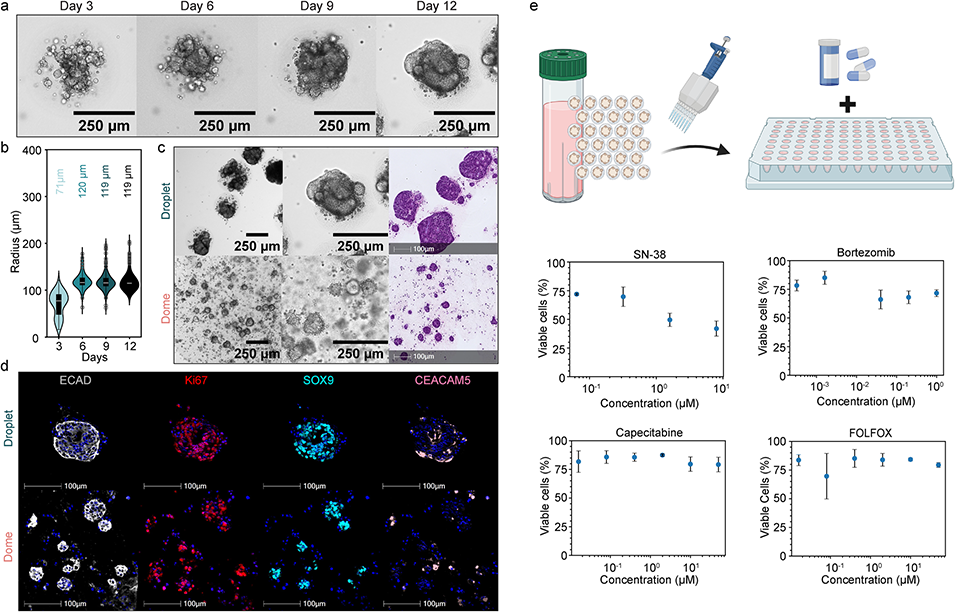
图3. 结肠肿瘤类器官的生长特性与形态特征
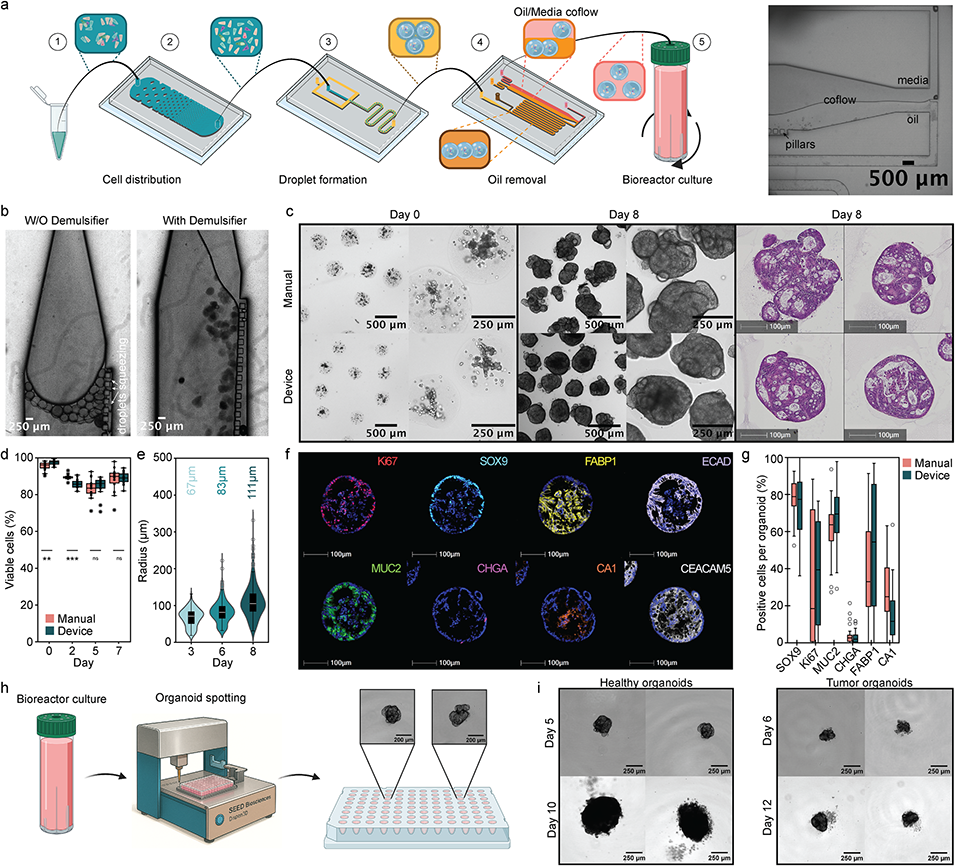
图4. 脱油装置与类器官定量封装技术
论文链接:https://doi.org/10.1002/advs.202516507
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














