间充质干细胞(MSCs)具备自我更新、旁分泌及免疫调节能力,在多种疾病治疗中应用广泛。传统二维单层培养的MSCs(2D-MSCs)易因长期培养出现细胞功能衰退、细胞间通讯受损等问题,而三维培养的MSCs(3D-MSCs)可抑制过度增殖、增强细胞间相互作用,更贴近天然组织特性,在组织再生、伤口愈合等场景中展现出更优治疗效果。即便如此,3D-MSCs的临床应用仍面临现实瓶颈:一方面,其规模化培养过程耗时又费力;另一方面,从供体组织中获取的细胞量往往难以满足治疗需求,即使通过体外扩增补充细胞数量,长期培养仍会导致其多能性丢失,影响治疗效能。因此,亟需开发高效的冷冻保存技术,为3D-MSCs的临床转化提供关键支撑。


近期,昆明理工大学灵长类转化医学研究院司维教授、严亚萍等人开发了一种基于微流控技术的3D-MSCs玻璃化冷冻新方法,通过将人脐带3D-MSCs封装在GelMA水凝胶中制备微球,在降低冷冻保护剂浓度的同时实现96%的高复苏存活率。该方法不仅通过增强线粒体功能和抗氧化能力维持细胞活性,还在小鼠伤口愈合模型中展现出与新鲜3D-MSCs相当的治疗效果,为干细胞疗法的临床转化提供了实用解决方案。相关研究以“Vitrification of 3D-MSCs encapsulated in GelMA hydrogel: Improved cryosurvival, reduced cryoprotectant concentration, and enhanced wound healing”为题目,发表在期刊《International Journal of Biological Macromolecules》上。
本文要点:
1、该研究针对3D培养间充质干细胞(3D-MSCs)缺乏有效冷冻保存技术的问题,开发了一种创新玻璃化冷冻方法。
2、通过微流控技术将人脐带3D-MSCs封装在甲基丙烯酰化明胶(GelMA)水凝胶中,制备成3D-MSCs水凝胶微球(3D-MSCsHM),并优化了冷冻保护剂(CPA)配方。
3、结果显示,该方法仅需30分钟即可完成,使用30%浓度的CPA(15%二甲基亚砜+15%乙二醇)就能实现96%的细胞存活率,较传统方法降低了CPA浓度,减少了细胞毒性。
4、蛋白质组学分析表明,该方法通过增强线粒体功能、提高抗氧化蛋白和生长因子水平,维持了细胞活性与功能。
5、在小鼠背部创伤模型中,解冻后的3D-MSCsHM展现出与新鲜3D-MSCs相当的伤口愈合效果,能促进血管生成和组织修复。
6、该研究成果解决了3D-MSCs在生产后储存、规模化运输及移植前复苏相关的供应链难题,显著提升了3D-MSCs实际应用的可行性。
本研究在技术原理和概念验证上取得了成功,但要转化为可上市的细胞治疗产品,还需跨越以下工程化挑战:
1、微球生产的“一致性”与“无菌性”放大:
挑战:实验室的同轴微流控装置通量有限,且依赖人工操作。放大到临床级别(需处理数十亿细胞)时,如何保证每小时数千甚至数万微球的尺寸、细胞负载量高度均一?同时,如何在开放式液滴生成与光交联过程中维持A级无菌环境?
潜在解决方案:开发一次性、封闭式、并联化的微流控芯片模块,并与无菌流体系统、在线光学检测(实时监控微球尺寸)集成,实现过程分析技术(PAT)控制。
2、冷冻-复温工艺的标准化与自动化:
挑战:文中步骤涉及多次梯度CPA转移、尼龙网蘸取、快速投入液氮等精细手工操作。人工操作的不确定性是临床应用的重大风险。
潜在解决方案:设计全封闭的自动化设备,将微球装载、梯度渗透、快速玻璃化、密封入袋等步骤整合。关键是需要精确控制CPA交换的流体动力学、浸入液氮的速度与角度,以及开发适用于微球批次复温的自动化控温设备。
3、产品质量标准的建立:
挑战:除细胞活率外,对于此类“细胞-材料复合产品”,需建立全新的关键质量属性(CQAs)。例如:微球降解速率是否与体内疗效相关?冷冻后微球的机械性能变化是否需要控制?如何无损检测微球内部细胞的真实状态?
潜在解决方案:结合先进成像技术(如OCT)和非侵入性代谢传感(如植入式生物传感器),建立一套从微球物理属性到细胞功能活性的多维质量控制体系。
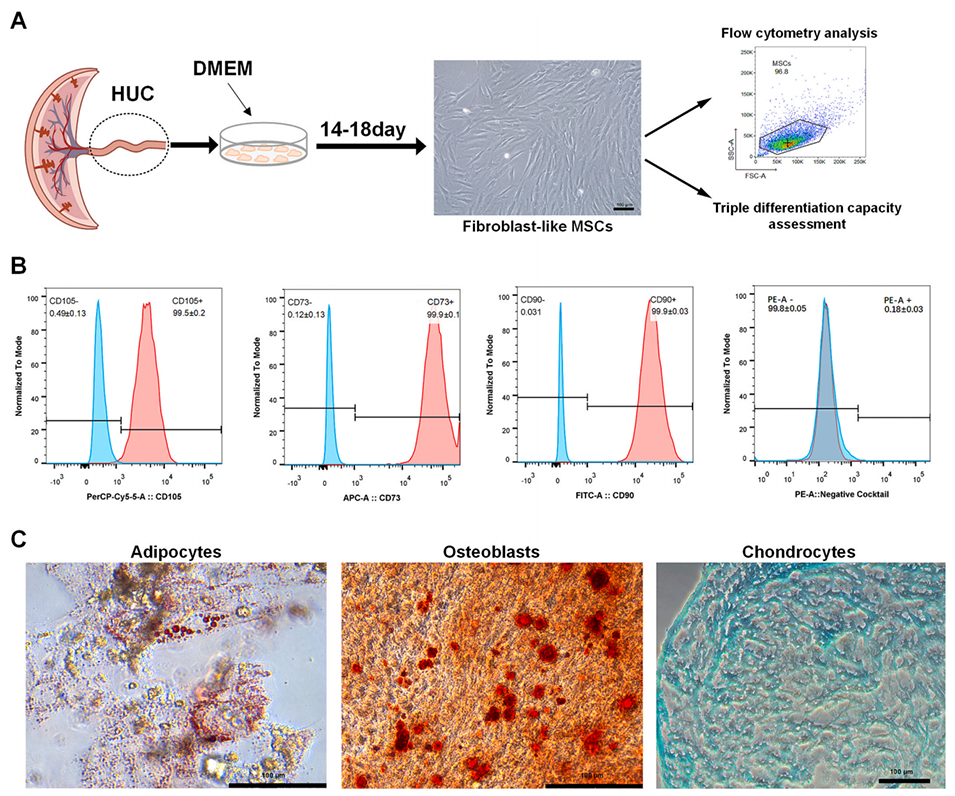
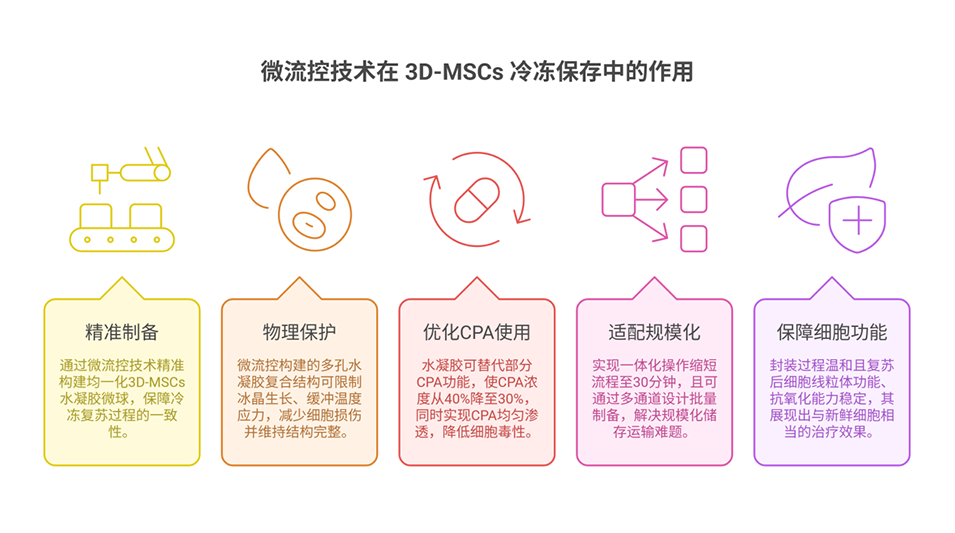
图1. MSCs 的分离与表征。(A)人脐带 MSCs 的分离流程,(B)流式细胞术分析 MSCs 表面标志物表达,(C)MSCs 的成脂、成骨及成软骨三向分化能力验证(比例尺:100 μm)
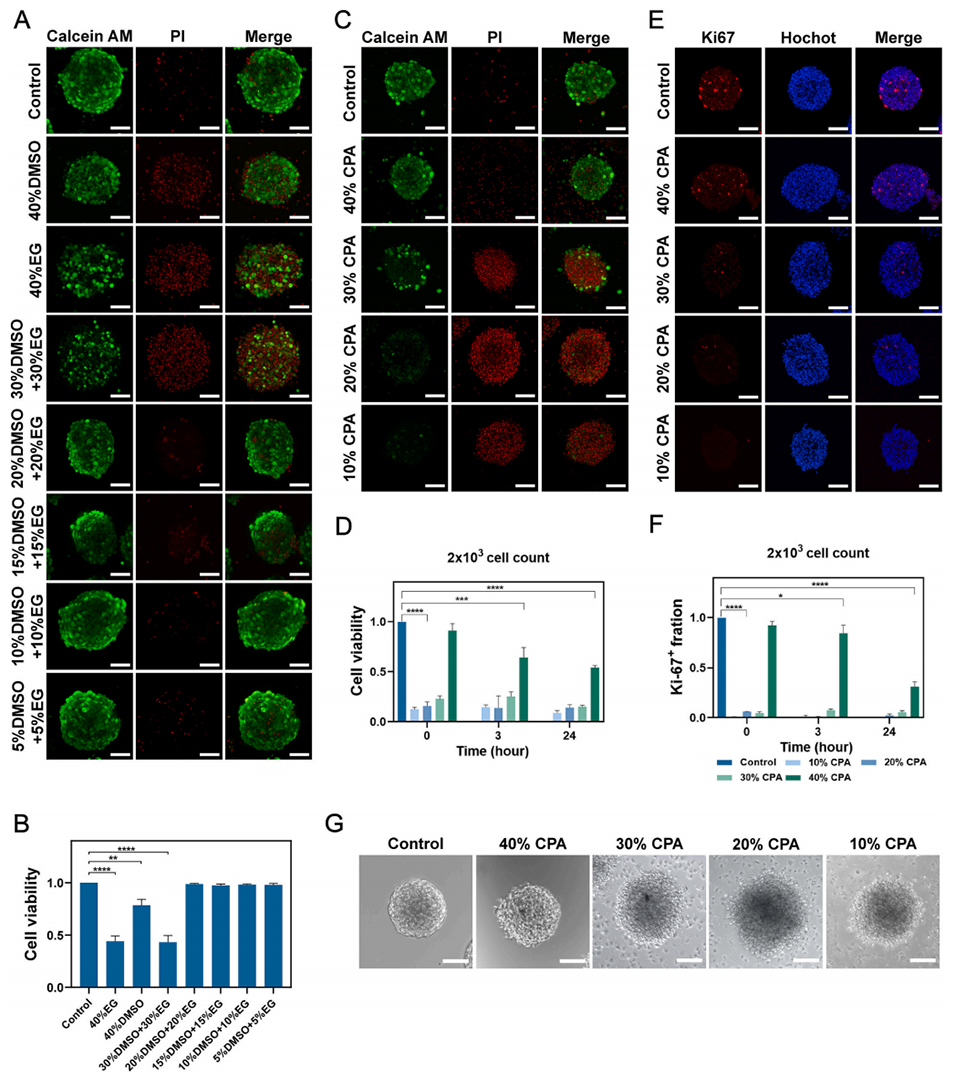
图2. 3D-MSCs 玻璃化冷冻前后细胞活力、功能及形态评估,用于筛选最优冷冻保护剂(CPA)配方与浓度
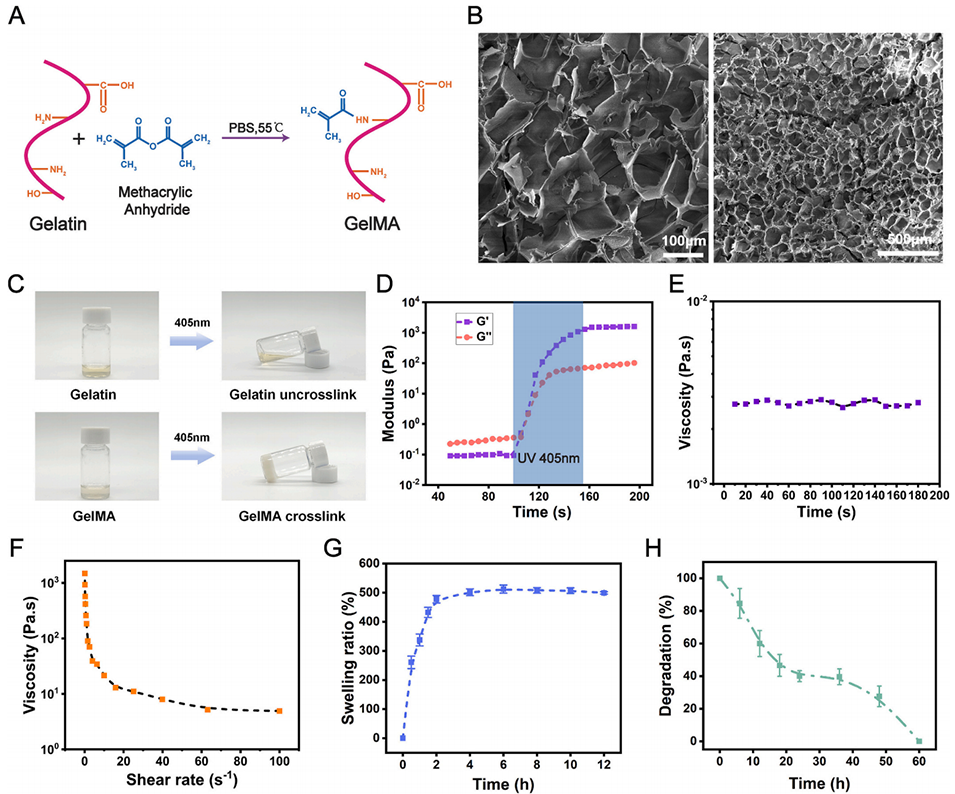
图3. 水凝胶的合成及理化性质表征。(A)GelMA 材料的合成路线,(B)扫描电子显微镜下材料微观形貌(左图比例尺:100 μm;右图比例尺:500 μm),(C)GelMA 材料固化能力验证实验示意图,(D)凝胶的紫外光固化过程及最终储能模量,(E)GelMA 材料的黏度变化,(F)GelMA 材料的剪切变稀特性,(G)GelMA 材料的溶胀曲线,(H)GelMA 材料的降解曲线(数据以平均值±标准误表示)

图4. 水凝胶微胶囊在低浓度 CPA 条件下对 3D-MSCs 的冷冻保护作用增强

图5. 玻璃化冷冻后 3D-MSCs 及 3D-MSCsHM 的蛋白质组学特征
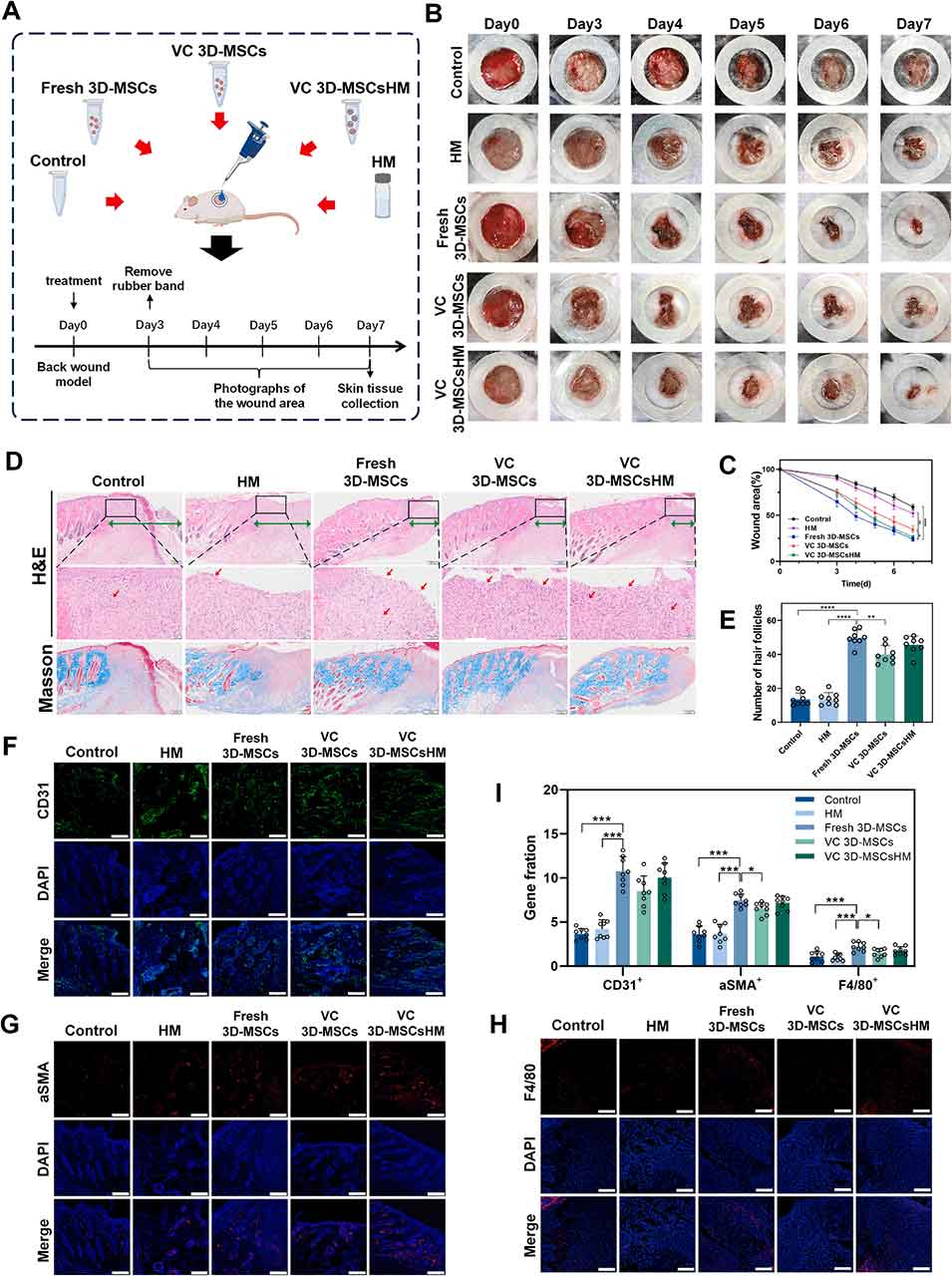
图6. 小鼠背部创伤模型的治疗效果评估
论文链接:https://doi.org/10.1016/j.ijbiomac.2025.139716
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














