微球因微米级尺寸、高比表面积及可调特性,在药物递送、组织工程等生物医学领域应用广泛,其中兼具生物相容性与单分散性的微球更具应用价值。丝素蛋白源自天然蚕茧,具备优异的生物相容性、生物降解性及低免疫原性,是构建功能生物材料的理想单元。目前,丝素蛋白微球的制备方法,如静电喷雾、乳液扩散等普遍面临单分散性控制难、制备周期长、或依赖化学交联剂/引发剂等问题,限制了其应用潜力。
微流控技术虽能实现单分散微滴的精准调控,但现有凝胶化方法仍存在时间长、步骤复杂或引入外源物质等挑战。同时,丝素蛋白微球的本征荧光特性及其与微观结构的关联尚不明确。因此,开发一种快速、可控、无需外源添加剂的丝素蛋白微球制备方法,并揭示其形成机制与荧光特性,对推动该类材料在生物医学领域的应用具有重要意义。

鉴于此,川北医学院蒙治君副教授团队开发了一种基于液滴微流控技术快速制备单分散荧光丝素蛋白微球的新方法。该方法采用独特的θ形毛细管装置,将丝素蛋白溶液与乙醇在微滴生成瞬间混合,有效避免了预凝胶化,并通过调控温度与乙醇浓度,在20分钟内可控制备出单分散的实心或核壳结构微球。团队首次发现并系统研究了此类微球的本征荧光特性,该荧光源于其内部β-折叠的规整堆积,并成功利用此特性实现了酶降解过程的实时可视化监测。细胞实验进一步证实了微球良好的生物相容性。相关研究以“Droplet Microfluidic Rapid Fabrication of Monodisperse Fluorescent Silk Fibroin Microspheres by Tuning the Temperature-Ethanol Mediated Gelation Process”为题目,发表于期刊《Advanced Materials Technologies》。
本文要点:
1、本文提出了一种可靠、简便的液滴微流控方法,基于可控的温度-乙醇介导凝胶化过程,实现了具有显著本征荧光的单分散丝素蛋白微球的快速、可控制备。
2、该方法利用乙醇诱导凝胶化理论,加速微液滴内丝素蛋白β-折叠结构的形成,进而组装成丝素蛋白微球,并采用共聚焦激光扫描显微镜对其本征荧光特性进行表征。
3、为验证该液滴微流控方法的有效性、快速性与可控性,系统探究了孵育温度和乙醇浓度对微球制备过程、尺寸、形貌及荧光性能的影响。值得注意的是,通过调控孵育温度,可在20分钟内快速制备出微球;而改变乙醇浓度则能得到实心或核壳结构等不同形貌的产物。
4、对未来研究与应用而言至关重要的是,研究发现所制备的微球展现出优异的本征荧光特性 —— 这一特性与提取态丝素蛋白截然不同,且此前尚未见相关报道。
5、基于这一发现,无需借助外部荧光探针,即可实现微球酶降解过程的可视化实时监测,为深入研究丝素蛋白的聚集结构奠定了基础。此外,该新型微球的生物相容性已得到证实,为其生物医学相关应用奠定基础。
6、本研究为丝素蛋白的加工及丝素蛋白微球的新型光学特性提供了新的见解,同时为开发适用于多种场景的高性能荧光功能微球提供了有效策略。
温度-乙醇介导的凝胶化过程是如何加速微滴内β-折叠形成的?
温度-乙醇介导的凝胶化通过热力学调控与动力学加速的协同作用,推动微滴内丝素蛋白β-折叠快速形成。乙醇作为温和的溶剂调节剂,进入体系后降低了溶剂极性,削弱了丝素蛋白分子链与水分子间的氢键作用,促使疏水氨基酸残基暴露并驱动分子链自发聚集,同时通过弱氢键作用引导链段规整排列,为β-折叠成核提供结构基础。
温度升高则进一步加速乙醇与水分子的扩散蒸发,提升蛋白分子热运动速率,降低β-折叠形成的活化能,促进初始成核的β-折叠片段快速延伸并相互交联,缩短凝胶化进程。
而微流控构建的均一微环境确保了乙醇浓度与温度在微滴内的均匀分布,强化了分子间接触效率,三者共同作用使β-折叠形成速率显著提升,实现20分钟内微球的快速成型。
这一过程中,β-折叠的堆积不仅是凝胶化的核心驱动力,也直接赋予了微球独特的固有荧光特性,其含量与温度-乙醇调控参数呈正相关,经FTIR与激光共聚焦表征得到充分验证。
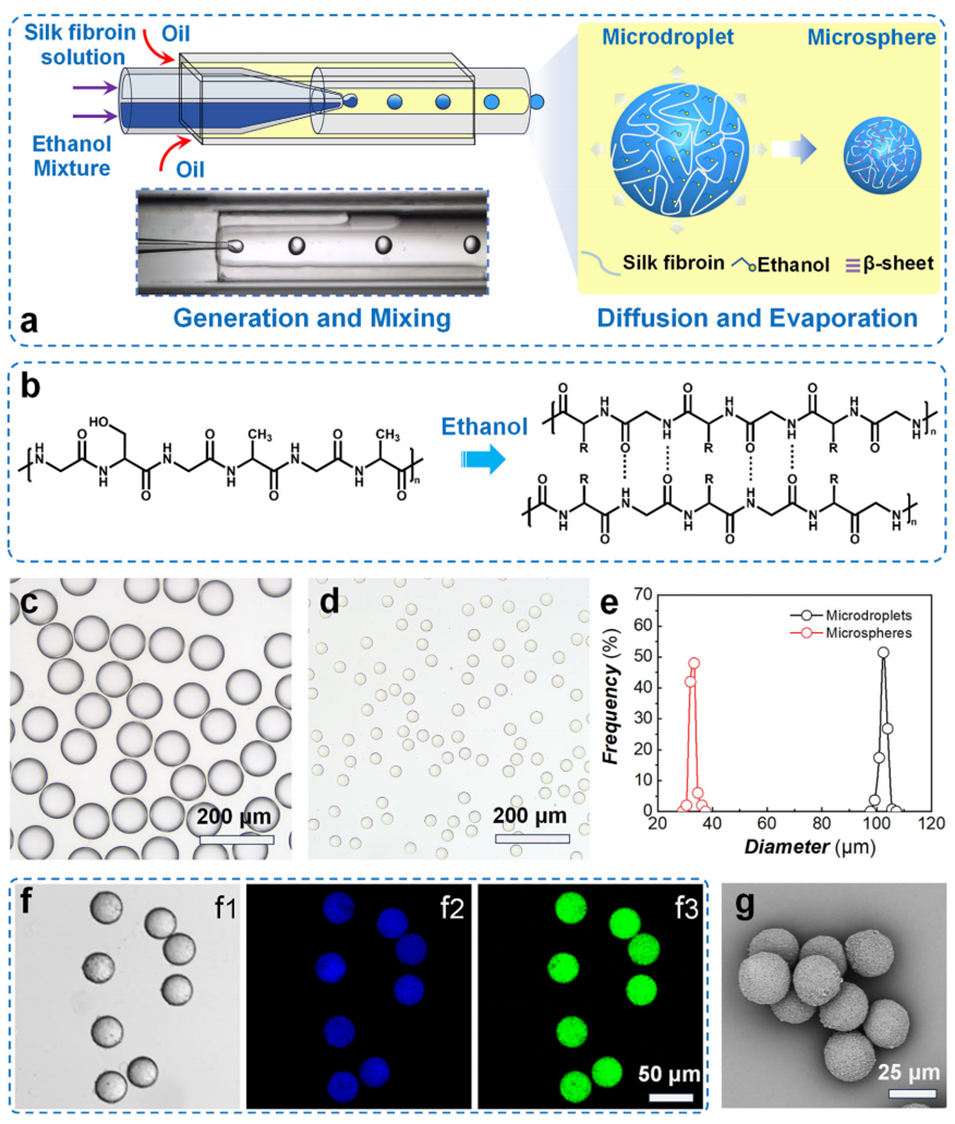
图1 液滴微流控制备荧光丝素蛋白微球

图2 通过调控孵育温度实现丝素蛋白微球的可控制备
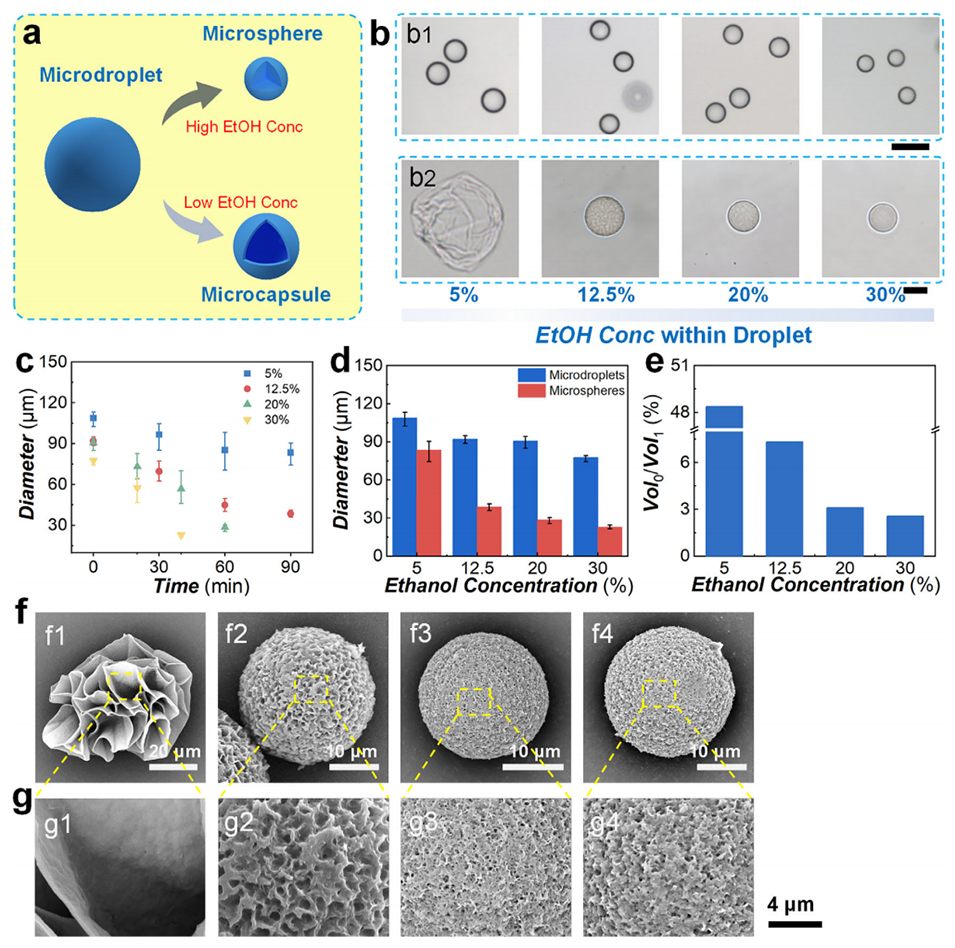
图3 通过改变含丝素蛋白微滴内的乙醇浓度实现丝素蛋白微球的可控制备
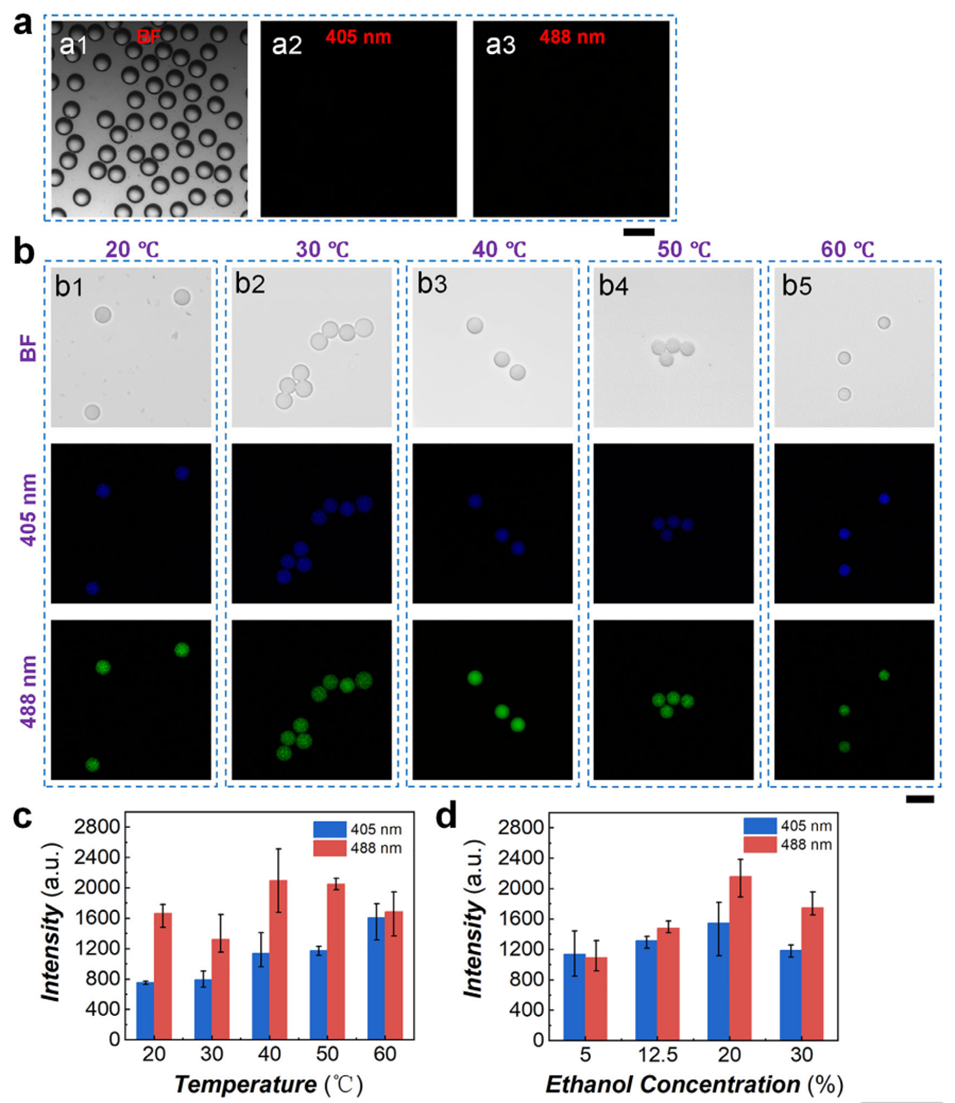
图4 孵育温度和乙醇浓度对丝素蛋白微球固有荧光的影响
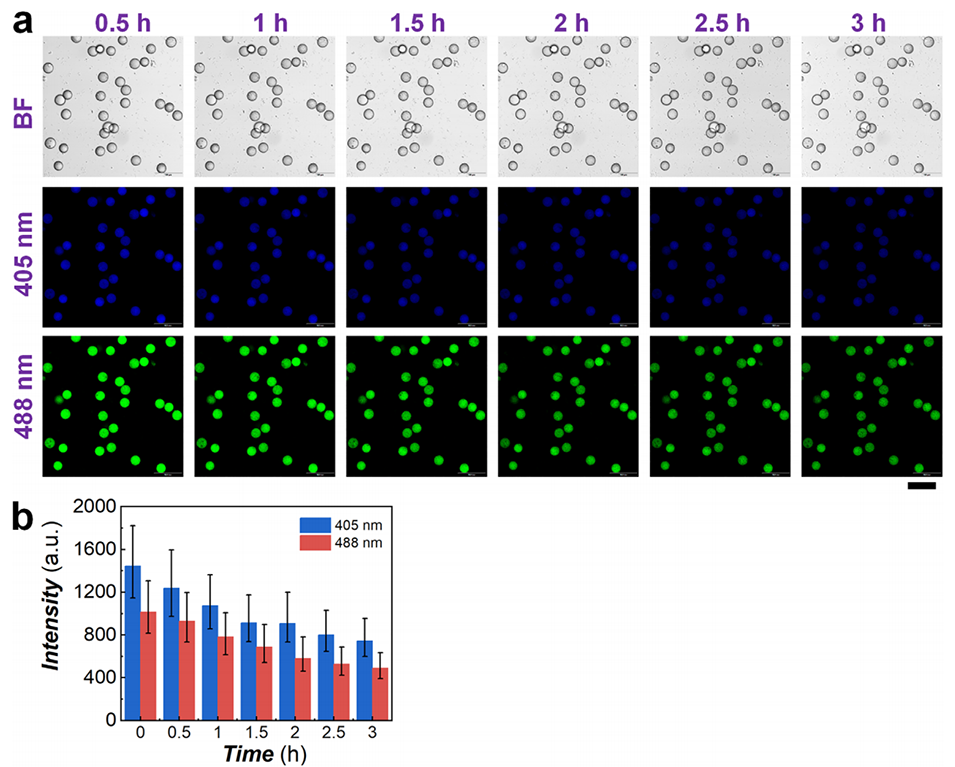
图5 丝素蛋白微球固有荧光随酶降解时间的变化
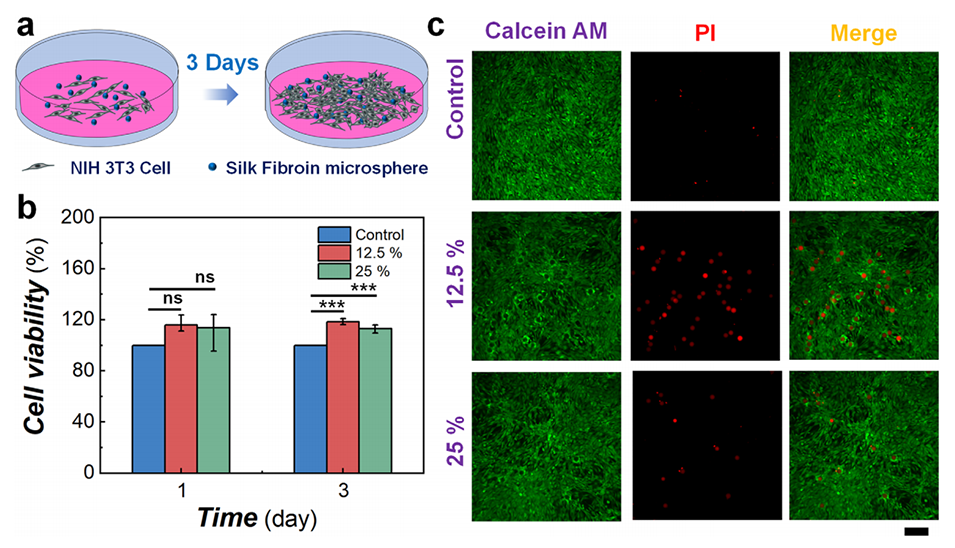
图6 荧光丝素蛋白微球的体外生物相容性
论文链接:https://doi.org/10.1002/admt.202501597
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














