传统多孔支架制备技术难以精确调控孔隙结构与分布,无法仿生天然组织的复杂层级。3D打印为此提供了新途径,但现有生物打印策略或依赖有害组分,或无法在打印中实时调节孔隙,且细胞直接封装与长期存活仍是挑战。因此,开发一种能在线调控孔隙并高效载细胞的一体化打印方法,成为构建仿生梯度支架、推动组织工程发展的关键需求。

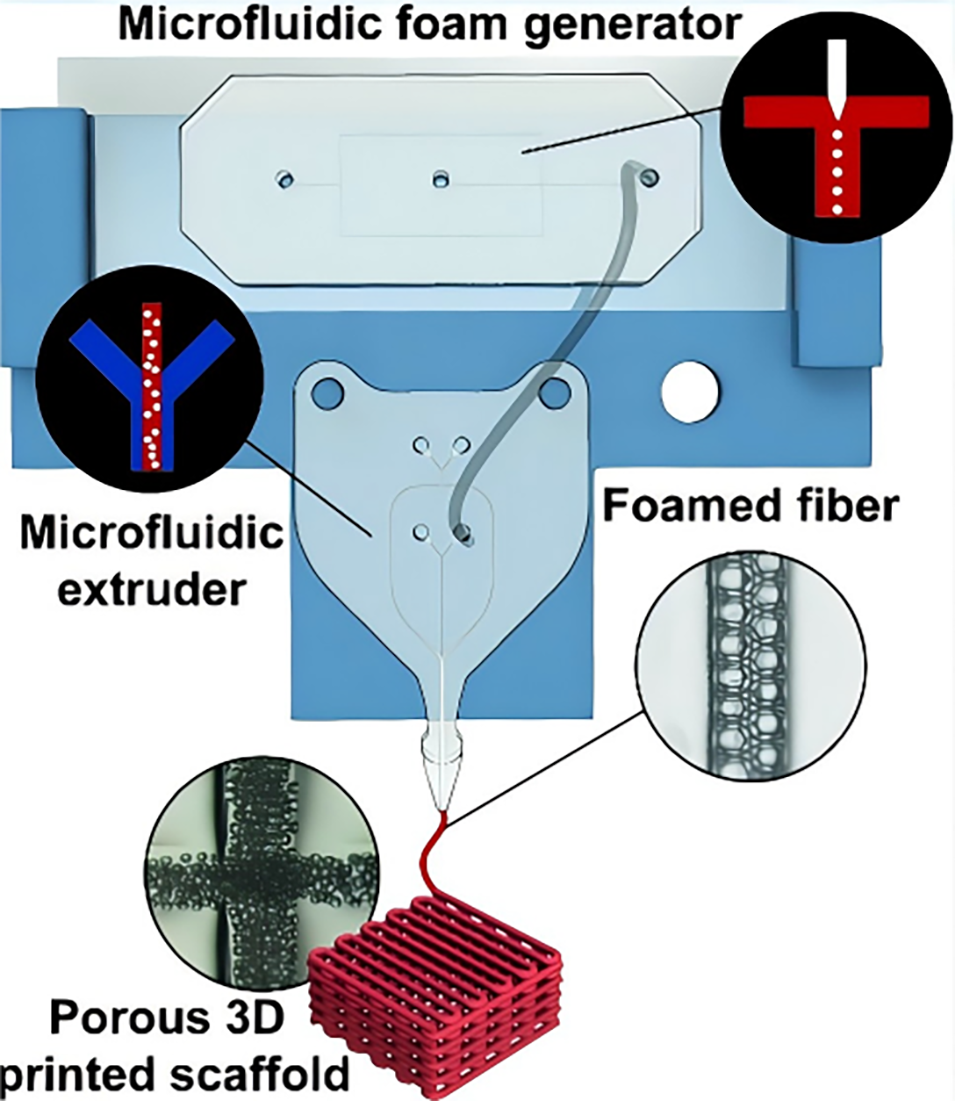
近日,波兰科学院物理化学研究所联合意大利技术研究院等单位提出一种融合微流控技术与3D生物打印的创新方法,通过串联的泡沫生成芯片与挤出芯片实时生成液体泡沫并同步诱导凝胶化,实现了对纤维内部气泡尺寸、孔隙率与空间分布的动态调控,从而一步制备出具有定制化孔隙梯度的载细胞多孔支架。相关研究以“Microfluidic 3D Bioprinting of Foamed Fibers with Controlled Micromorphology”为题目,发表于期刊《ACS Applied Materials & Interfaces》。
本文要点:
1、本研究提出一种融合微流控技术与3D生物打印的创新方法,通过串联的泡沫生成芯片与挤出芯片实时生成液体泡沫并诱导凝胶化,可一步制备多孔功能梯度材料(pFGMs)。
2、该方法能通过调控气压(700-1600 mbar)和生物墨水流速(25-40 μL/min),动态调节气泡尺寸(25-73 μm)、体积分数(最高74%)及孔隙模式(单孔隙、阶梯/交替/梯度多级孔隙),实现高空间精度的孔隙分布。
3、研究所用LAG生物墨水由0.5%w/v Laponite、2%w/v海藻酸盐、1.5%w/v明胶和0.125%v/v Plantacare 2000组成,经优化后具备良好的泡沫稳定性和细胞相容性,可直接封装MG63骨肉瘤细胞。
4、细胞实验表明,在最佳条件(10×10⁶ cells/mL细胞浓度、0.04%表面活性剂浓度、20%初始空气分数)下,细胞可在支架内存活21天并形成70-120 μm的聚集簇,RGD修饰与μTG交联能进一步优化细胞粘附与迁移性能。
5、力学表征显示,支架弹性模量和韧性随孔隙率增加而降低,高孔隙支架较对照组分别降低47%和62%,且韧性对内部微孔结构变化更敏感。
6、该技术无需有机溶剂,泡沫实时凝胶化保障结构稳定性,在骨组织修复、肿瘤模型构建等再生医学领域具有重要应用价值,但仍面临表面活性剂细胞毒性、μCT成像孔隙区分困难等挑战。
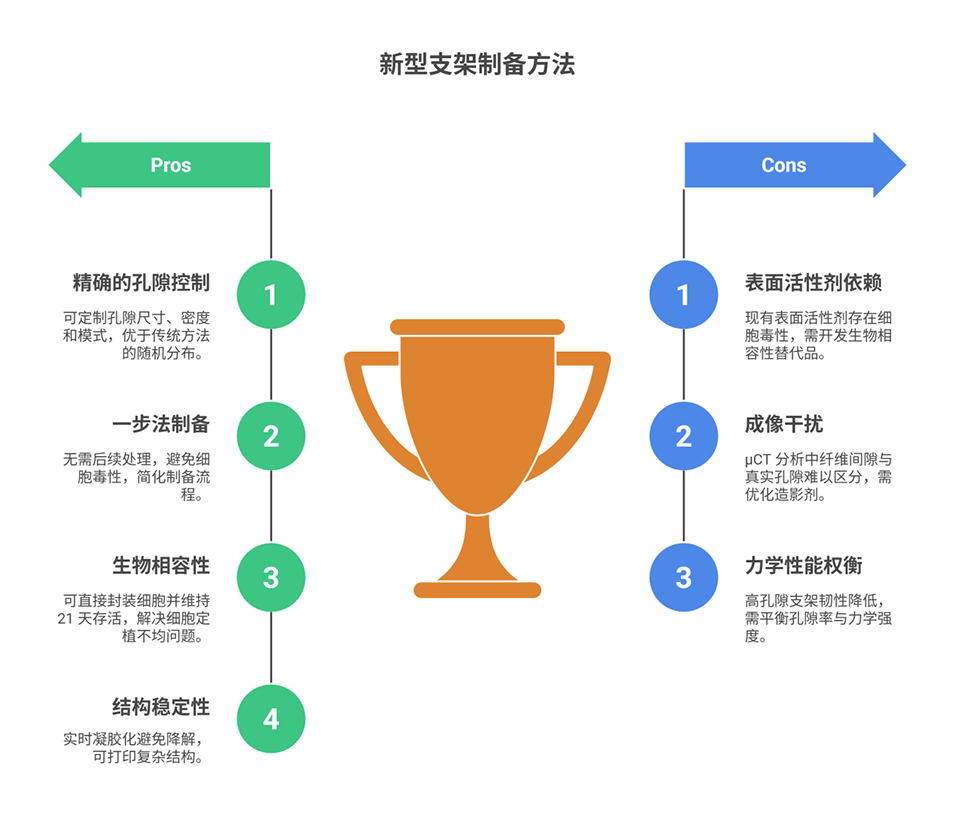
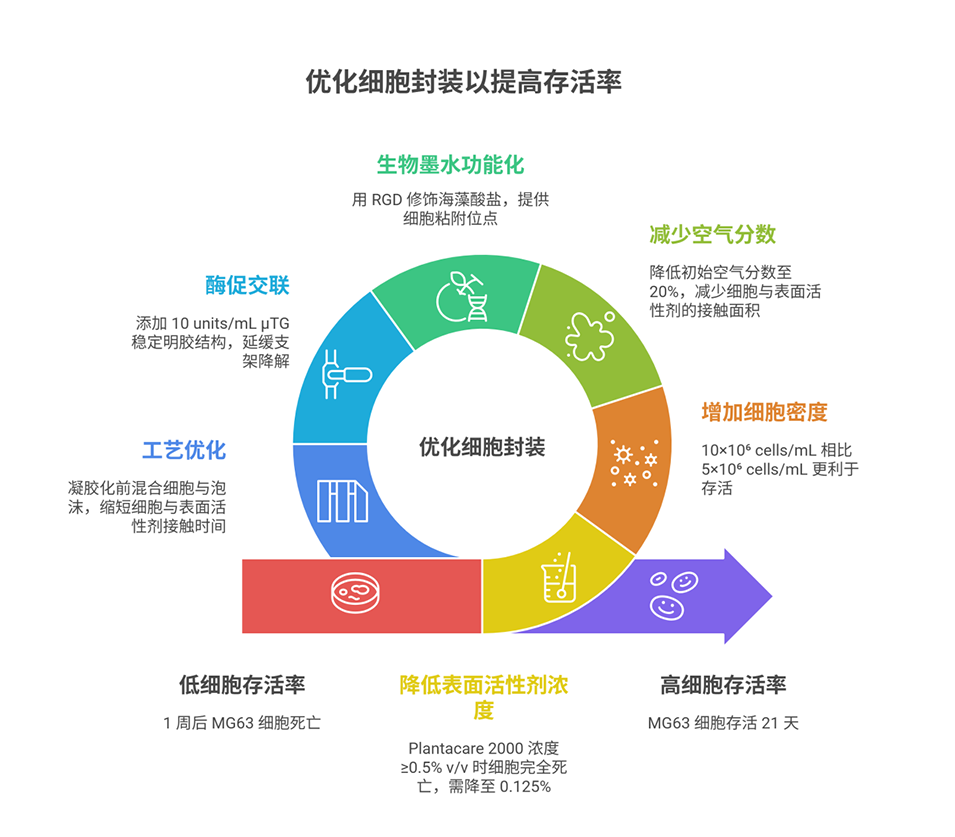
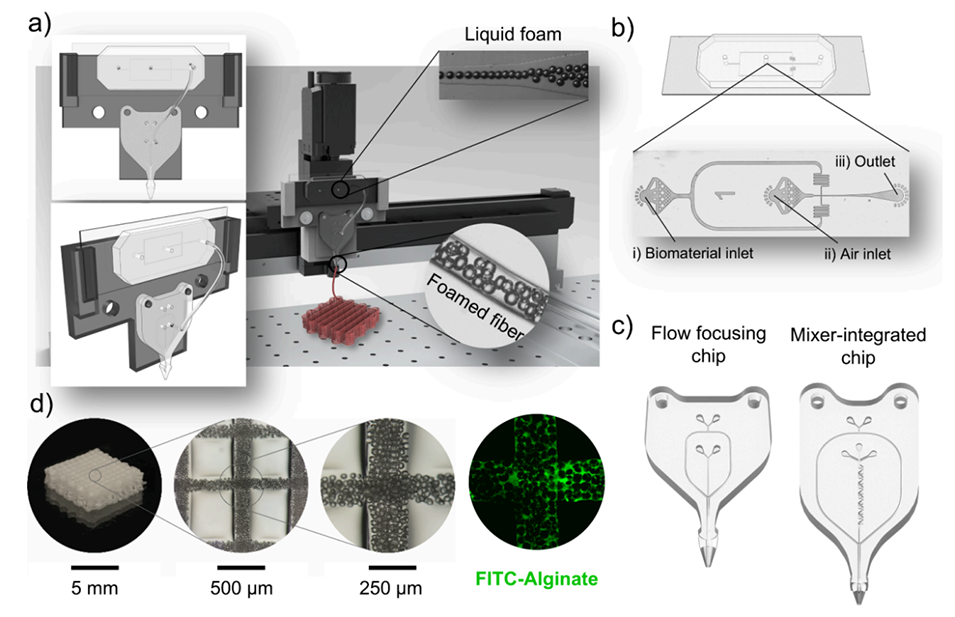
图1. 装置总览
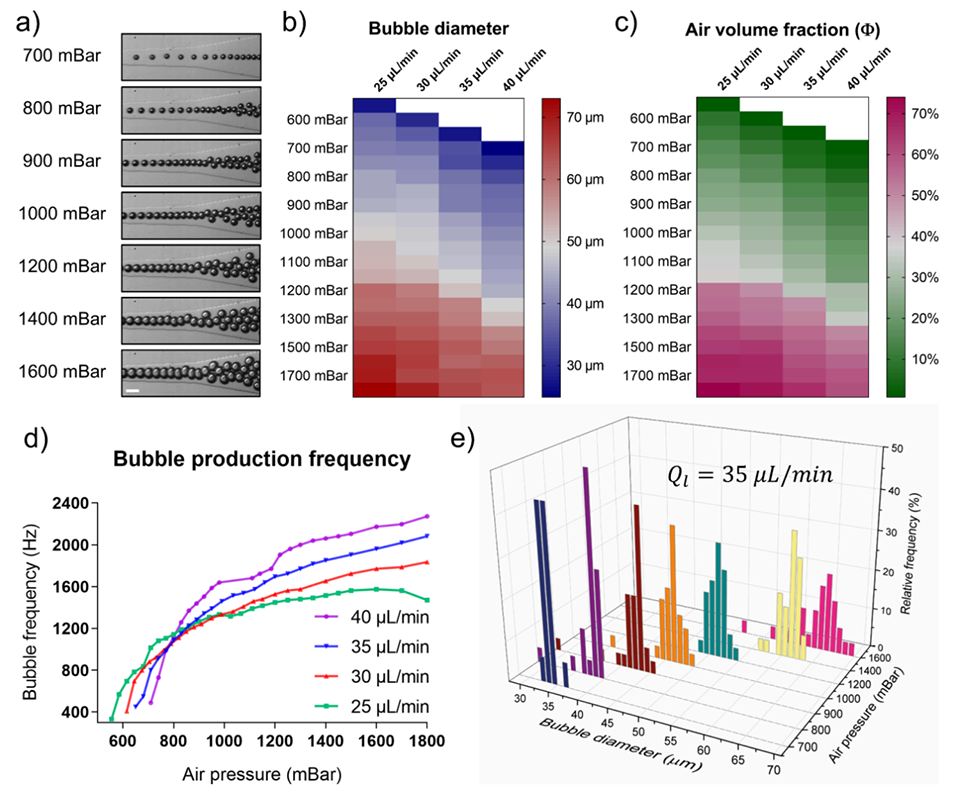
图2. 微流控泡沫的表征
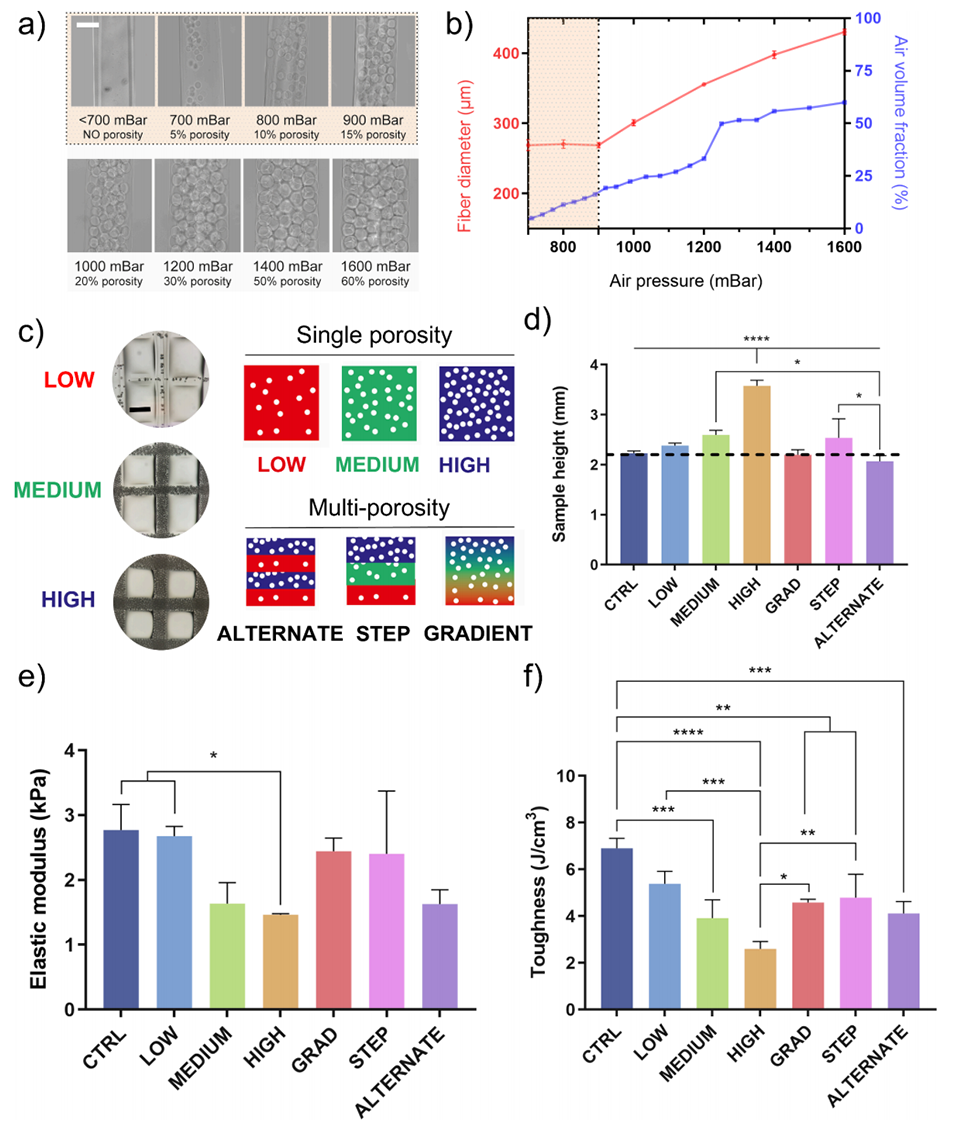
图3. 泡沫纤维直径及泡沫支架性能
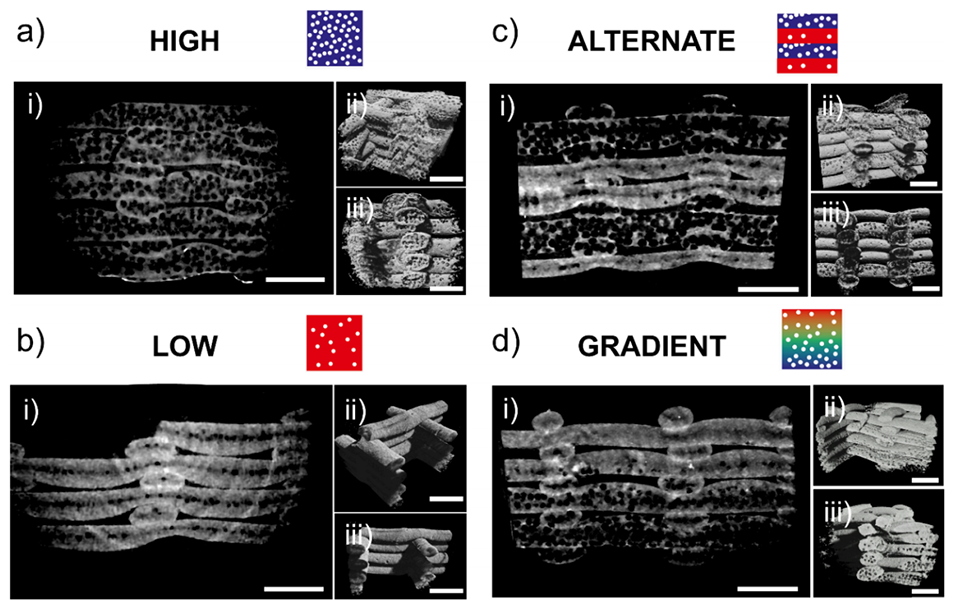
图4. 单孔隙与多孔隙结构的显微 CT 扫描结果
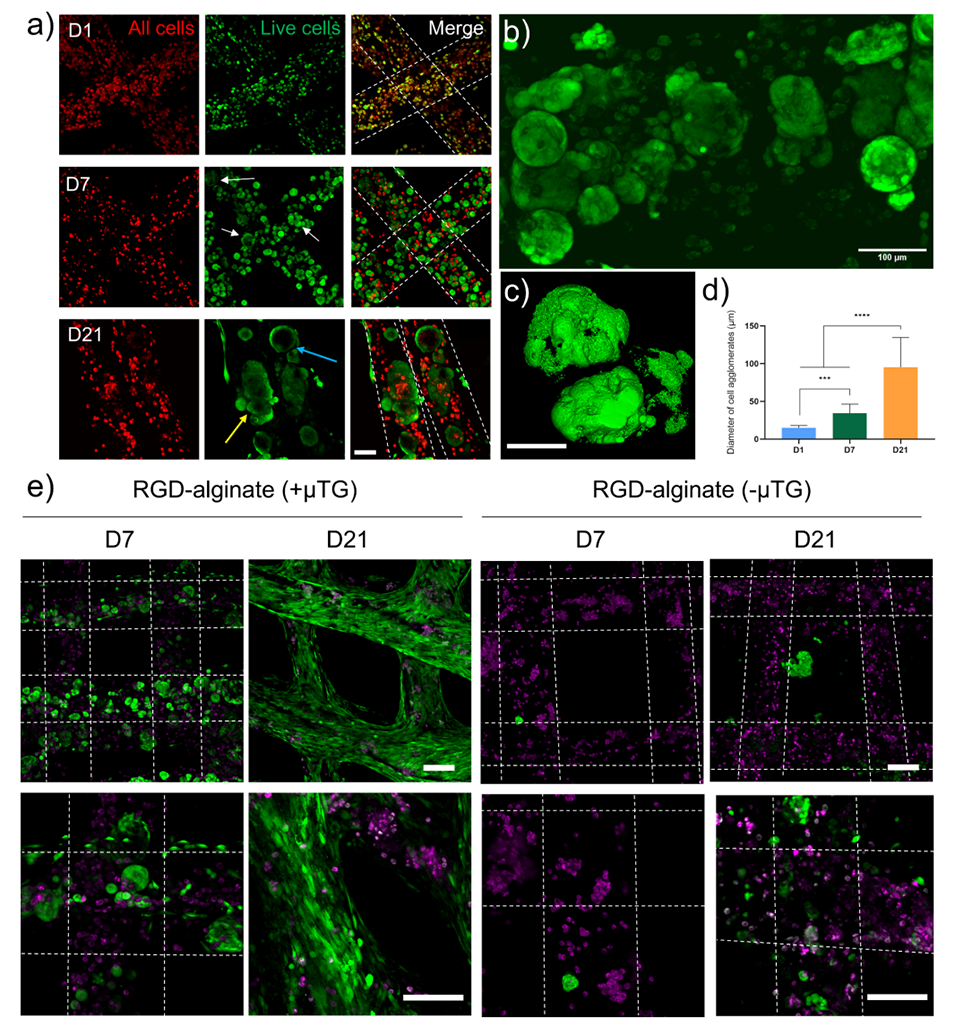
图5. 泡沫生物墨水中封装的 MG63 细胞活力染色结果
论文链接:https://doi.org/10.1021/acsami.4c22450
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)