
导读:
近期,佛罗里达州立大学化学与生物化学系研究人员发表综述,聚焦液滴微流控技术在抗生素发现中的创新应用,系统阐述其如何突破难培养微生物利用、低通量筛选、已知化合物重复发现等传统瓶颈,相关研究成果以“Droplet Microfluidics Strategies for Overcoming Bottlenecks in Antibiotics Discovery”为题目,发表于期刊《iScience》。
本文要点:
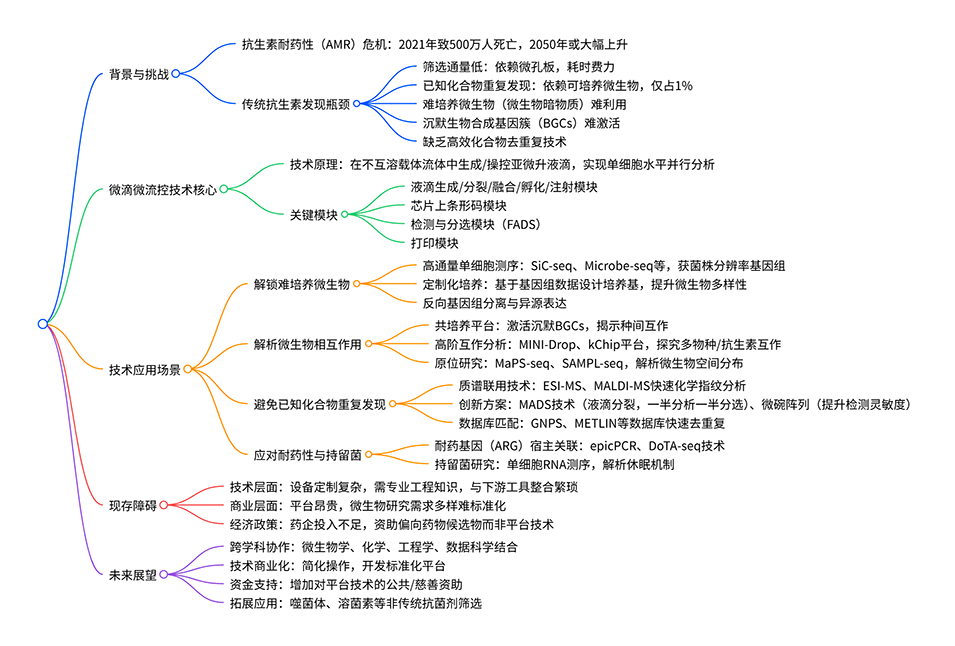
1、本综述聚焦微滴微流控技术在抗生素发现中的应用,旨在解决抗菌素耐药性(AMR)引发的全球健康危机,突破传统抗生素发现的瓶颈。
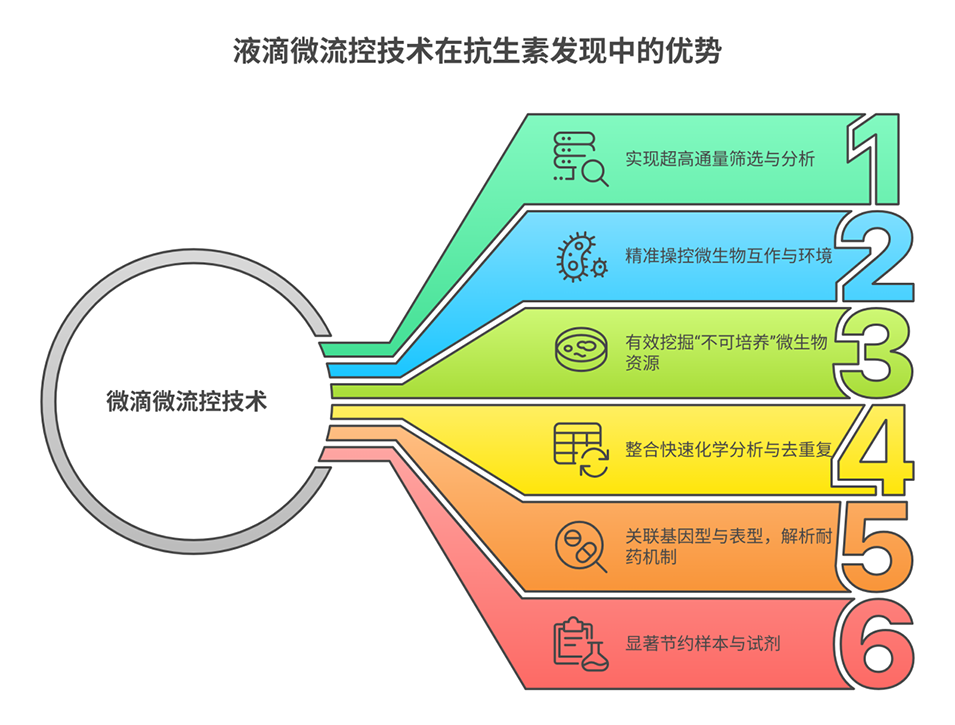
2、传统抗生素发现方法受限于低通量、已知化合物重复发现、难培养微生物难以触及以及沉默生物合成基因簇(BGCs)激活困难等瓶颈。微滴微流控技术通过微升/纳升级别液滴的生成、操控与分析,实现单细胞水平的大规模平行研究,为解决这些问题提供了新方案。
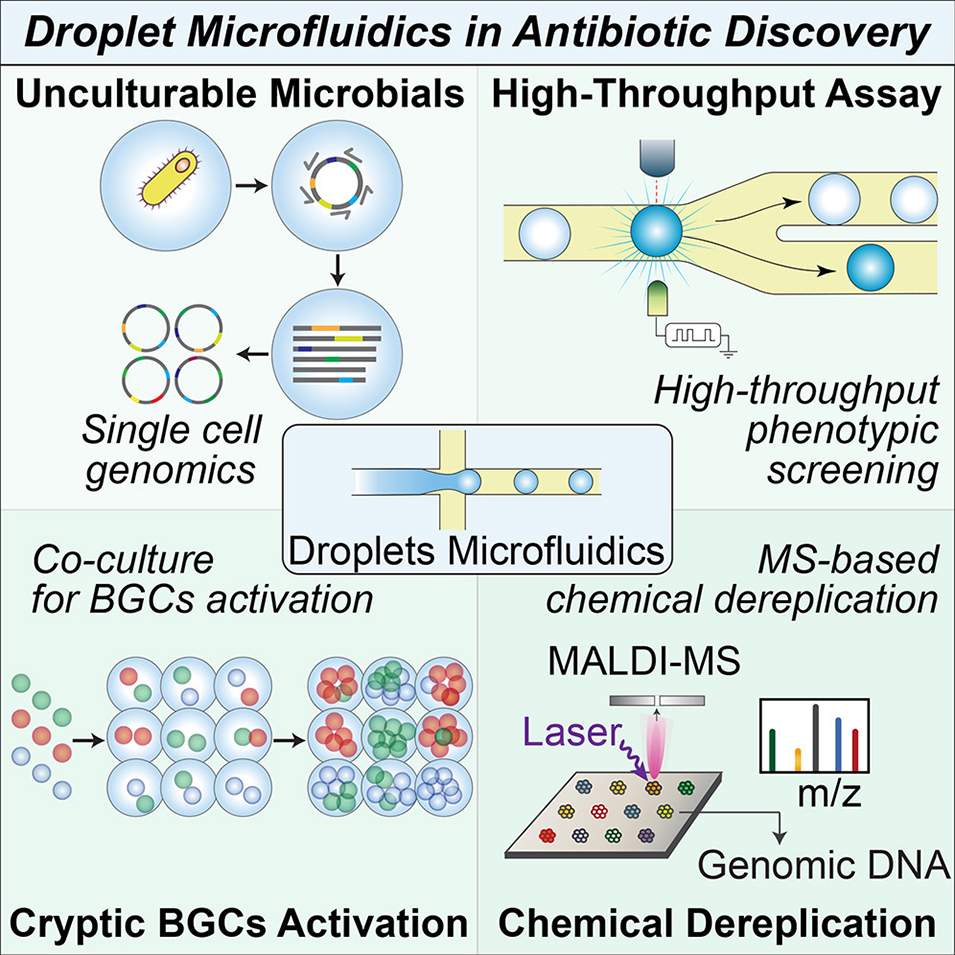
3、文章重点阐述了该技术的四大核心应用:一是借助高通量单细胞测序等技术挖掘“微生物暗物质”,获取不可培养微生物的基因组信息;二是通过微流控共培养平台激活隐蔽BGCs,解析微生物间的相互作用;三是结合质谱技术加速化学筛选去重复与新型代谢物发现;四是通过关联抗生素耐药基因与微生物宿主及单细胞转录组,揭示耐药性和持留机制。
4、同时,文章也指出该技术面临技术复杂、成本高、商业化不足、资金与政策支持有限等推广障碍,并强调需跨学科协作、持续资金投入及技术转化,以推动其在抗生素发现中的广泛应用,应对AMR带来的全球挑战。
一张图读懂全文
用于抗生素发现的核心微滴微流控模块大体可以分为以下9类:
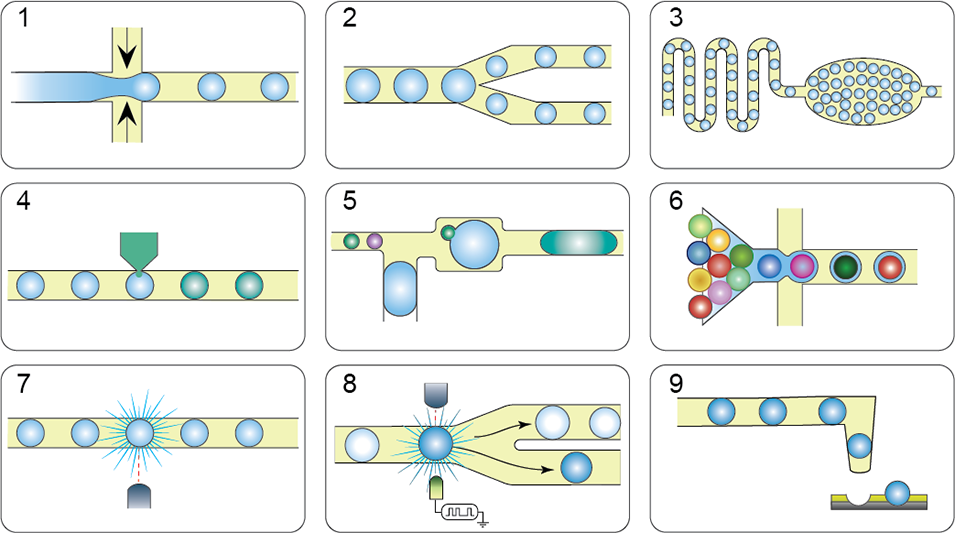
微滴生成模块:生成体积均一的皮升至纳升级微滴,是实现单细胞、试剂或 DNA 模板分区封装的核心。
微滴分裂模块:将微滴分割为更小体积或进行复制,适用于平行检测或剂量反应筛选。
微滴孵育模块:长时间维持微滴内稳定环境,支持微生物生长、基因表达或相互作用,通常集成温度控制功能。
微滴注射模块:无需融合即可向现有微滴中添加试剂,可实现抗生素、底物或诱导剂的定时递送。
微滴融合模块:将两个或多个微滴合并,用于添加试剂或启动共培养,可实现抗生素与微生物微滴的混合,或单细胞裂解物与条形码的融合。
芯片上条形码模块:为单细胞或分子添加独特条形码,是微滴中单细胞组学分析的关键。
微滴检测模块:通过光学或电学方式读取荧光信号、吸光度或细胞形态,对表型筛选或转录组条形码分析至关重要。
微滴分选模块:根据荧光信号或其他指标选择性分选微滴,可富集目标阳性样本(如具有生长抑制活性或代谢产物生成能力的微滴)。
微滴打印模块:将微滴定点沉积到载体(如载玻片、微阵列、MALDI 板)上,支持下游成像、质谱分析或固体培养基上的高通量培养。
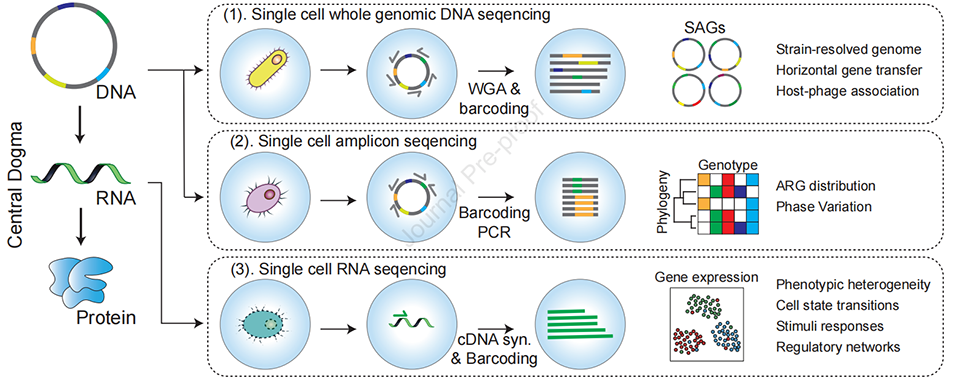
图1:微生物单细胞测序的三种方法概述。(1)微生物单细胞鸟枪法测序:旨在回收单个微生物细胞的全部基因组内容,可高通量生成单细胞扩增基因组(SAGs);(2)微生物单细胞扩增子测序:靶向特定目标基因 —— 通常用于系统发育分类或功能表征,允许在单细胞水平进行基因型分析;(3)微生物单细胞转录组测序:分析单个细胞的基因表达谱,以揭示功能活性和调控状态。
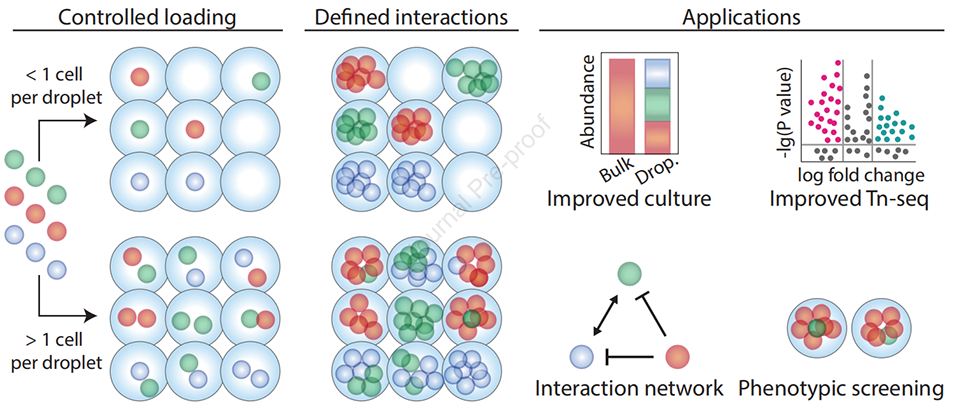
图2:微滴微流控技术可精准调控细胞间相互作用分析。当单个细胞被封装在独立微滴中时,细胞间的相互作用会被消除,这有助于慢生长物种的培养并提升分类丰富度。该设置还可用于优化转座子测序(Tn-seq)分析。相反,每个微滴封装多个细胞则能实现微生物相互作用的高通量分析和表型筛选。
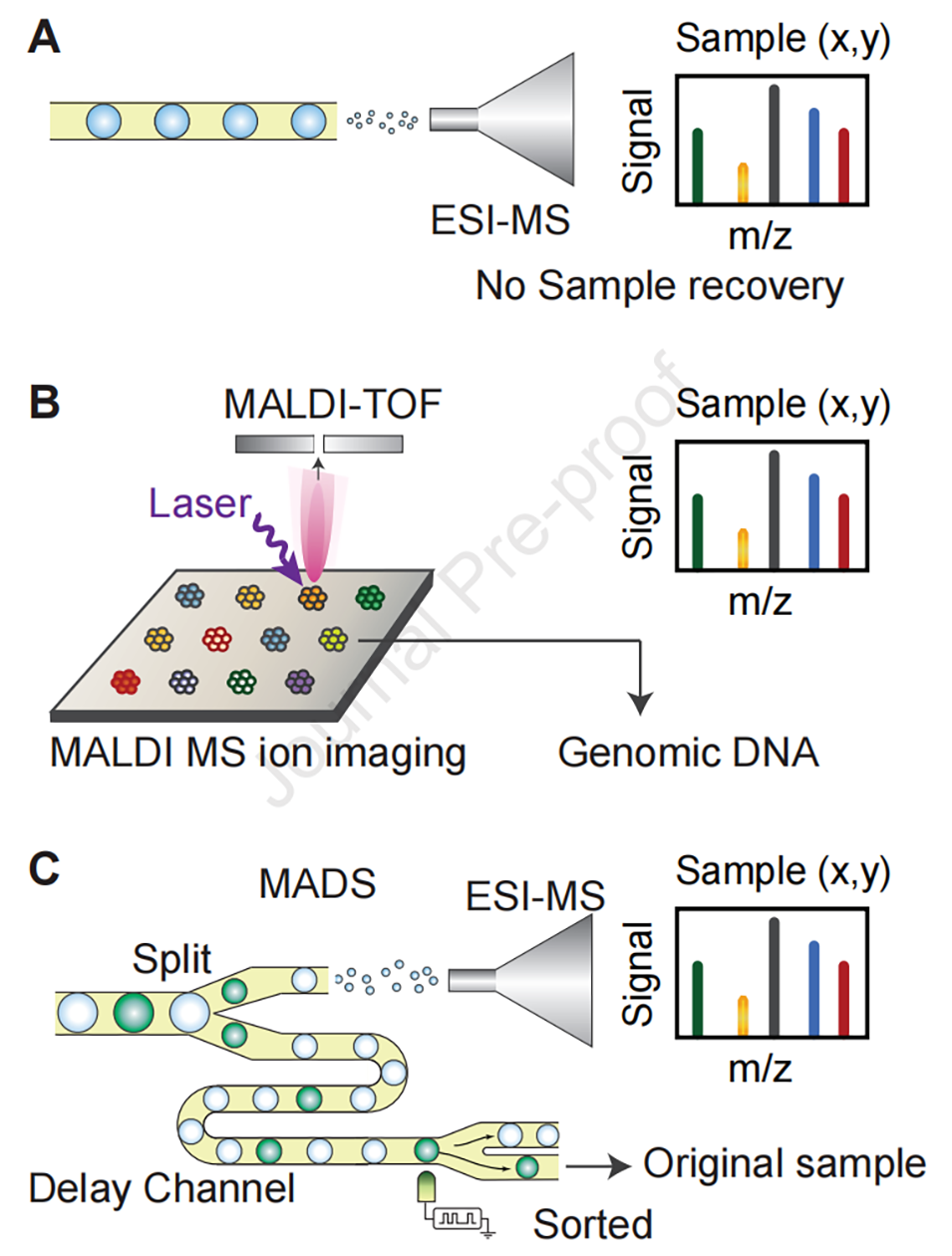
图3:微滴的质谱分析方法。(A)电喷雾电离(ESI)可直接分析微滴,但该方法具有破坏性 —— 分析后样本无法回收;(B)基质辅助激光解吸电离飞行时间(MALDI-TOF)成像能够分析微滴阵列,但由于 MALDI 技术所需的基质涂覆和真空环境,分析后的细胞不再具有活性,而基因组 DNA 仍可回收;(C)质量激活微液滴分选(MADS)技术将每个微滴一分为二:一半进行 ESI-MS 分析,另一半根据代谢物谱图进行分选,该方法可同时实现生物活性化合物的鉴定和产生菌株的回收。
论文链接:https://doi.org/10.1016/j.isci.2025.114377
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














