
导读:
水凝胶微颗粒在组织工程、3D生物打印及细胞治疗中具有重要潜力。然而现有制备方法常依赖复杂设备与操作,限制了其实际应用。近期,有研究人员提出一种三步实验法开发负压驱动微流控液滴发生器,通过出口储液器负压引液实现含活细胞的球形、核壳型及Janus型海藻酸盐微凝胶的高效合成,该方法简化了设备与操作且可重复性强,细胞封装后长期培养存活率超80%。相关研究以“Negative Pressure Actuated Microfluidic Droplet Generation Enables High-Throughput and Robust Synthesis of Cell-Laden Alginate Microgels”为题目,发表在期刊《ACS Biomaterials Science & Engineering》上。
本文要点:
1、本研究提出一种基于负压驱动液流的微流控液滴生成方法,仅需在出口处施加负压即可引入所有液相,成功制备了球形、核壳型及Janus型海藻酸微凝胶,并实现了活细胞的高效封装。
2、该系统操作简单、稳定性高、重复性好,微凝胶尺寸与结构由芯片设计决定,在-7至-15 kPa压力范围内保持稳定,细胞存活率超过80%。
3、该技术为多组分微凝胶的自动化、规模化制备提供了新途径,有望推动其在组织工程与生物打印中的应用。
该研究提出的三步法微流控芯片开发流程是一种通过实验迭代,将多相流体的精密流量控制转化为固定芯片结构设计的策略。具体步骤如下:
第一步先把芯片设计的基础参数和关键结构定下来。用独立的注射泵来精确控制不同流体的流量,通过反复测试找到能生成目标尺寸(80-120μm)和特定结构(比如核壳型、Janus 型)微凝胶的各相流速比,同时还要设计好液滴生成区域和出口通道的基本尺寸,确保后续液滴形成后能顺利交联,而且不会发生变形,为后续芯片制作打牢基础。
第二步是优化入口通道的水力阻力,让负压驱动时能自动实现之前确定的流速比。把入口通道做成蛇形,通过调整通道长度、改变开孔位置这些方式来调节每个入口的水力阻力,之后通过实验观察不同阻力配置下液滴的生成情况,一点点校准参数,直到能稳定复现第一步找到的流速比,这样后续用负压驱动时,不用额外装流量传感器,流体也能按需求稳定分流。
第三步是固化芯片的最终设计,让芯片结构更简单,同时保证制作工艺的稳定性和结果的可重复性。把第二步里用的蛇形通道换成直线或者微弯通道,把之前校准好的水力阻力参数固定下来,形成最终的芯片样式。这款成品芯片后续使用时,只需要通过调节出口储液器的负压(-7 至 - 15kPa)来控制微凝胶的生成频率,不用再进行复杂的流量调节,就能高效、稳定地合成微凝胶。
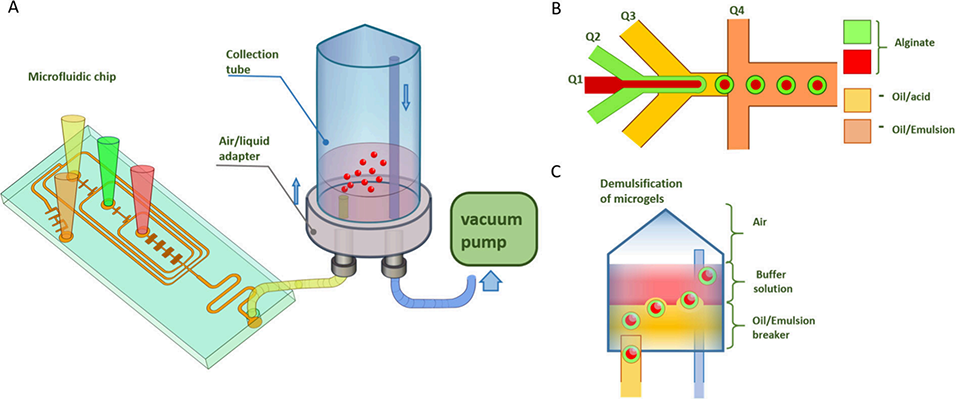
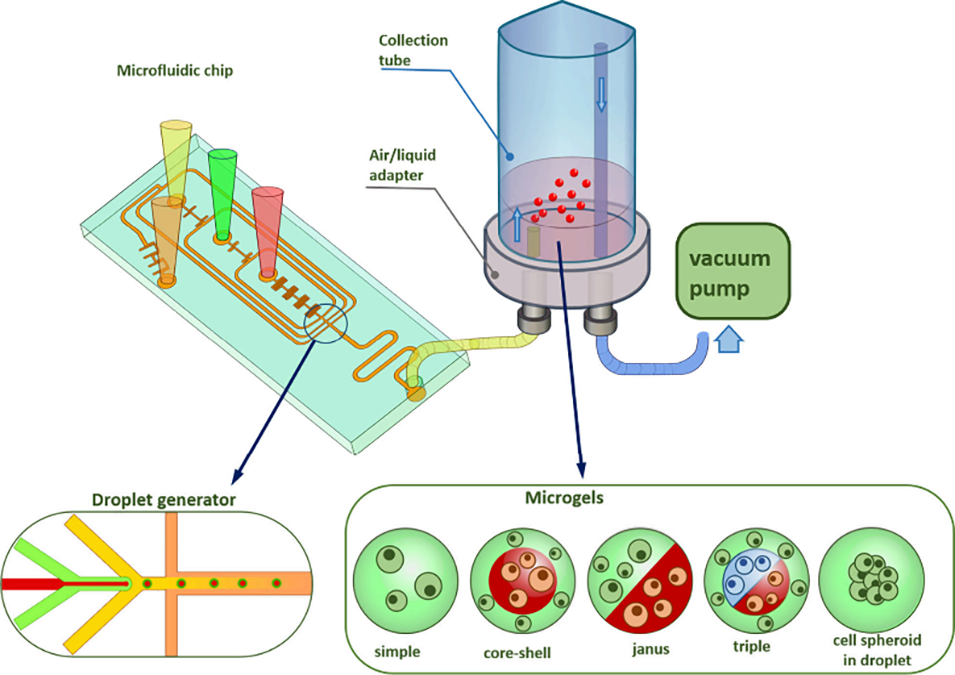
图1 海藻酸盐微凝胶合成的实验装置。A - 微流控装置示意图;B - 微流控芯片中海藻酸盐微凝胶的形成示意图;C - 收集管中微凝胶从油相到水相的转移过程。
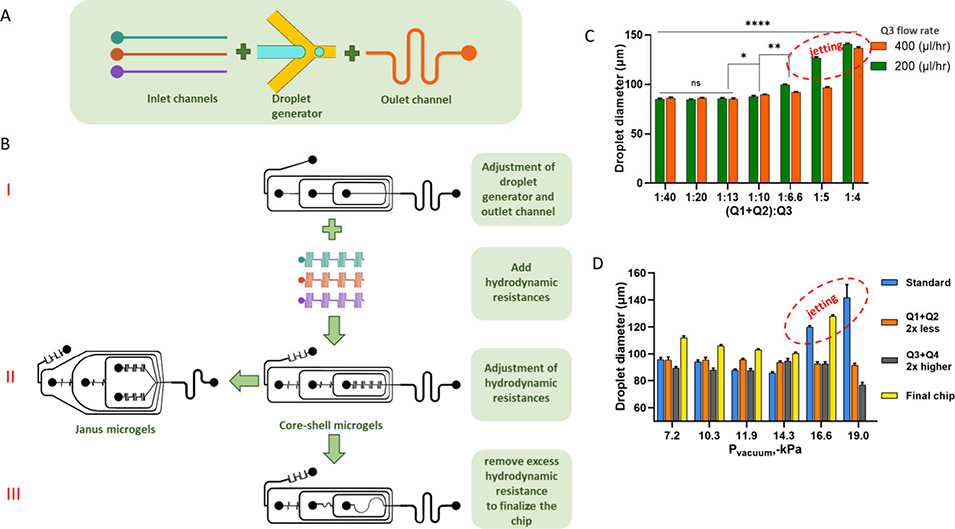
图2 基于出口储液器负压引液的微流控液滴发生器开发过程
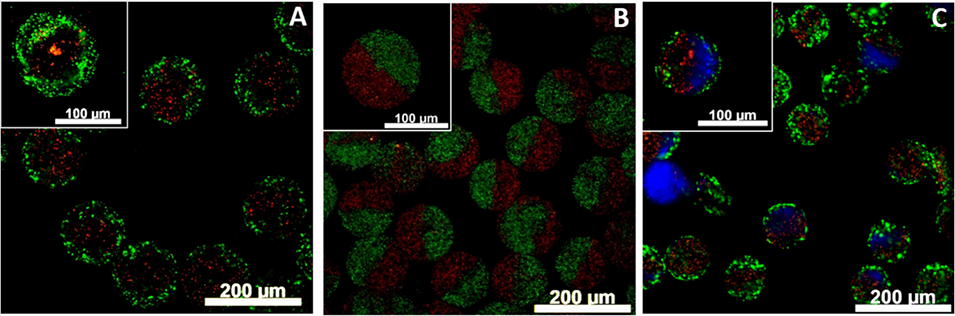
图3 多隔室海藻酸盐微凝胶的共聚焦荧光显微镜图像。A - 核壳型;B- Janus型;C - 核壳Janus复合型。为便于观察,在海藻酸盐相中添加了直径为0.5μm的绿色、红色和蓝色荧光聚苯乙烯微粒。
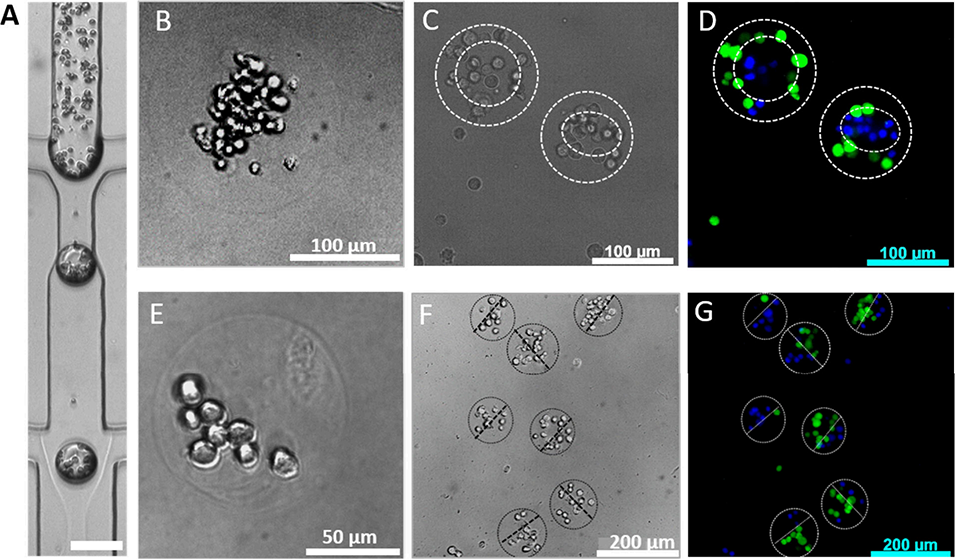
图4 含活CT26细胞的核壳型与Janus型海藻酸盐微凝胶的制备
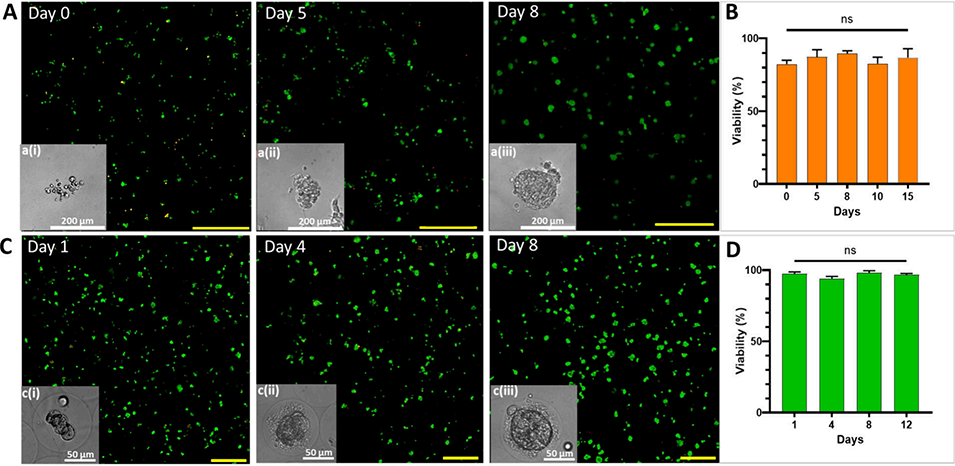
图5 海藻酸盐微凝胶内CT26-eGFP细胞与HepG2细胞的存活率
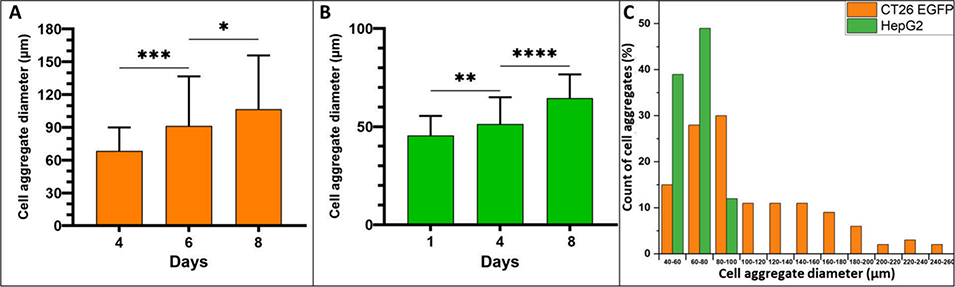
图6 CT26-eGFP细胞与HepG2细胞聚集体的生长动态
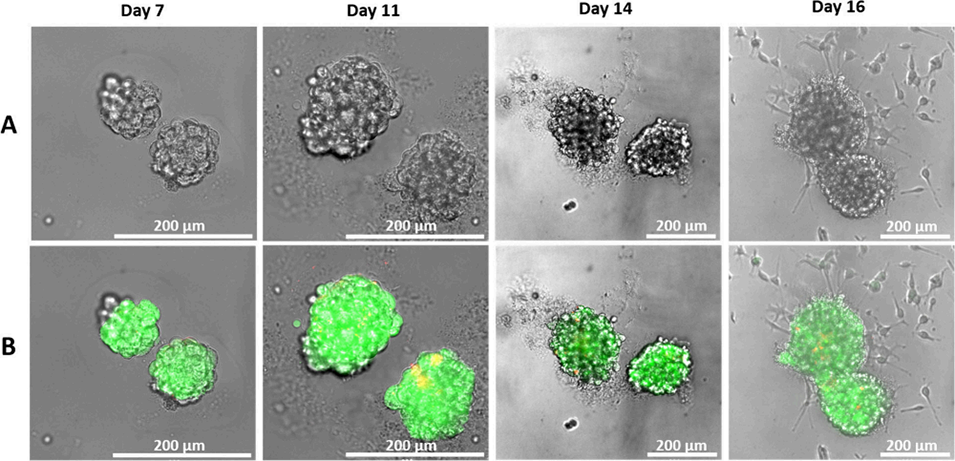
图7 两个相邻海藻酸盐微球内CT26-eGFP细胞聚集体的体外发育过程
论文链接:https://doi.org/10.1021/acsbiomaterials.5c01427
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














