人体肠道作为营养吸收、药物代谢及抵御病原体的关键器官,其体外模型在药物研发、传染病机制研究中具有不可替代的作用。传统2D单层细胞培养模型无法模拟肠道组织的3D微环境及细胞间、细胞-基质相互作用,功能代表性有限;现有3D肠道球体模型则存在成熟周期长、细胞极化随机、核心易出现坏死区等缺陷,影响模型可靠性。

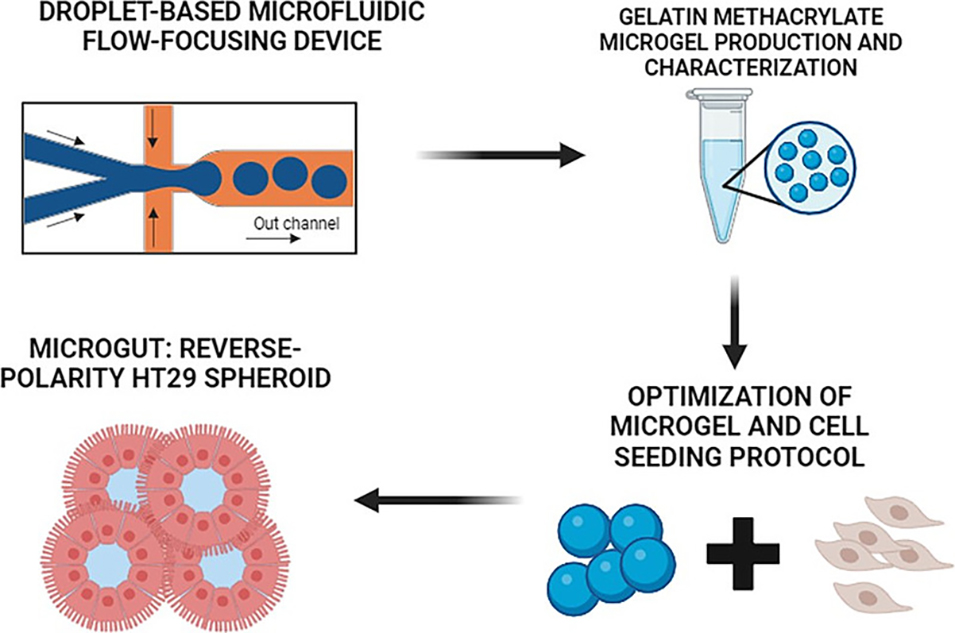
近期,有研究人员借助液滴微流控技术制备出尺寸均一的甲基丙烯酰化明胶(GelMa)微凝胶,以其模拟肠道绒毛凸面结构作为支架培养HT29细胞,成功构建出名为“microgut”的反向极性球状体模型。该模型不仅细胞存活率高、成熟周期短,还具备更完善的肠道屏障功能,为药物研发和传染病研究提供了有力工具。相关研究以“Microfluidic-based gelatin methacrylate microgel as a scaffold to create reverse-polarity HT29 spheroids”为题目,发表在期刊《International Journal of Biological Macromolecules》上。
本文要点:
1、该研究聚焦于构建新型体外肠道模型,以甲基丙烯酰化明胶(GelMa)为材料,借助流动聚焦微流控技术制备微凝胶支架,用于培养HT29细胞形成反向极性球体(即“微肠道”)。
2、研究首先合成了不同浓度(7%、10%、20%w/v)的GelMa,通过核磁共振、流变学测试等表征其甲基丙烯酰化程度与力学性能,发现浓度越高凝胶刚度越大,7%GelMa(μGelMa7)为软凝胶,更适合细胞生长。
3、随后优化微流控参数,制备出尺寸均一(约80μm)的GelMa微凝胶,将HT29细胞以1:500的微凝胶-细胞比例接种培养,7天后细胞存活率达95%左右。
4、免疫染色结果显示,μGelMa7表面的HT29细胞受微凝胶凸面曲率和力学特性影响,呈现反向极性——细胞核朝向凝胶,顶端膜暴露于培养基,且紧密连接表达更高;而较硬的10%GelMa(μGelMa10)上细胞极化效果不佳。
5、该“微肠道”模型克服了传统2D培养功能不全、3D球体成熟时间长等缺陷,能模拟肠道上皮的基本生理功能,在药物吸收与毒性评估、传染病研究等领域具有广阔应用前景。
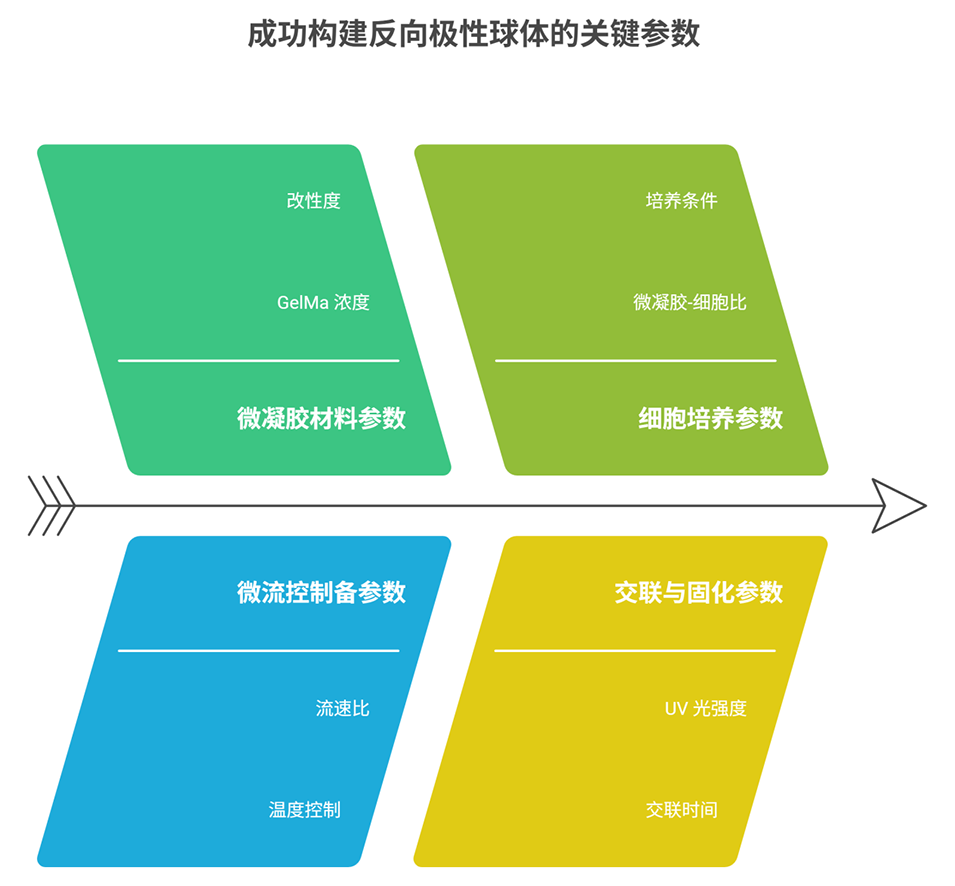
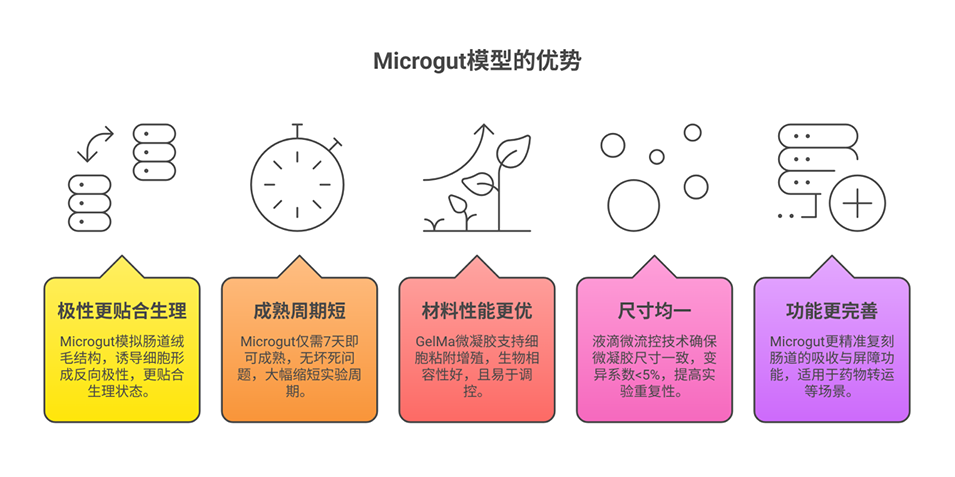
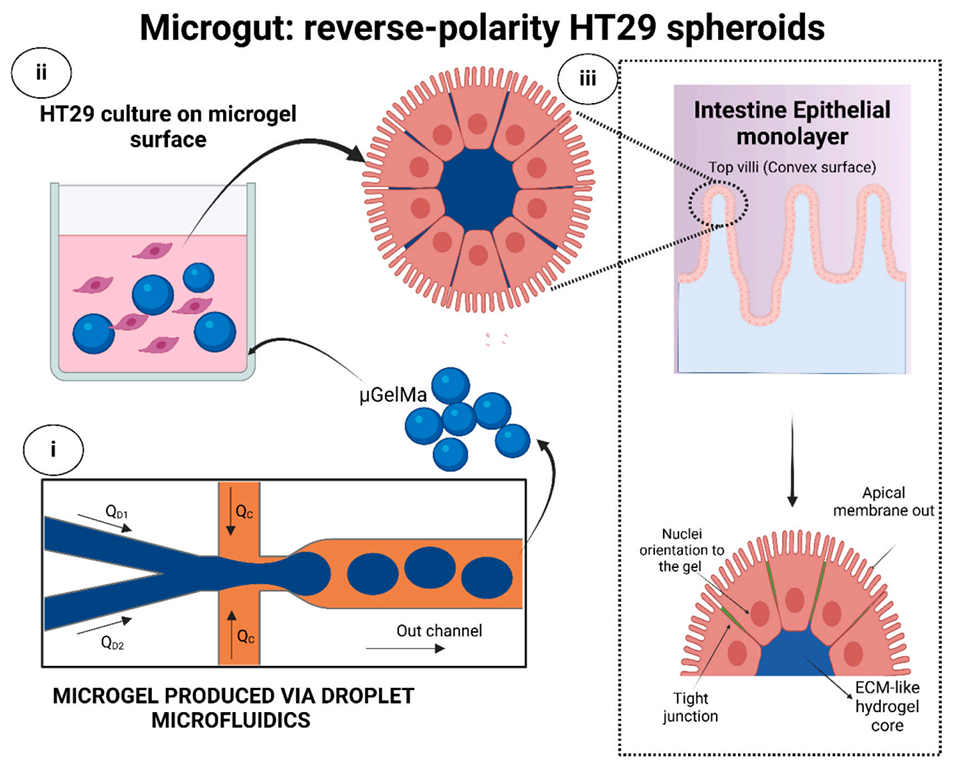
图1:微肠(反向极性 HT29 球体)的主要制备流程及特征示意图:i)通过液滴微流控技术制备甲基丙烯酰化明胶微凝胶(μGelMa);ii)在 μGelMa 表面培养 HT29 细胞以获得微肠;iii)微肠的表征。
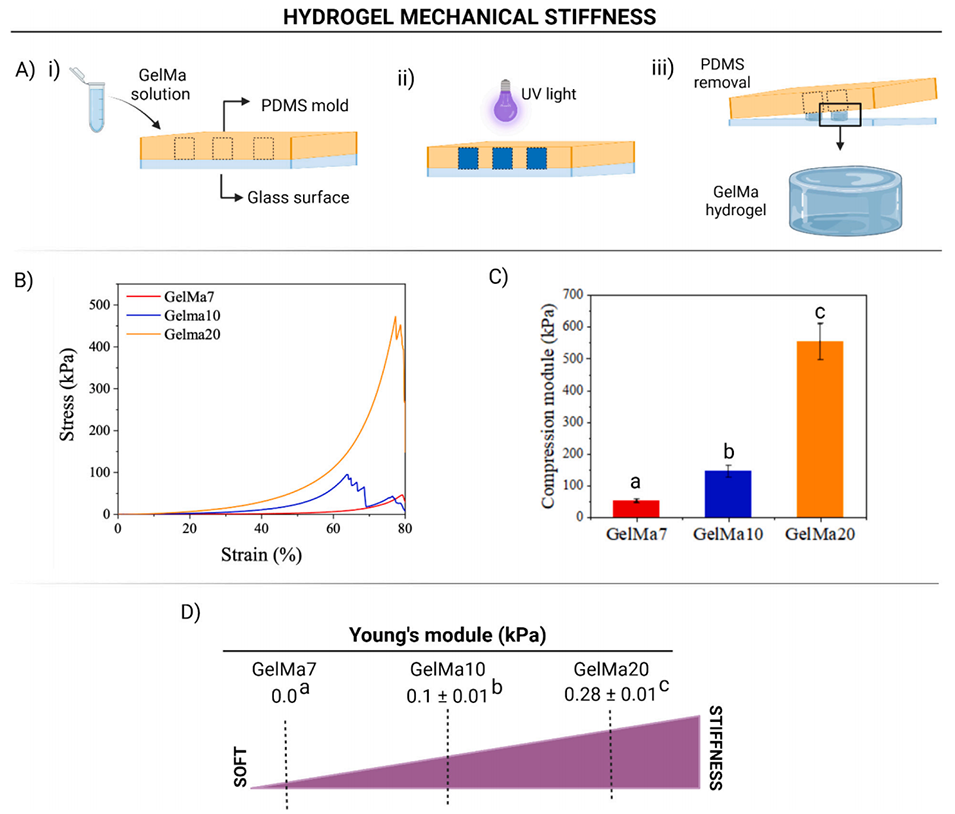
图2:甲基丙烯酰化明胶水凝胶的力学刚度:A)用于质构仪压缩测试的 PDMS 模具水凝胶制备示意图;B)压缩应力-应变特性分析;C)甲基丙烯酰化明胶水凝胶的压缩模量;D)甲基丙烯酰化明胶水凝胶的杨氏模量及软硬特性示意图。小写字母表示 Tukey 检验结果,p<0.05。
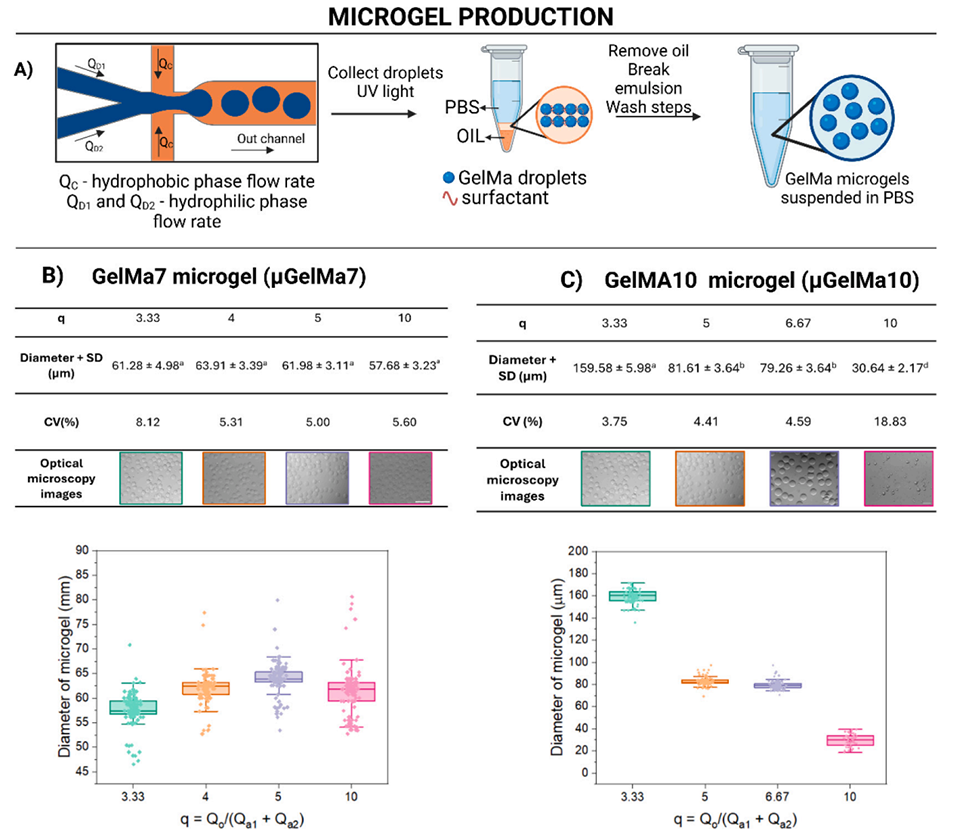
图3:甲基丙烯酰化明胶微凝胶的制备:A)流动聚焦型微流控装置的液滴生成示意图,其中 Qo 为疏水相流速,Qa1 和 Qa2 为亲水(水)相流速;B)流速比(q=Qo/(Qa1+Qa2))与微凝胶直径的关系:i)7% 浓度甲基丙烯酰化明胶微凝胶(μGelMa7);ii)10% 浓度甲基丙烯酰化明胶微凝胶(μGelMa10)(n=100 个微凝胶)。小写字母表示 Tukey 检验结果,p<0.05。比例尺:100 μm。所有数据均以三次独立重复实验的平均值 ± 标准差表示(n=3)。
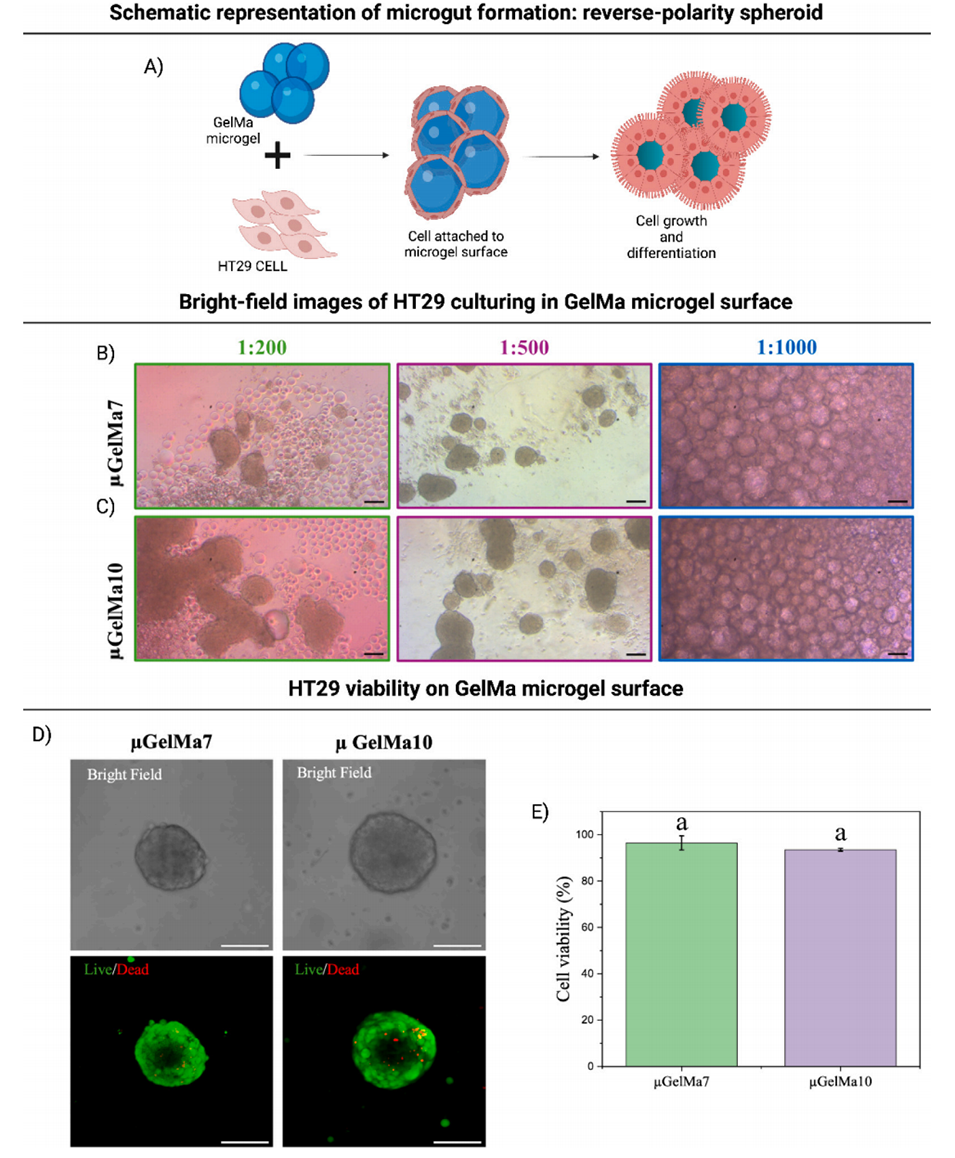
图4:A)反向极性 HT29 球体(即微肠)的制备示意图;B)不同细胞密度下 HT29 在 μGelMa7 表面培养的明场图像;C)不同细胞密度下 HT29 在 μGelMa10 表面培养的明场图像;D)培养 7 天后微肠的 Z 轴投影图,含明场图像及活死染色结果。比例尺:100 μm;E)甲基丙烯酰化明胶微凝胶周围 HT29 细胞的存活率定量分析。结果无显著差异,小写字母表示 Tukey 检验结果,p<0.05。
论文链接:https://doi.org/10.1016/j.ijbiomac.2025.140824
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














