药物心脏毒性研究亟需能够模拟真实心脏复杂微环境的体外模型。传统2D细胞培养无法再现心脏的三维结构与细胞间相互作用,而动物模型则存在成本高、通量低和种属差异大等问题。现有的一些3D心脏模型虽然在结构上有所改进,但往往操作繁琐,且普遍缺乏高通量代谢物分析能力,更重要的是,它们大多未能有效模拟药物从心内膜到心肌层的递送屏障这一关键生理路径。

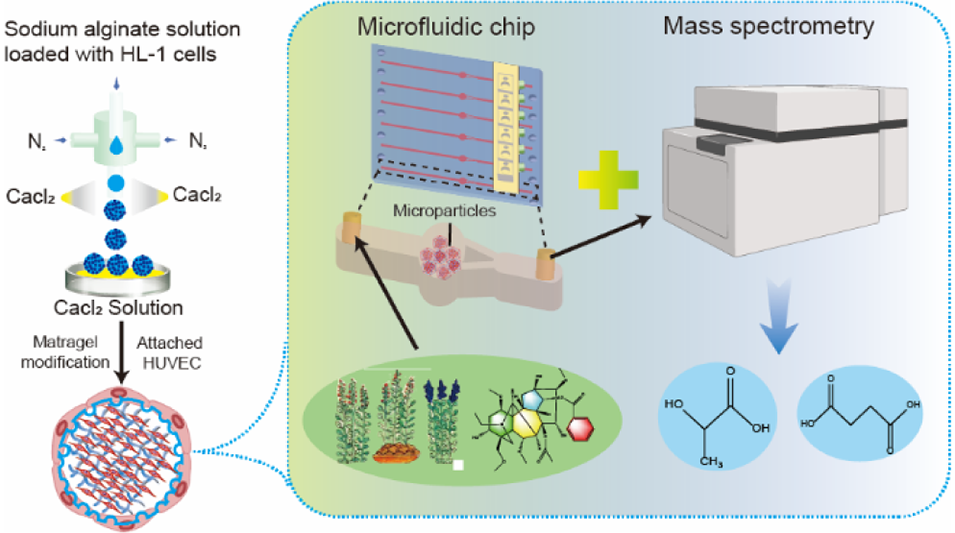
近期,清华大学林金明教授、吴增楠博士与成都中医药大学张艺教授等人合作,成功开发了一种仿生心脏微颗粒模型,该模型通过整合心内膜与心肌结构和功能,并结合微流控芯片-质谱联用技术,实现了对药物心脏毒性的实时动态评估。该工作揭示了乌头碱与藏药铁棒锤(TBC)的心脏毒性机制及TBC炮制减毒原理,为中药安全性评价提供了新的技术平台。相关研究以“Biomimetic Microparticles with Myocardial and Endocardial Integration for Drug Toxicity Studies”为题目,发表于期刊《Analytical Chemistry》。
本文要点:
1、本研究开发了一种模拟心内膜与心肌结构和功能的心脏水凝胶微粒模型。
2、通过定制微流控装置制备表面粗糙、包裹心肌细胞的水凝胶微粒,并经基质胶修饰促进内皮细胞黏附连接,形成致密内皮层。
3、结合微流控芯片-质谱实时分析系统,该模型可用于检测药物心脏毒性。
4、研究发现,乌头碱与铁棒锤的毒性导致乳酸和琥珀酸水平升高,而经炮制处理后毒性显著降低,代谢物水平回落。该仿生微粒模型为实时代谢分析与心脏毒性研究提供了新平台。
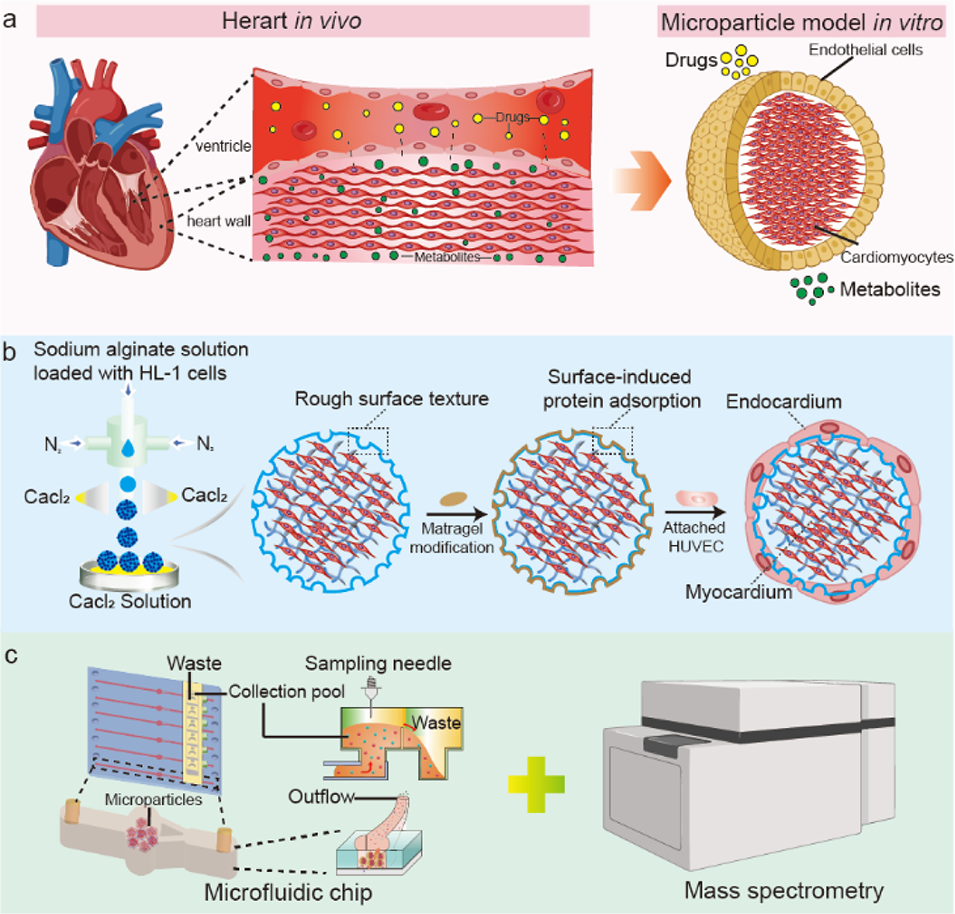
图1. 模拟心内膜-心肌的三维心脏微球设计(a)心脏内药物递送与代谢示意图;(b)心脏微球模型构建示意图;(c)用于心脏微球代谢物分析的微流控芯片-质谱联用系统工作原理
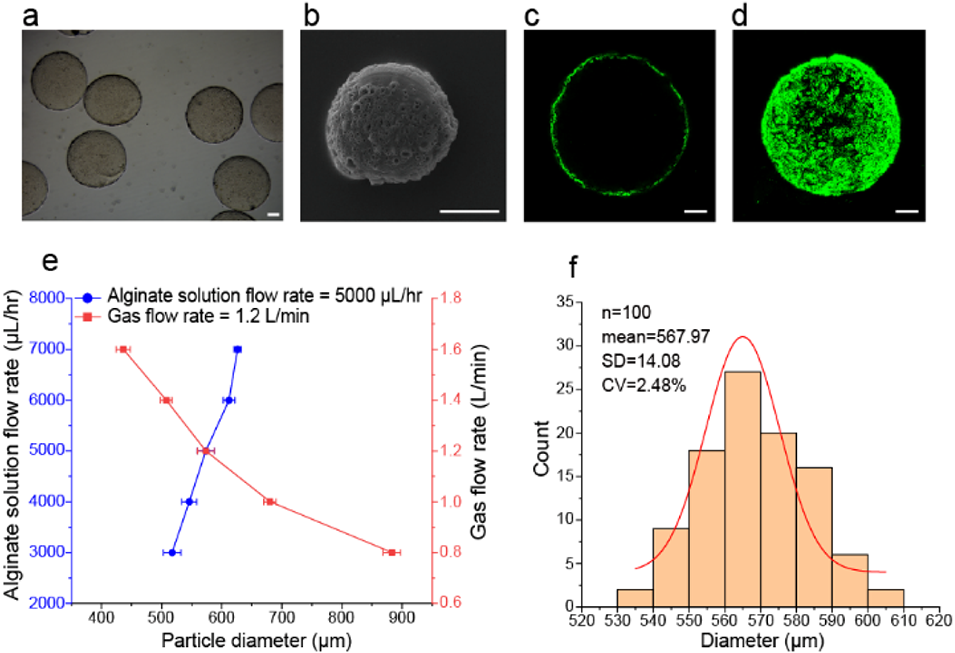
图2. 粗糙海藻酸钠微球的制备。(a)粗糙微球的明场图像;(b)微球形貌的SEM图像;(c、d)异硫氰酸荧光素(FITC)标记基质胶修饰粗糙微球表面的二维和三维荧光图像;(e)微球尺寸的可控调节;(f)对应(a)中微球的尺寸分布。数据以平均值±标准差表示,n=100。比例尺:100μm
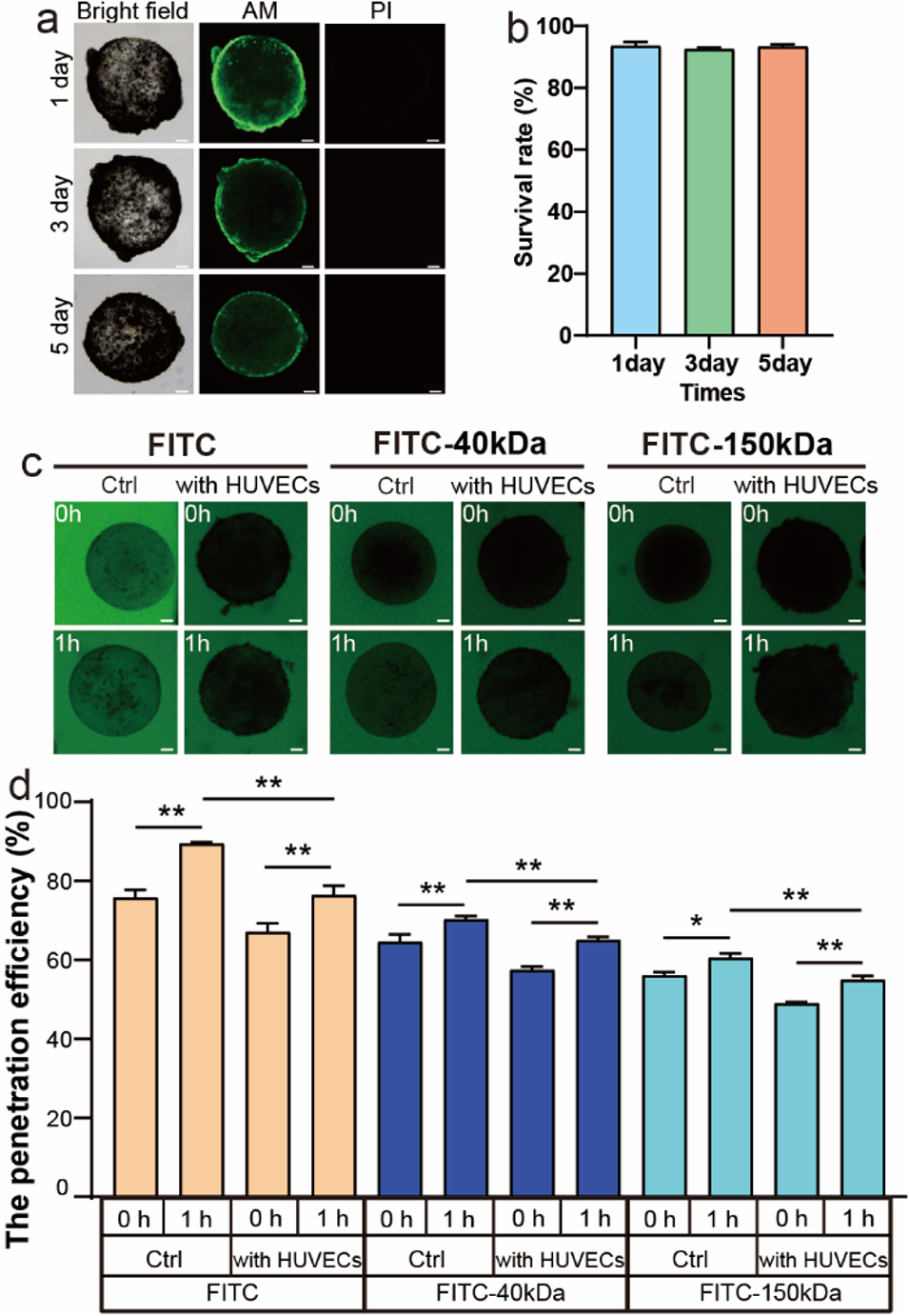
图3. 心脏微球的细胞活性与内皮屏障功能验证。(a)5天内微球中细胞活力的荧光成像;(b)5天内微球的细胞存活率。数据以平均值±标准差表示,n=3;(c)微球内皮屏障通透性评估——异硫氰酸荧光素(FITC)、40kDa及150kDa FITC标记葡聚糖向有无内皮细胞单层的微球内扩散的延时荧光图像;(d)有无内皮细胞单层的微球渗透效率(渗透效率=微球内部与周围示踪剂荧光强度比值)。数据以平均值±标准差表示,n=5。*p<0.05,**p<0.01。比例尺:100μm
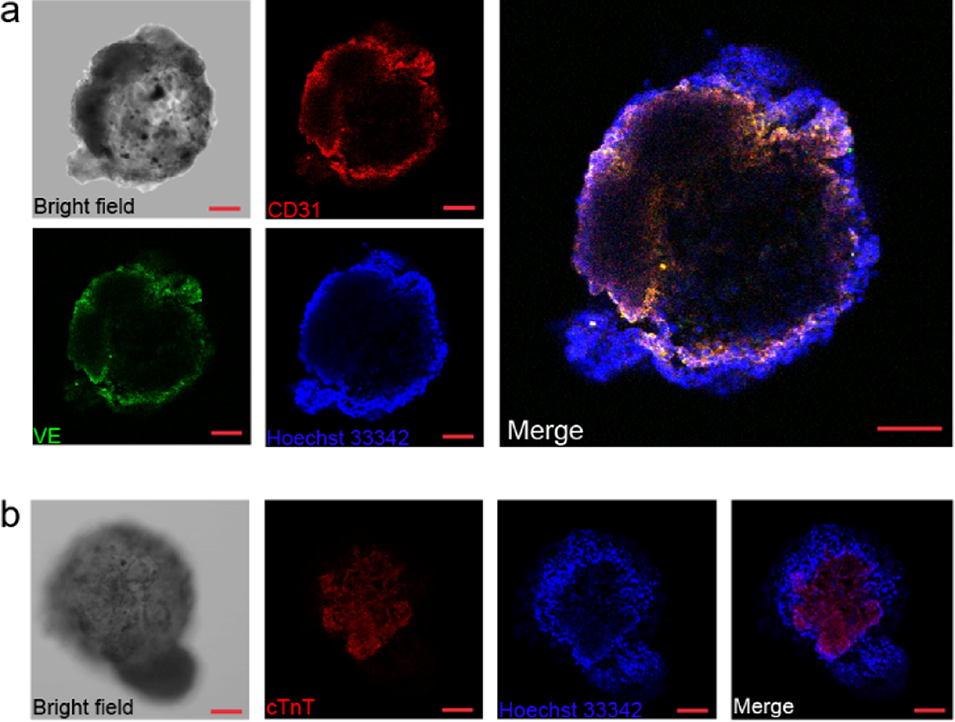
图4. 心脏微球的细胞功能验证。(a)微球模型中CD31标志物/VE-钙黏蛋白/细胞核的共聚焦图像及明场图像;(b)微球模型中心肌肌钙蛋白(cTnT)标志物/细胞核的共聚焦图像及明场图像
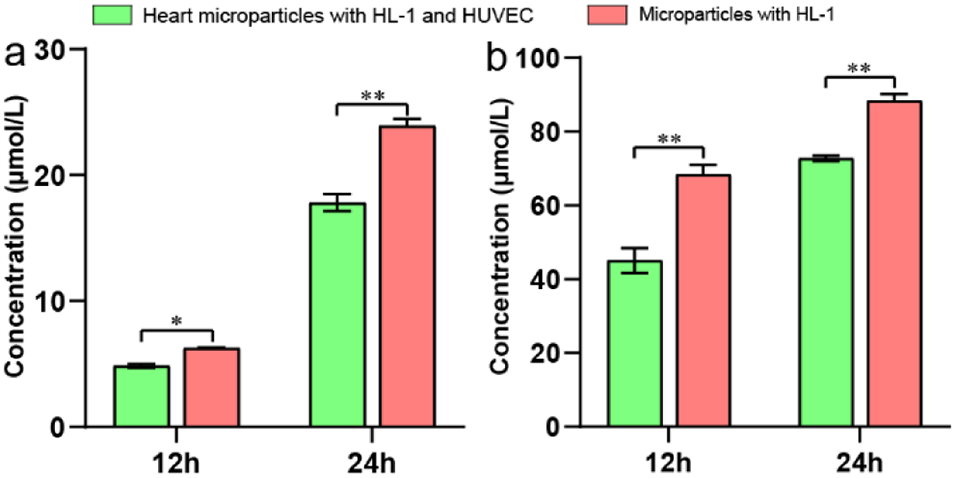
图5. 心脏微球上乌头碱代谢物的定量分析。两种微球中乌头原碱(a)和苯甲酰乌头原碱(b)的含量。n=3。*p<0.05,**p<0.01
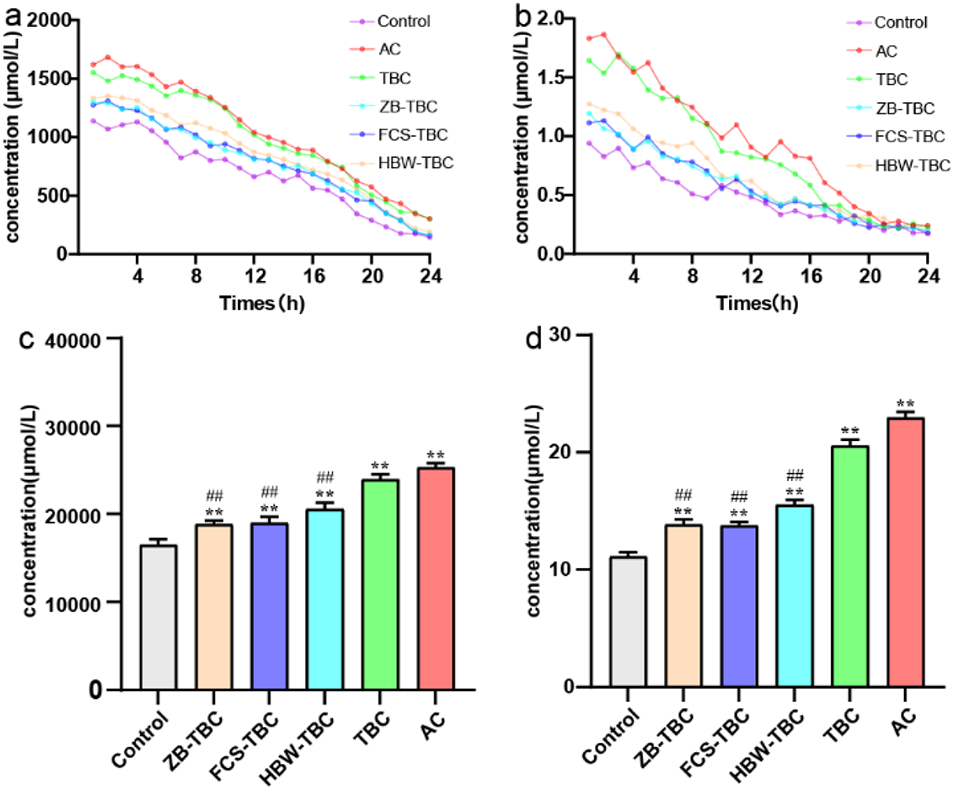
图6. 基于芯片-质谱(Chip-MS)的乳酸和琥珀酸检测动态变化。(a)24小时内乳酸的实时定量分析;(b)24小时内琥珀酸的实时定量分析;(c、d)24小时内乳酸和琥珀酸的总浓度分析。n=3。与对照组比较,**p<0.01;与铁棒锤(TBC)组比较,##p<0.01
论文链接:https://doi.org/10.1021/acs.analchem.5c00672
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














