骨肉瘤是常见原发性恶性骨肿瘤,严重威胁青少年健康,当前手术结合放化疗的治疗方案下,仍有20%-40%患者出现肿瘤复发与转移。免疫治疗虽在黑色素瘤、肺癌等“热肿瘤”中效果显著,但逆转骨肉瘤免疫抑制微环境仍面临挑战。PROTAC技术可靶向降解PD-L1以“恢复”T细胞功能,却难在“冷肿瘤”中全面激活抗肿瘤免疫;光免疫疗法虽为新型抗癌手段,纳米载体可提升药物递送效率,但MOFs存在载药量低的问题,且纳米颗粒全身给药肿瘤蓄积少、可能引发细胞因子风暴,瘤内注射又易扩散渗漏,因此亟需研发兼具靶向性、高效性与安全性的新型治疗策略以攻克上述难题。

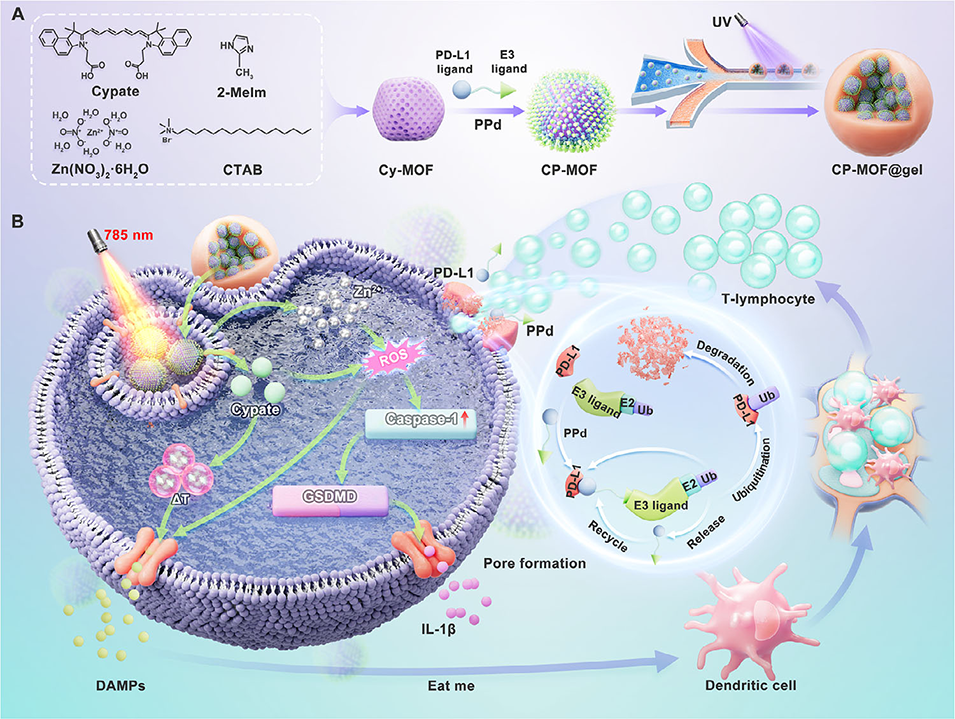
近期,嘉兴市第二医院院长陈刚教授、季康副主任医师与中心实验室罗欢欢研究员、Yi Li等人开发了一种基于PROTAC策略的功能化光免疫水凝胶微球(CP-MOF@gel),通过“由内而外”的双重机制——即诱导肿瘤细胞焦亡并精准降解PD-L1蛋白,显著激活抗肿瘤免疫,在骨肉瘤模型中实现高效肿瘤抑制。相关研究以“Functionalized Photoimmune Hydrogel Microspheres for Inside-Out Eradication of Osteosarcoma via a PD-L1 PROTAC Strategy”为题,发表在期刊《Advanced Healthcare Materials》上。
本文要点:
1、针对骨肉瘤免疫抑制微环境难以逆转的挑战,本研究开发了一种功能化光免疫水凝胶微球CP-MOF@gel。
2、该系统以无定型ZIF-8为壳层,封装光敏剂Cypate和PROTAC(靶向蛋白降解嵌合体)分子ppd,形成核壳结构纳米粒,并通过微流控与光固化技术制备成微球。
3、CP-MOF@gel在肿瘤内可长效释放CP-MOF纳米粒,部分被细胞内化后,在785 nm激光照射下产生活性氧并引发光热效应,通过caspase-1/GSDMD通路诱导细胞焦亡,释放损伤相关分子模式,激活抗肿瘤免疫。
4、同时,胞外CP-MOF通过ppd精准降解PD-L1蛋白,解除免疫抑制,增强T细胞介导的肿瘤杀伤。
5、体内实验证实该体系具有良好的肿瘤滞留能力与协同治疗效果,为骨肉瘤的“由内而外”免疫治疗提供了新策略。
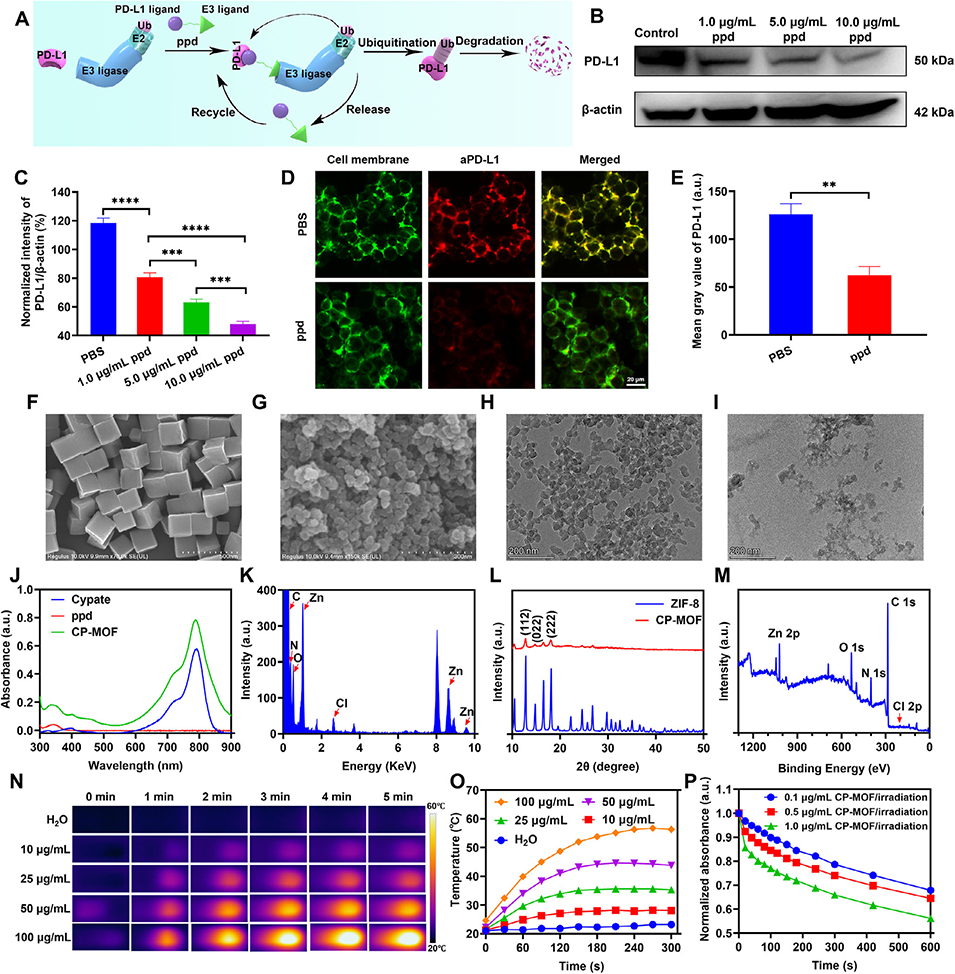
图1. PD-L1的精准降解及CP-MOF的表征
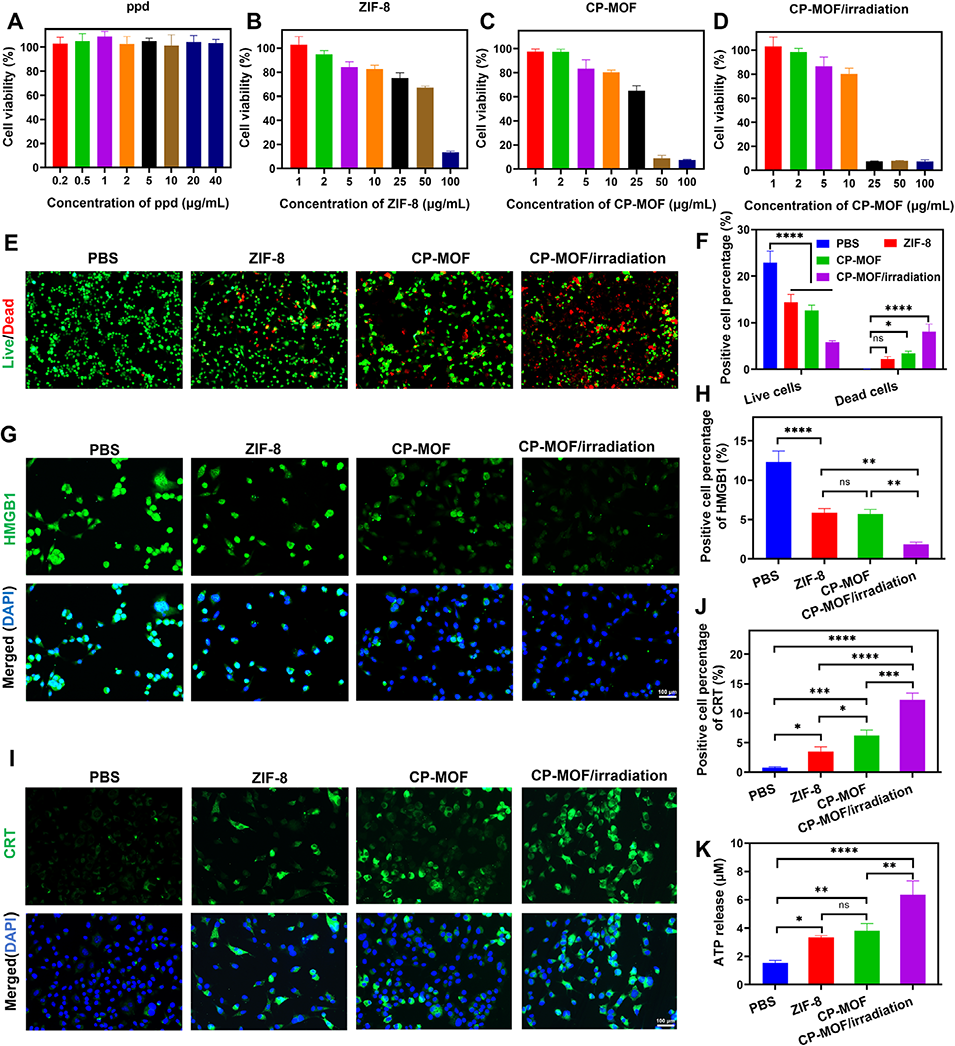
图2. 体外细胞毒性及损伤相关分子模式释放行为
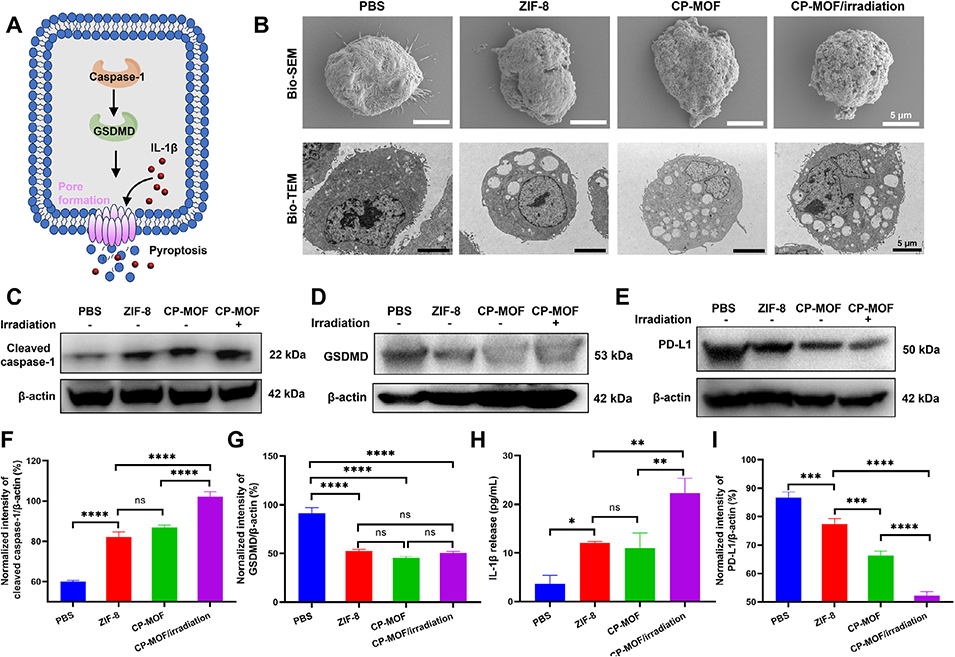
图3. 细胞焦亡机制及蛋白质印迹分析
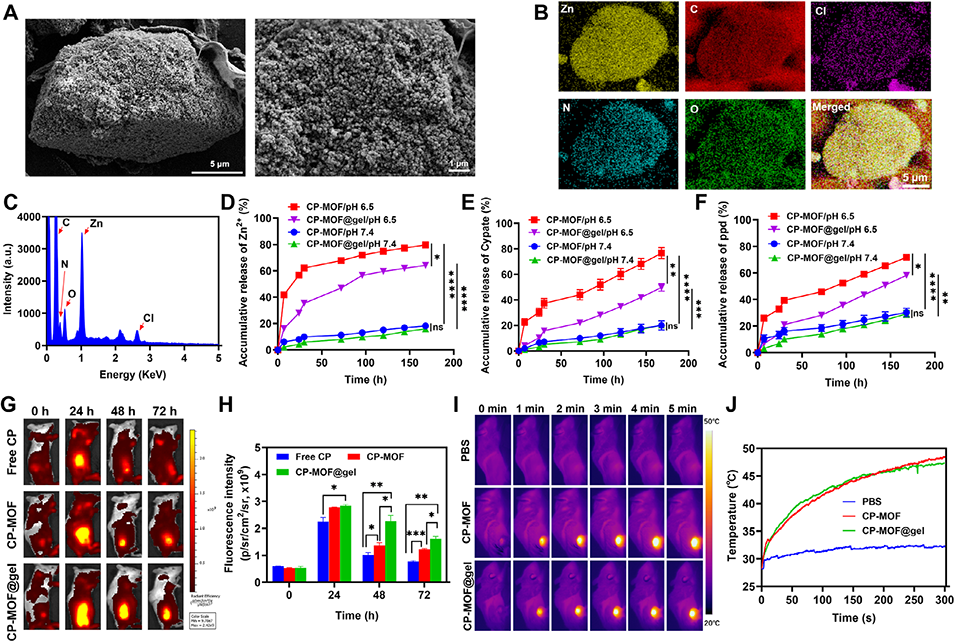
图4. CP-MOF@gel的表征、释放行为及体内性能
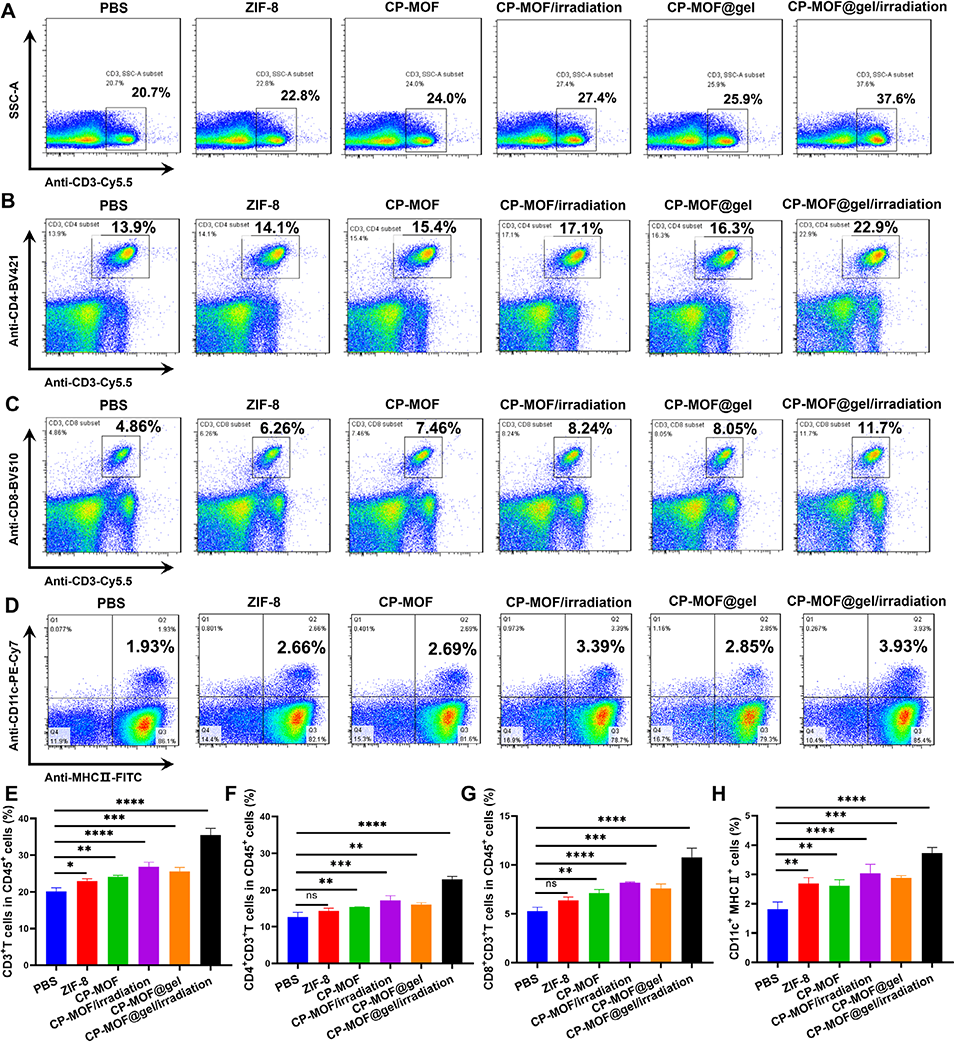
图5. 体内免疫激活效果
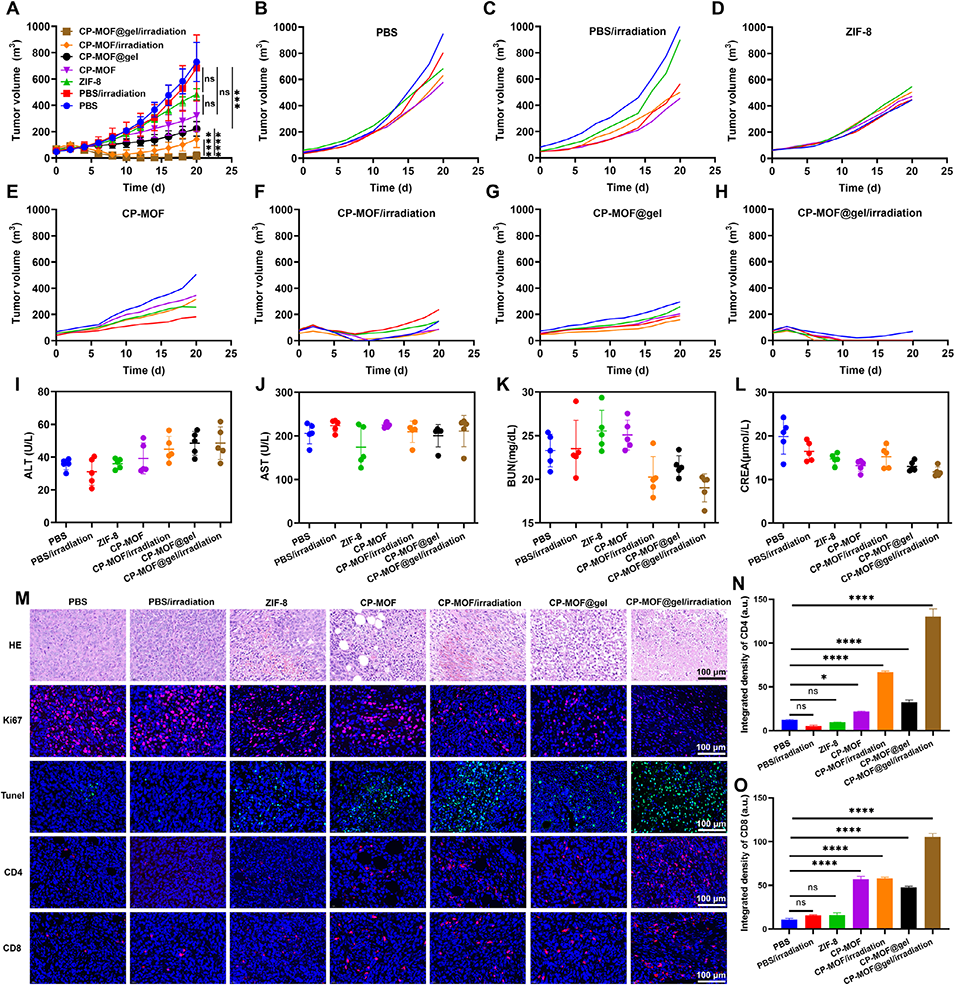
图6. CP-MOF@gel的体内抗肿瘤疗效
论文链接:https://doi.org/10.1002/adhm.202503988
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














