
导读:
当前Ti-6Al-4V骨植入体缺乏天然骨小梁结构和促血管生成信号,限制了修复效果。为此,南方医科大学吴耀彬副教授、黄文华教授、胡孔和博士以及暨南大学利时雨副教授等人创新性地将3D打印的仿生骨小梁支架与负载“缺氧外泌体”的水凝胶微球相结合,构建了一种双重仿生骨修复材料。该材料不仅成功模拟了天然骨的力学性能以避免应力屏蔽,还能持续释放生物活性信号,在动物实验中显著促进了成骨与血管生成。相关研究以“3D-Printed Titanium Trabecular Scaffolds with Sustained Release of Hypoxia-Induced Exosomes for Dual-Mimetic Bone Regeneration”为题目,发表于期刊《Advanced Science》。
本文要点:
1、本研究提出一种双重仿生策略,通过Voronoi 算法和成像数据设计,利用选择性激光熔化(SLM)3D 打印技术制备出仿生小梁多孔Ti-6Al-4V支架(BTPS),其弹性模量约为3.2 GPa、渗透率达11.52×10-8 mm²,可模拟天然骨的几何结构与力学性能。
2、同时,采用微流控技术将缺氧诱导的人脐静脉内皮细胞(HUVEC)来源外泌体(HExo)包封于PEGDA/GelMA水凝胶微球(PGHExo)中实现缓释,并通过聚多巴胺(pDA)修饰将其锚定于BTPS表面形成BTPS&pDA@PGHExo复合支架。
3、体外实验表明该支架显著促进成骨与血管生成,mRNA测序显示其通过激活MAPK、mTOR、HIF-1、VEGF等通路调控相关基因表达;兔体内实验证实其可提升骨体积、密度及新生血管形成,为大段骨缺损修复提供了具有临床潜力的个性化解决方案。

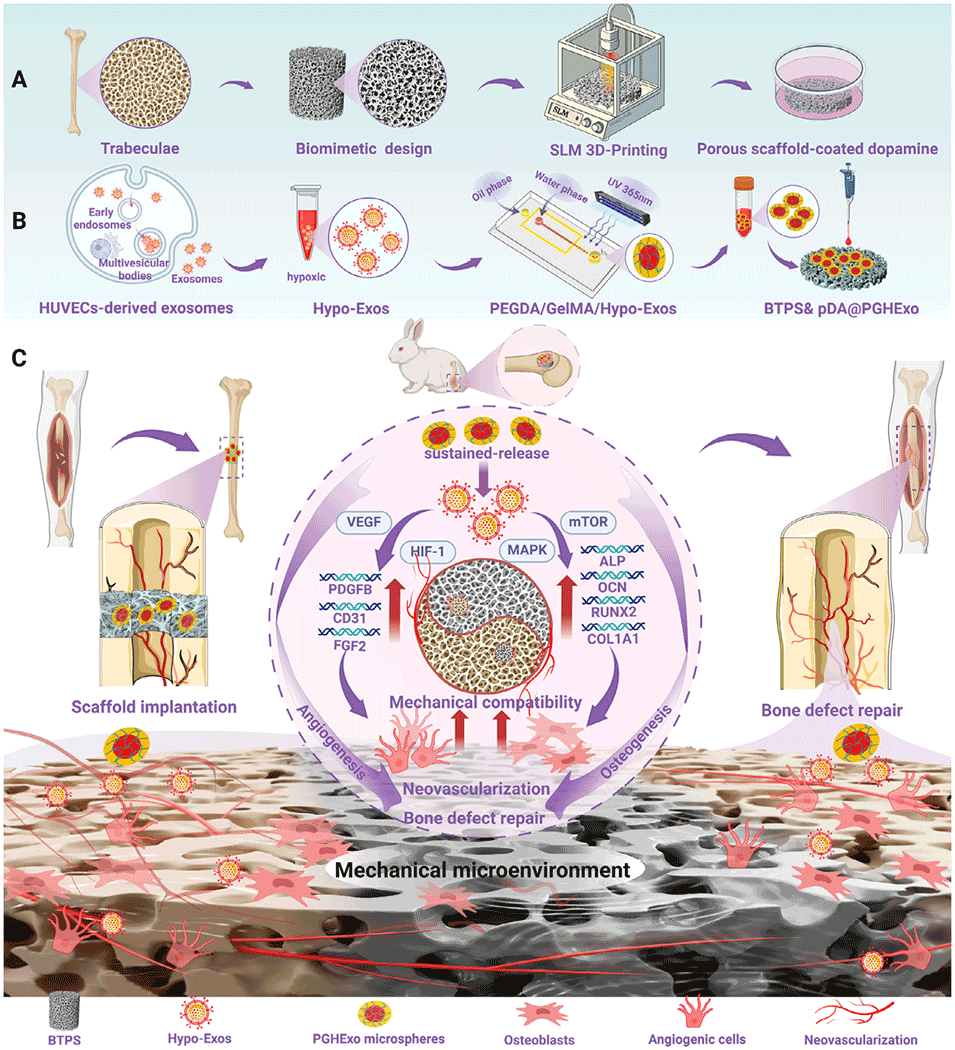
图1:用于大段骨缺损修复的BTPS&pDA@PGHExo支架制备流程及治疗机制示意图
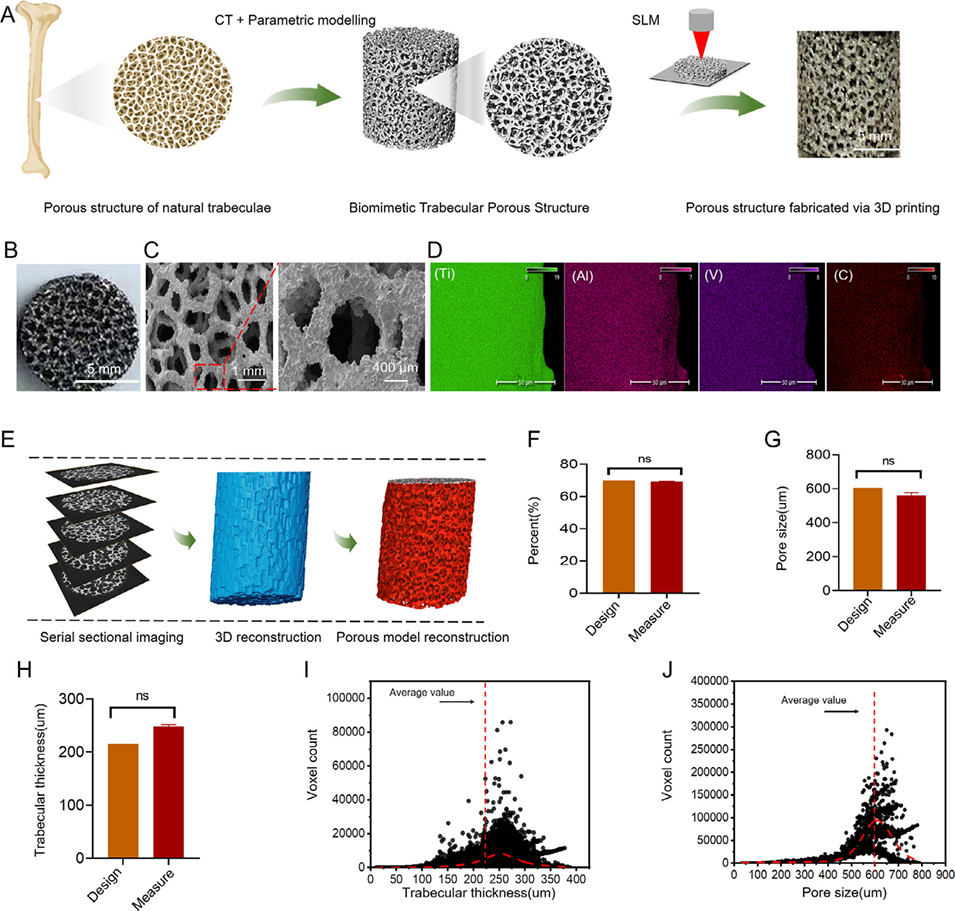
图2:仿生小梁多孔支架(BTPS)的表征及元素映射分析
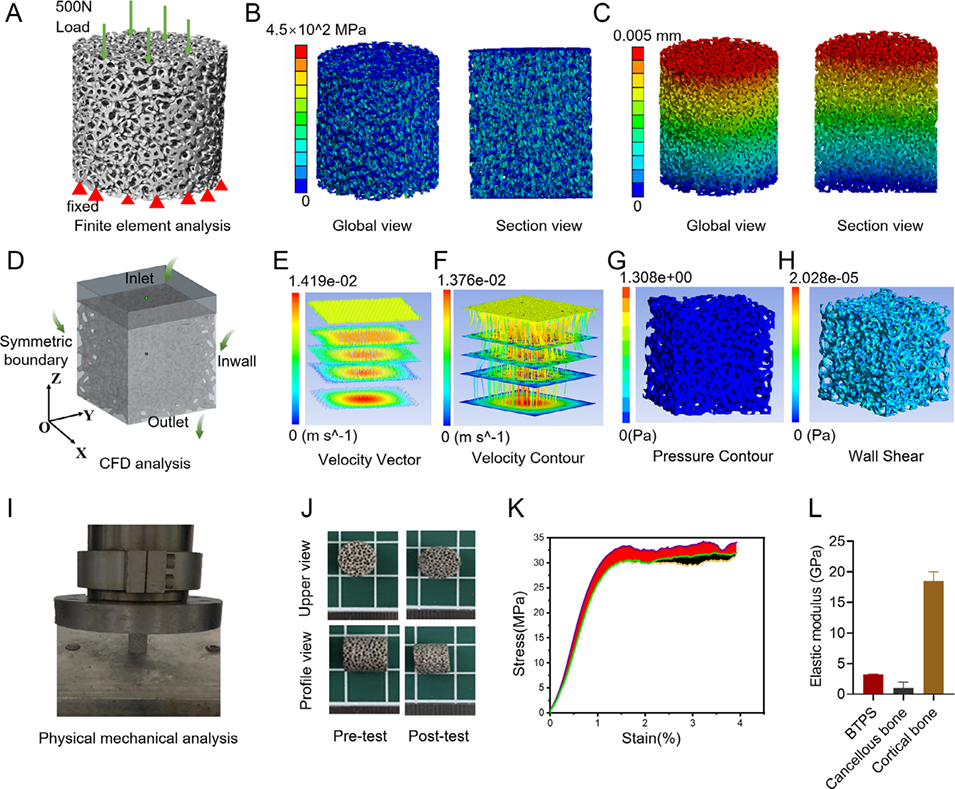
图3:BTPS的力学表征、有限元分析及流体动力学分析
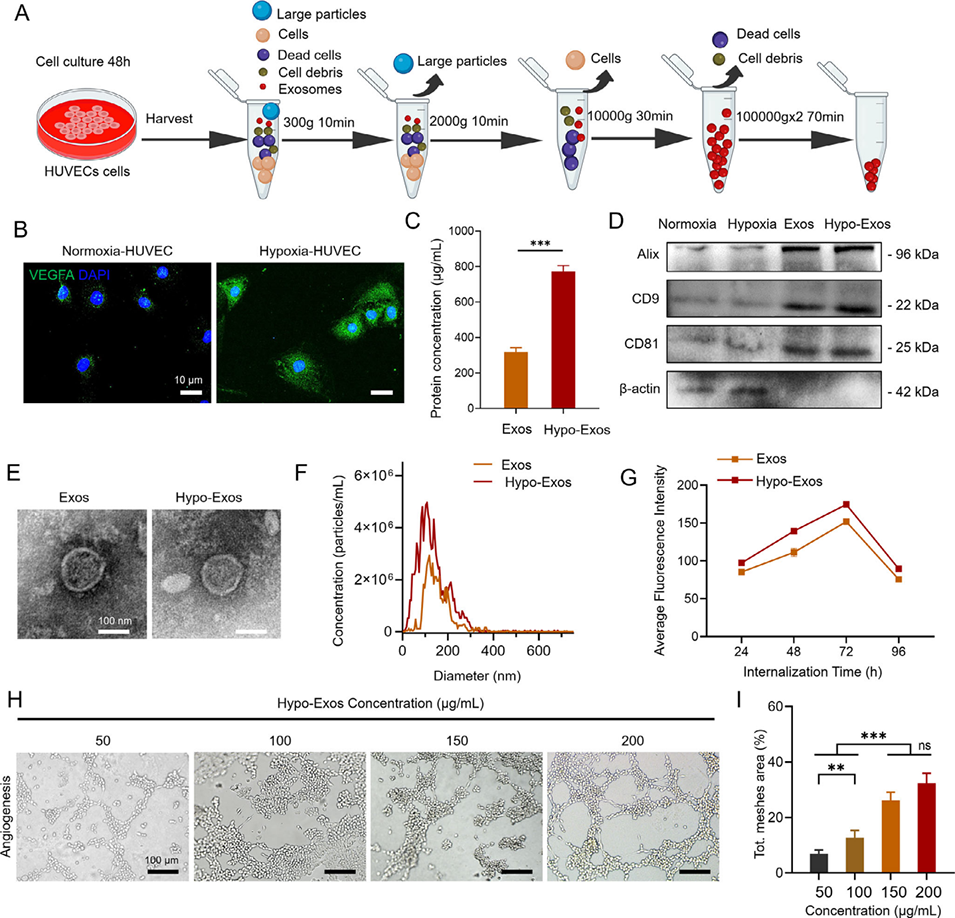
图4:人脐静脉内皮细胞(HUVEC)来源外泌体的分离、表征及生物活性评价
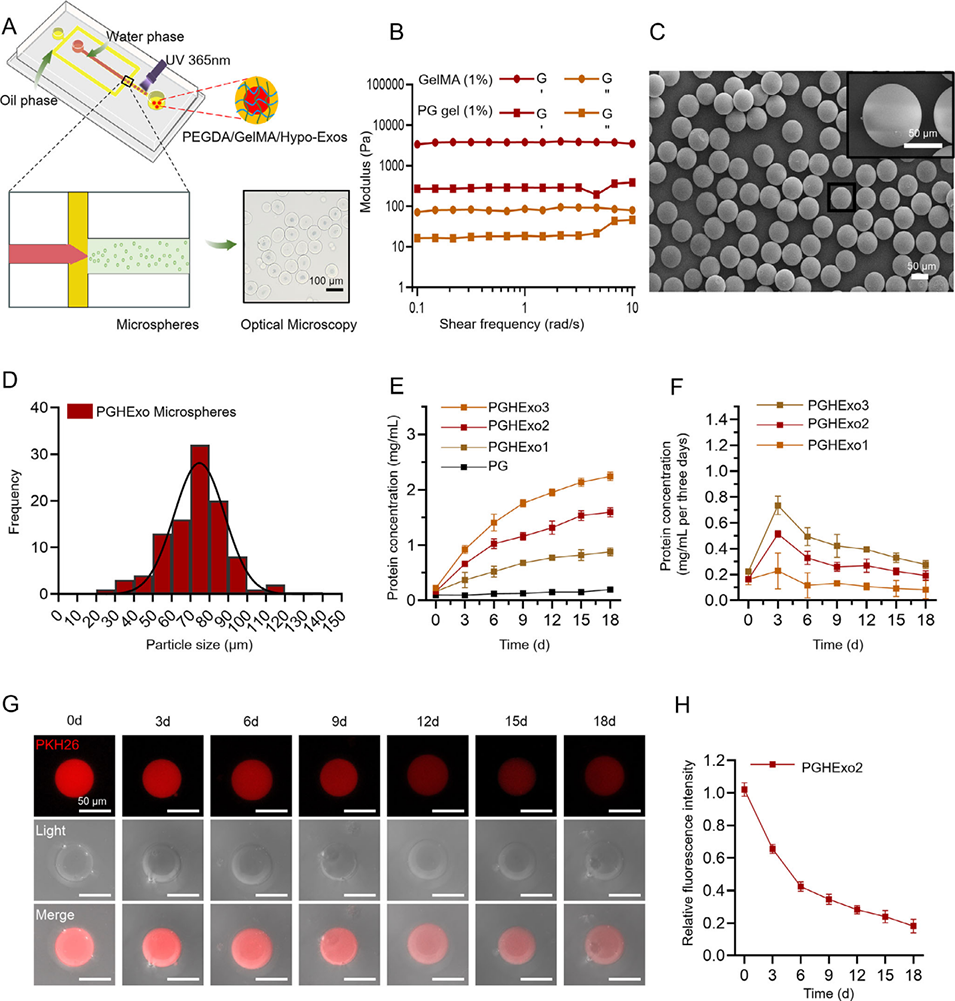
图5:负载缺氧诱导外泌体(Hypo-Exos)的PEGDA/GelMA双网络水凝胶缓释微球的制备、表征及释放曲线

图6:BTPS&pDA@PGHExo复合支架的构建、表征及功能评估
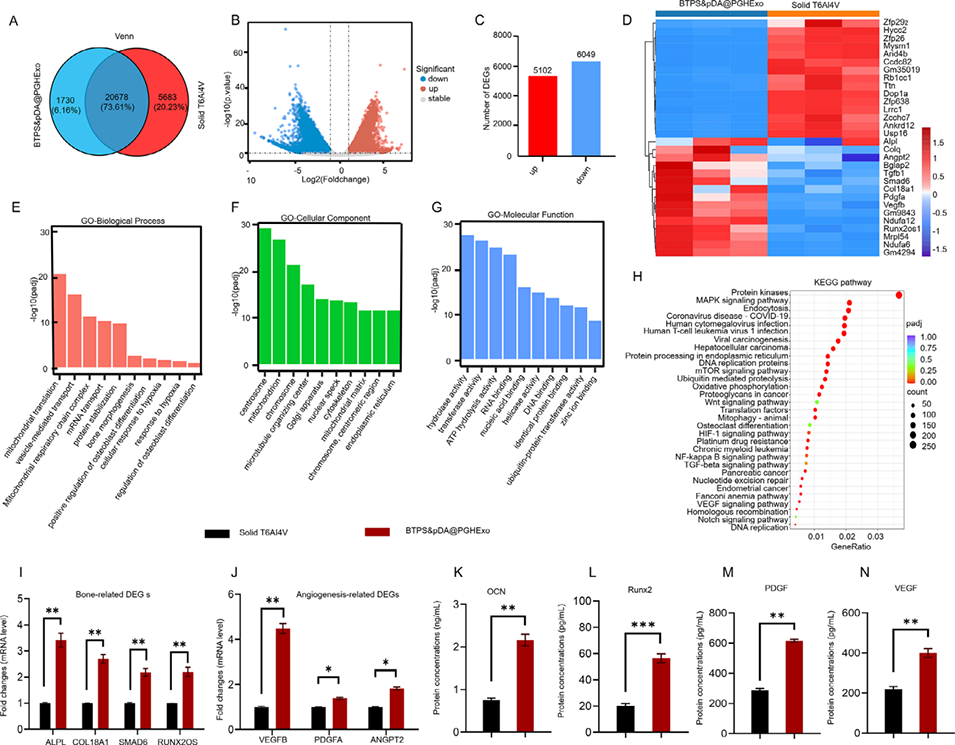
图7:基因表达的mRNA测序(mRNA-seq)分析
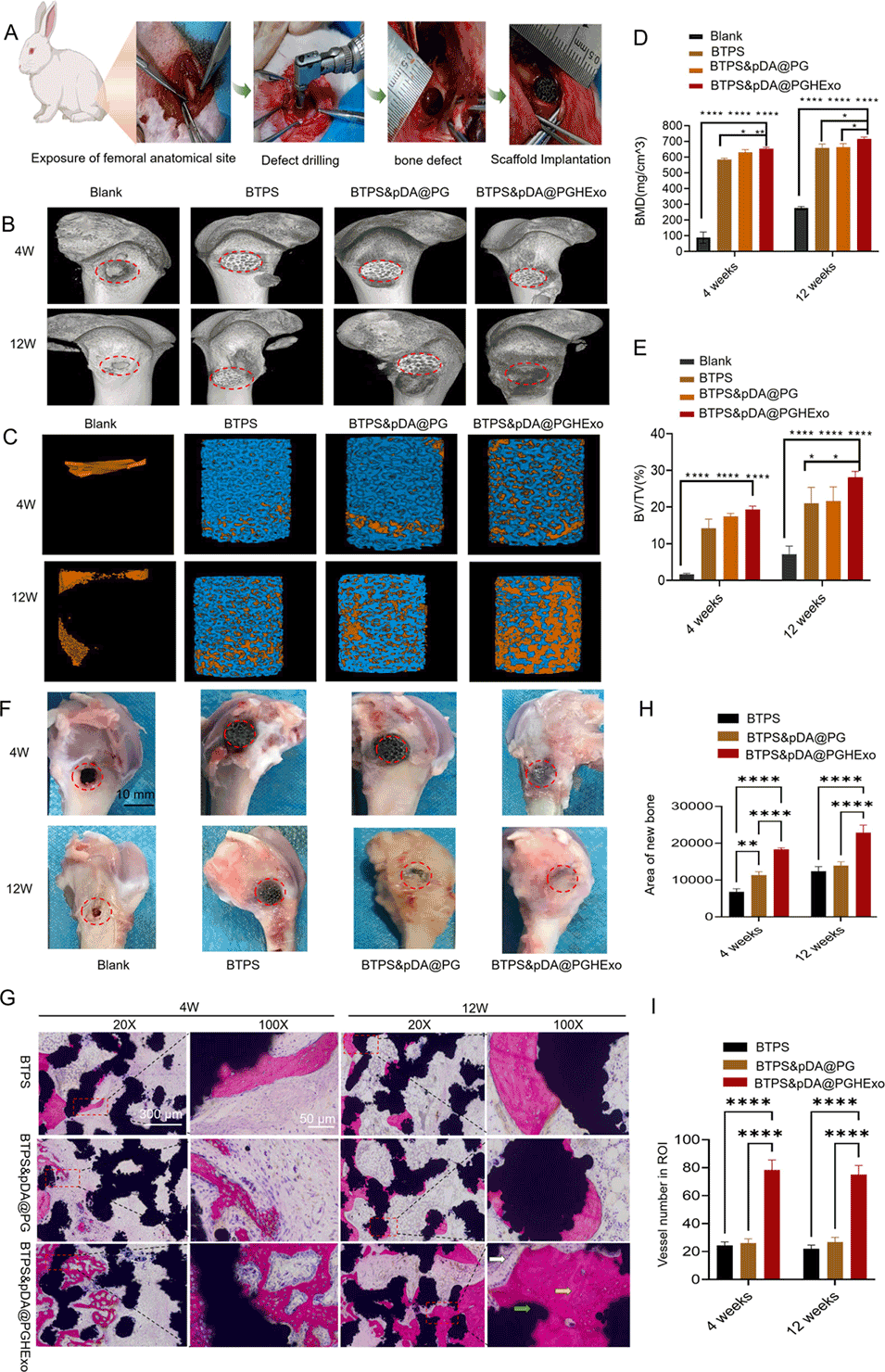
图8:不同支架组在兔股骨缺损模型中骨再生效能的体内评估
论文链接:https://doi.org/10.1002/advs.202500599














