患者来源的肿瘤类器官(PDTOs)是开发个性化治疗方法的极具潜力的3D疾病模型。然而,传统的PDTO制备技术存在诸多局限性,如批次间差异大且通量低。液滴微流控技术(DM)利用微通道生成均一液滴,凭借其高通量与参数可控的优势,在类器官制备领域展现出巨大潜力。但现有大多数液滴微流控装置需极高的初始细胞量(通常为10⁶量级),而活检样本难以获取如此大量的细胞。

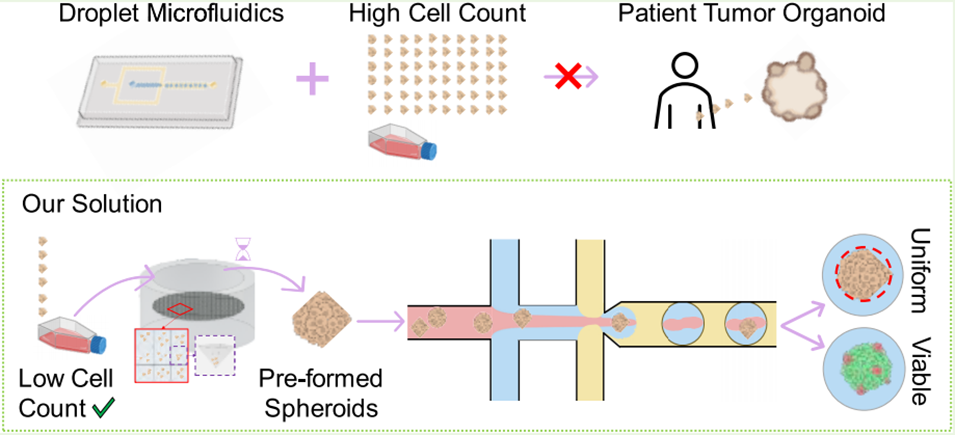
近期,加拿大滑铁卢大学研究团队提出了一种“分步式”新策略:先利用微孔板制备出均一的预成型球状体,再通过其设计的双十字液滴微流控芯片,将这些球状体逐个封装入水凝胶微环境中。该方法仅需极低的初始细胞数量(低至6×10⁴个),便能实现单球状体的精准包裹,并在后续培养中保持了球状体超过80%的高活性与优良的均一性。相关研究以“A Versatile Droplet Microfluidic Platform Capable of Confining Preformed Spheroids in Hydrogel Microenvironments for Downstream Growth and Analysis”为题,发表在期刊《ACS Biomaterials Science & Engineering》上。
本文要点:
1、本研究开发了一种液滴微流控平台,用于将预成型肿瘤球体封装到水凝胶微粒中,以解决患者来源肿瘤类器官(PDTOs)构建中初始细胞需求量高、批次差异大等问题。
2、该平台采用双十字形通道芯片设计,利用粘性对比的水凝胶产生流体动力聚焦,可将仅含10^4数量级细胞的预成型球体(直径100-200 μm)高效包裹于明确的水凝胶微环境中。
3、最优条件下,总封装率达75%,单球体封装率为54%。封装后的球体在离线培养5天后仍保持80%以上的存活率,直径变异系数差异小于4%,显示出良好的生物活性和尺寸均一性。该技术为低样本量下的高通量、标准化类器官培养与分析提供了可靠工具。
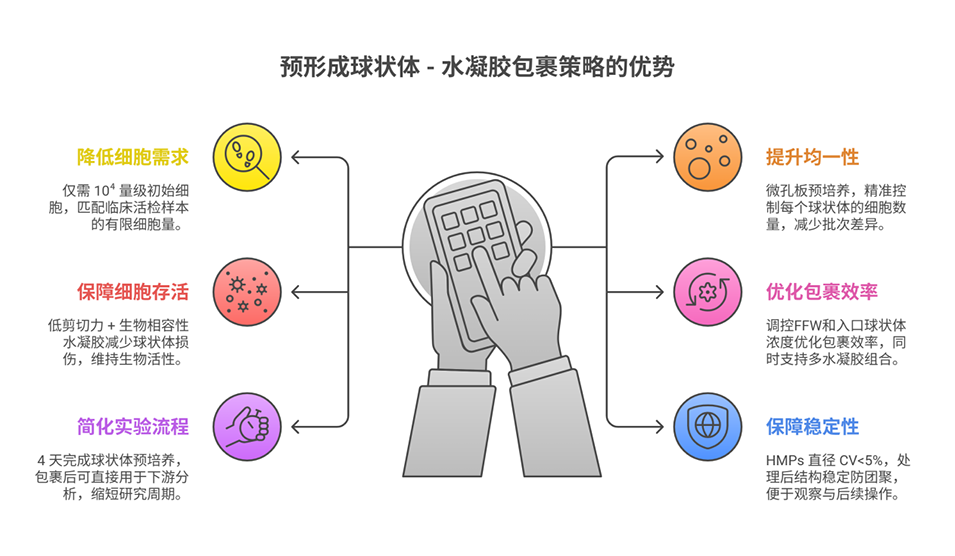
该平台中“流体动力聚焦”的设计原理在于,利用粘度差异产生的分层流效应,实现对预成型球状体的有序排列与温和封装。具体而言,通过控制双十字形通道芯片中两个分散相(D1和D2)的粘度比(η=μD1/μD2=2-20),使高粘度的D1(含预成型球状体)形成内流,低粘度的D2形成外侧聚焦流,在第一交叉口处将球状体对齐,第二交叉口处被连续相(矿物油)剪切形成单球状体包裹的液滴,避免传统T型芯片的多包裹或空滴问题。
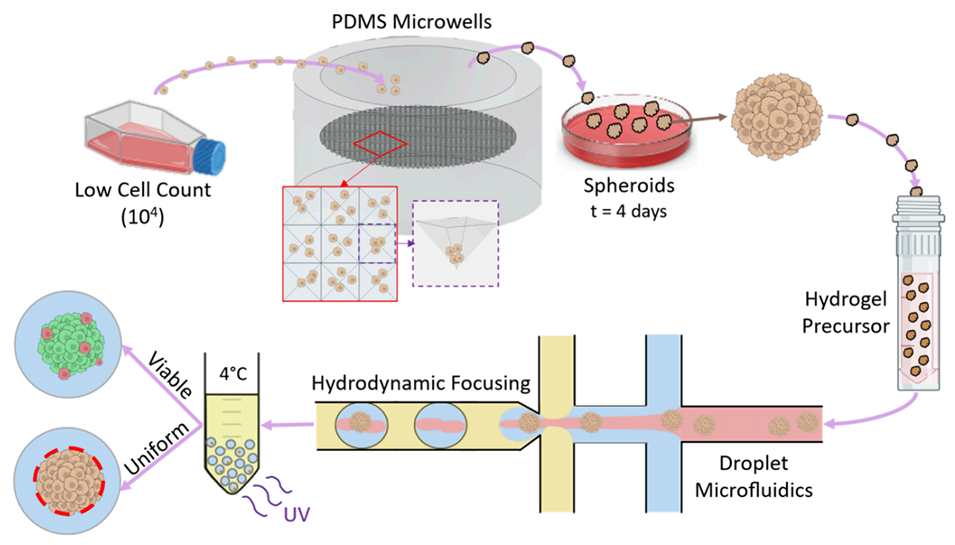
图1 系统操作流程总结:从低细胞量开始形成球状体,随后采用液滴微流控技术将球状体包裹在水凝胶液滴中,并验证其存活率与均一性。
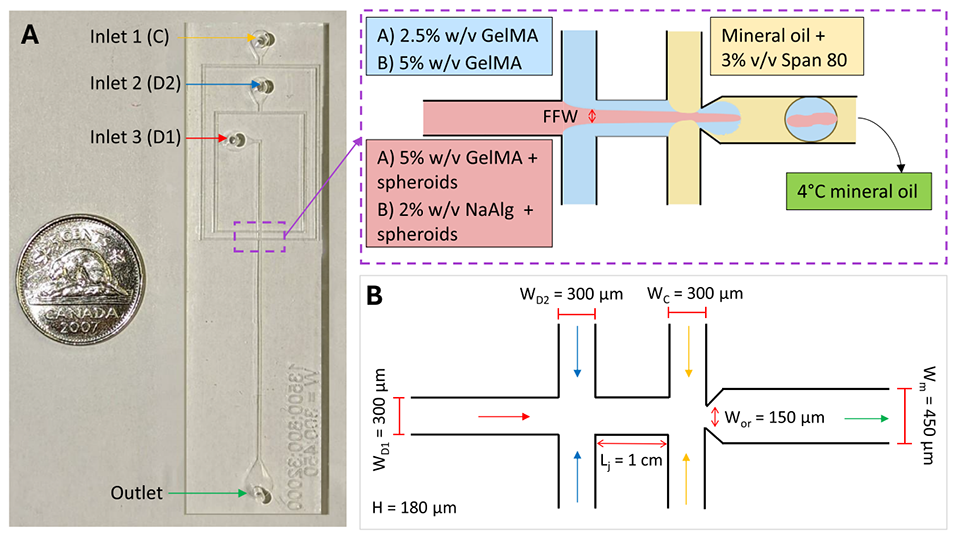
图2 (A)完整的液滴微流控(DM)芯片及尺寸标注,显示装置的入口与出口:入口 1 为连续相(C),即含 3% 体积分数 Span 80 的矿物油(黄色);入口 2 为分散相 2(D2),即低粘度水凝胶前体(蓝色);入口 3 为分散相 1(D1),即含球状体的高粘度水凝胶前体(粉色)。出口处为用于收集液滴的 4℃矿物油(绿色)。放大示意图展示了本研究中使用的流体条件,其中流体聚焦宽度(FFW)以粉色标注。(B)DM 芯片在通道连接处的几何结构示意图,标注了通道尺寸与流体流向。

图3 利用 PDMS 微孔板复制品形成均一球状体的流程总结:以低至 6×10⁴个细胞的 L929 细胞悬液为起始材料,将其加入 PDMS 微孔板(PMWs)中并均匀分配至各微孔内。细胞在 4 天内聚集形成均一且致密的球状体。对球状体进行反向过滤处理,得到均一的球状体批次,随后将其加入用于 DM 装置的水凝胶前体中。
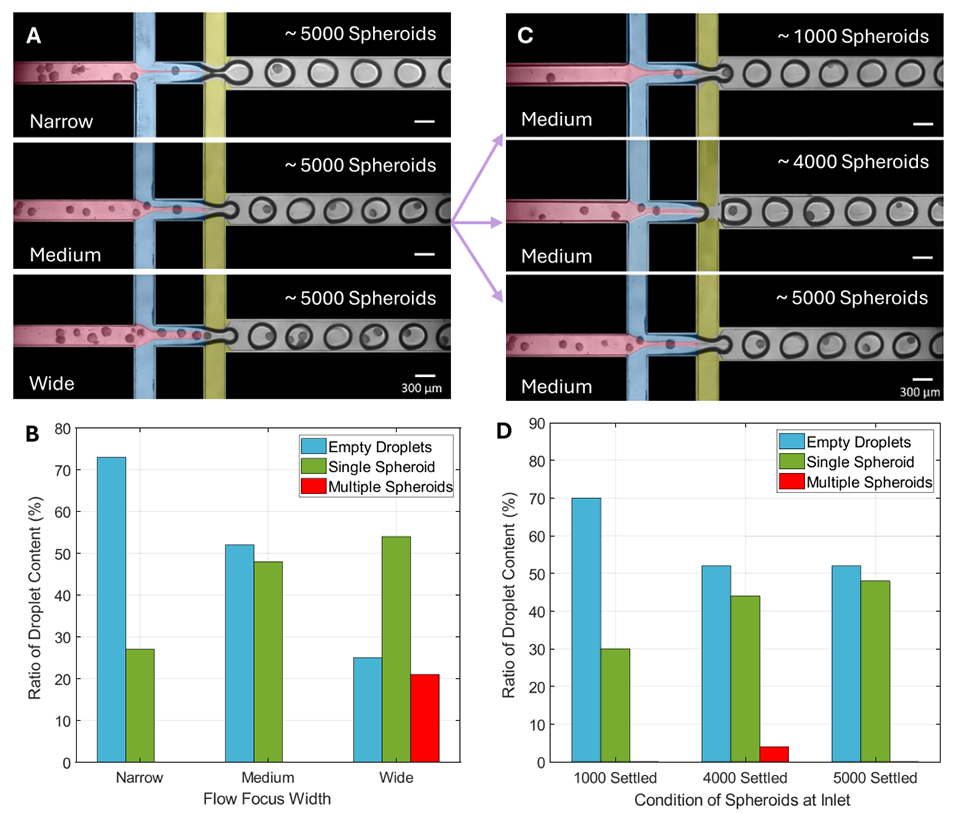
图4 (A)不同流体聚焦宽度(FFW)的伪彩色图像,便于区分流体流束:(i)窄宽度(为 WD1 的 20%)、(ii)中等宽度(为 WD1 的 30%)、(iii)宽宽度(为 WD1 的 40%)。球状体数量固定为 5000 个,悬浮于 500μL 5% 质量体积分数 GelMA 中作为分散相 1(D1,粉色),分散相 2(D2)为 2.5% 质量体积分数 GelMA(蓝色)(粘度比 η≈2.5),连续相(黄色)为含 3% 体积分数 Span 80 的矿物油。聚焦宽度通过调整 D1 的压力实现变化。(B)不同 FFW 条件下的包裹效率示意图,对比了液滴中球状体的含量分布。随着 FFW 增大,单球状体包裹的液滴数量增多。(C)在入口储液池中加入不同浓度球状体时装置运行的伪彩色图像:球状体悬浮于 500μL 5% 质量体积分数 GelMA 中,流体条件与(A)一致,FFW 保持中等宽度。(D)不同入口球状体浓度下的包裹效率示意图,对比了液滴中球状体的含量分布。初始球状体数量越多,可被包裹进水凝胶液滴的球状体数量越多;但即使在低球状体数量下,仍能实现有效的包裹。比例尺 = 300μm。
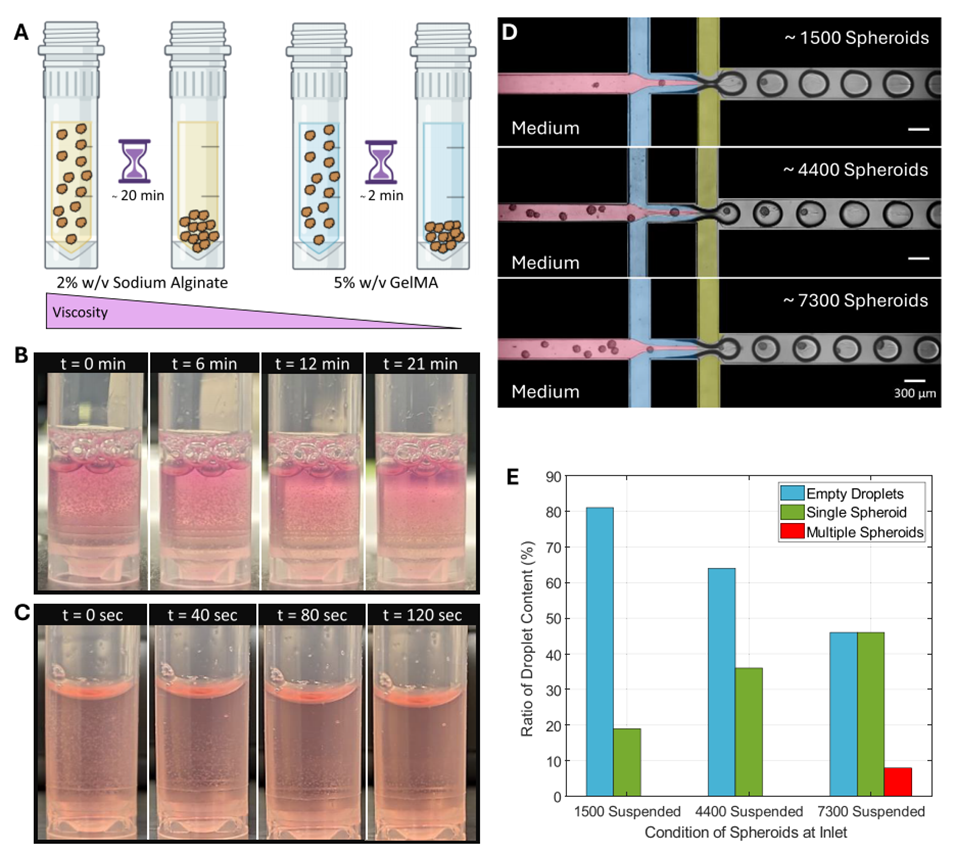
图5 (A)基于水凝胶前体粘度的球状体沉降时间示意图:粘度越高,球状体沉降速度越慢。(B)约 4000 个球状体悬浮于 500μL 2% 质量体积分数海藻酸钠(NaAlg)中:球状体在约 20 分钟后出现明显沉降,每 3 分钟观察一次并记录关键图像。(C)约 4000 个球状体悬浮于 500μL 5% 质量体积分数 GelMA 中:球状体在约 2 分钟后出现明显沉降,每 20 秒观察一次并记录关键图像。(D)入口储液池中加入不同浓度球状体时装置运行的伪彩色图像:球状体悬浮于 500μL 2% 质量体积分数 NaAlg 中作为分散相 1(D1,粉色),分散相 2(D2)为 5% 质量体积分数 GelMA(蓝色)(粘度比 η≈9),FFW 保持中等宽度,连续相(黄色)为含 3% 体积分数 Span 80 的矿物油。比例尺 = 300μm。(E)不同入口球状体浓度(悬浮于 2% 质量体积分数 NaAlg 中)的包裹效率示意图,对比了液滴中球状体的含量分布。
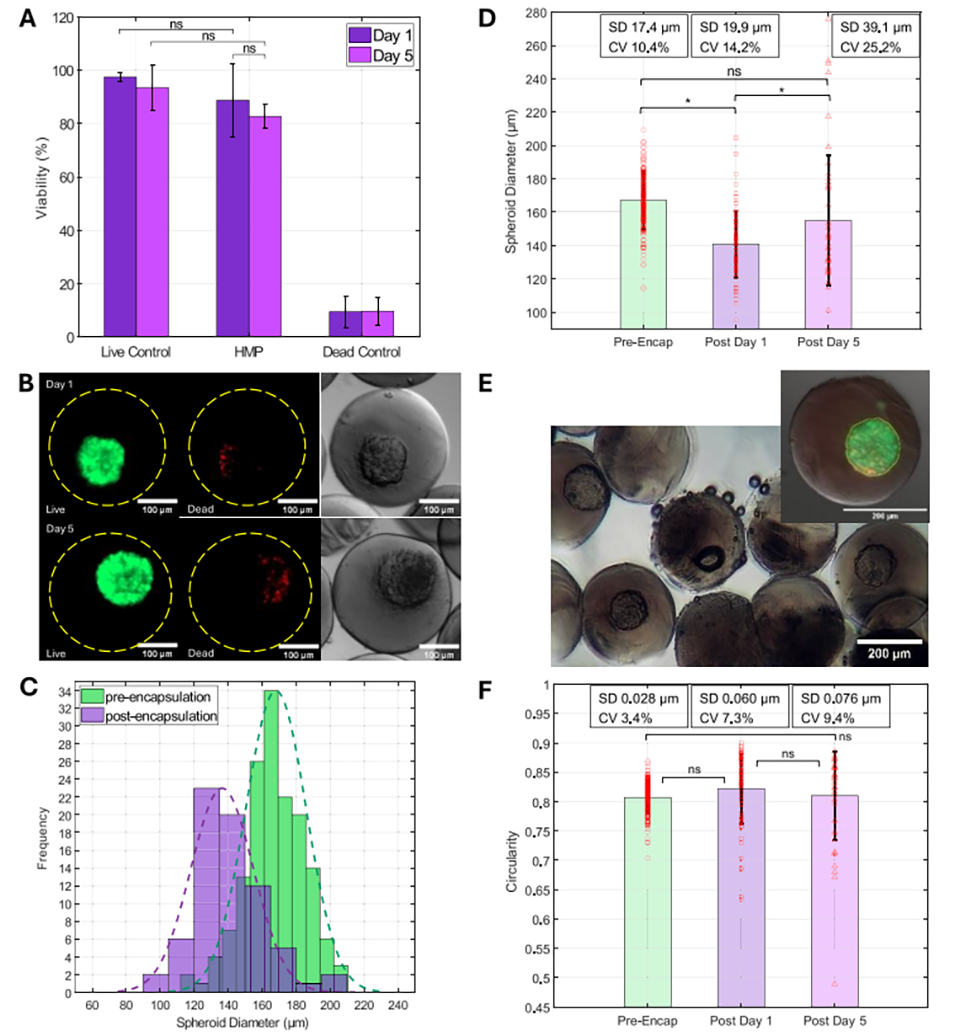
图 6 采用以下液滴微流控流体条件对包裹在水凝胶微粒(HMPs)中的球状体进行分析:分散相 1(D1)为 2% 质量体积分数 NaAlg,分散相 2(D2)为 5% 质量体积分数 GelMA,连续相(C)为含 3% 体积分数 Span 80 的矿物油,在 4℃矿物油出口处收集液滴。(A)包裹后 1 天和 5 天的球状体存活率,数值为四个不同批次的平均值。(B)活/死染色实验图像示例:展示了包裹后 1 天和 5 天的荧光图像(活细胞为绿色,死细胞为红色)及对应的明场图像。比例尺 = 100μm。(C)包裹前 1 天与包裹后 1 天的球状体直径分布,附对应的高斯分布曲线(虚线)。(D)包裹前(Pre-Encap,n=152)、包裹后 1 天(Post Day 1,n=71)和包裹后 5 天(Post Day 5,n=46)的球状体平均直径统计图,红色圆点代表各样本数据。(E)包裹后 1 天含球状体液滴的明场图像,示例液滴中标注了球状体直径的测量方式(黄色轮廓线)。(F)球状体平均圆形度统计图,格式与(D)一致。比例尺 = 200μm。(* 表示 p<0.05,具有统计学显著性)。
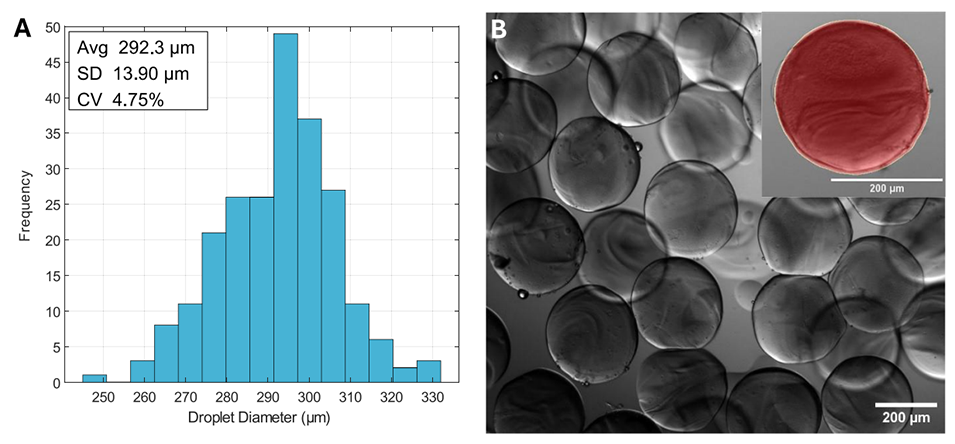
图 7 (A)收集并交联后的水凝胶微粒(HMPs)的液滴分布(n=231)。(B)收集后空液滴的明场图像,示例液滴中标注了液滴直径的测量方式(黄色轮廓线)。比例尺 = 200μm。
论文链接:https://doi.org/10.1021/acsbiomaterials.5c01015
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














