嵌合抗原受体(CAR)-T细胞疗法彻底改变了癌症治疗格局,但该疗法存在制造流程复杂、成本高昂及安全性隐患等挑战,这推动了嵌合抗原受体(CAR)-自然杀伤(NK)细胞免疫疗法等替代方案的研发。CAR-NK细胞疗法具备先天细胞毒性,可实现不依赖抗原的靶向作用,在降低安全风险的同时还能提升治疗效果。然而,同种异体NK细胞的高效基因组工程改造与规模化生产,仍是目前亟待解决的重大难题。

近期,有研究人员开发出一种名为Y-hydroporator的新型Y型微流控基因递送平台,通过流体动力学拉伸实现高效基因递送,成功制备出高活性的抗CD19 CAR-NK细胞与NKG2A敲除NK细胞,突破了同种异体NK细胞免疫疗法的技术瓶颈。相关研究以“Advancing Allogeneic NK Cell Immunotherapy through Microfluidic Gene Delivery”为题目,发表在期刊《Advanced Science》上。
本文要点:
1、本研究开发了一种新型微流体基因递送平台,即Y-hydroporator,用于推进同种异体NK细胞免疫治疗。
2、该平台采用Y型微通道结构,含1个核心入口(注入NK细胞与cargo混合物)和2个鞘层入口(注入细胞培养基或缓冲液);细胞在通道滞止点经历约20微秒的快速流体动力学拉伸,细胞膜形成瞬时孔隙,从而促进外源性货物(mRNA、CRISPR/Cas9等)的摄取。
3、Y-hydroporator可实现高递送和转染效率,处理速度达每分钟约2×106个细胞,同时保持长期细胞活性(>89%)和功能。
4、利用该平台分别递送抗CD19 CAR mRNA和CRISPR/Cas9核糖核蛋白,成功制备出人原代CAR-NK细胞和NKG2A敲除NK细胞。这些工程化NK细胞表现出增强的细胞毒性,为同种异体NK细胞免疫疗法的发展提供了突破性工具。
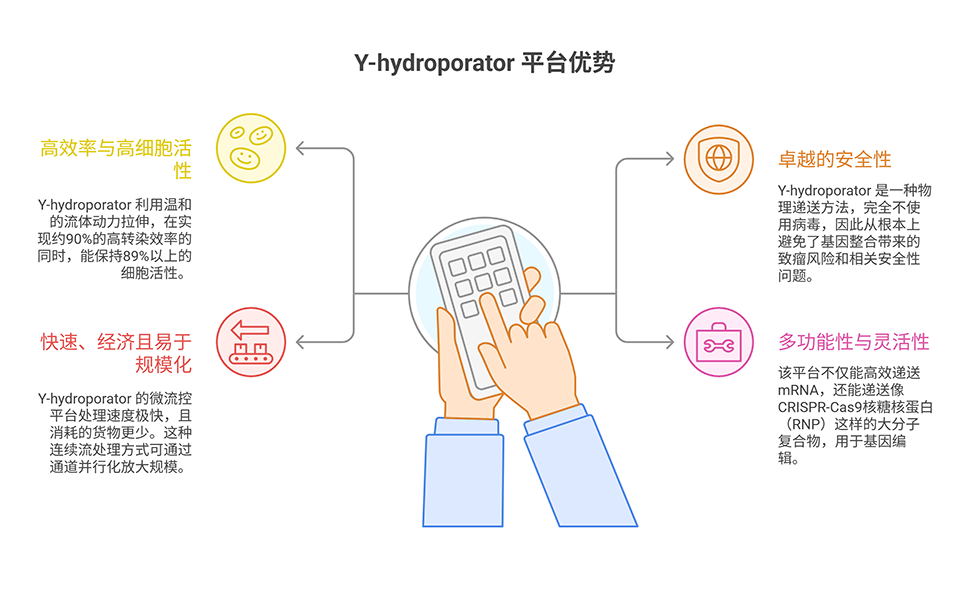
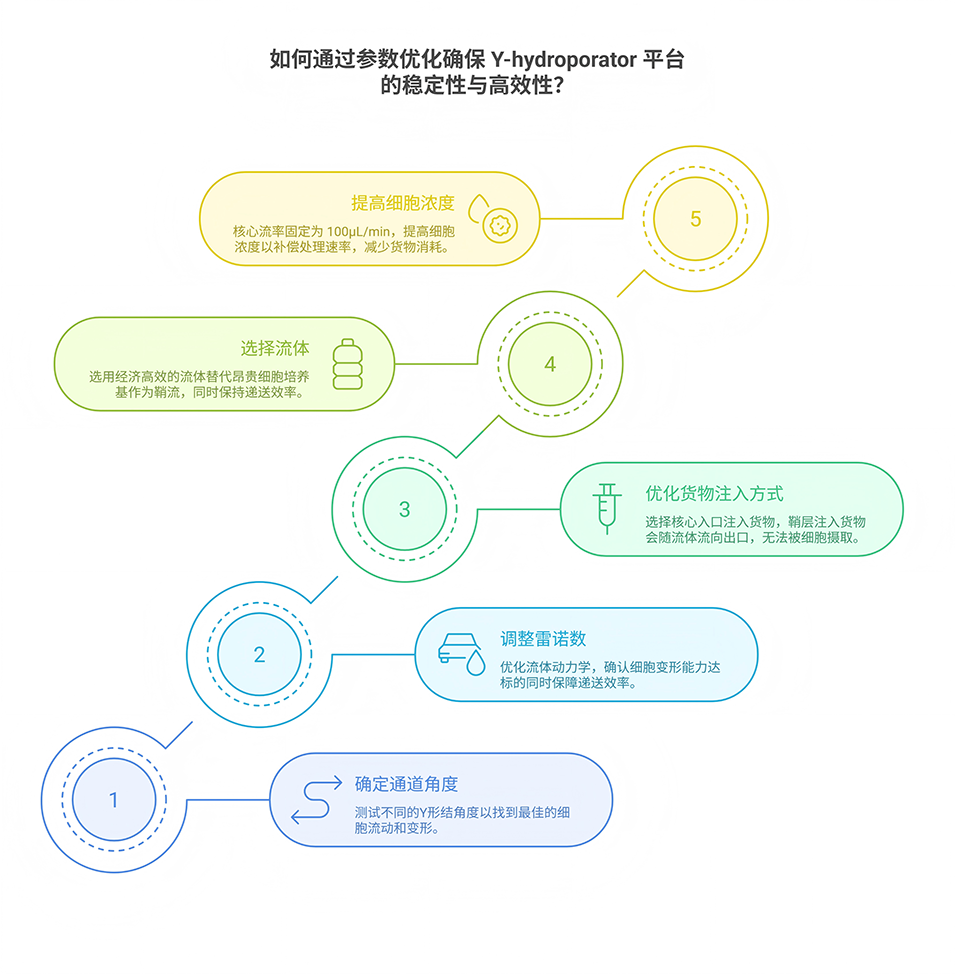
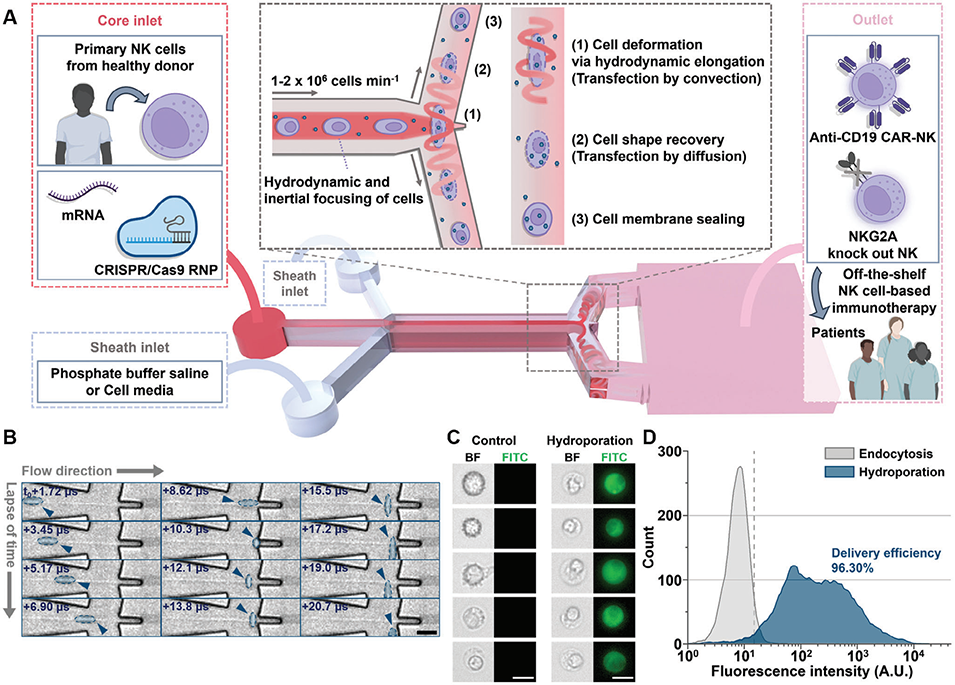
图1. 装置设计与工作原理
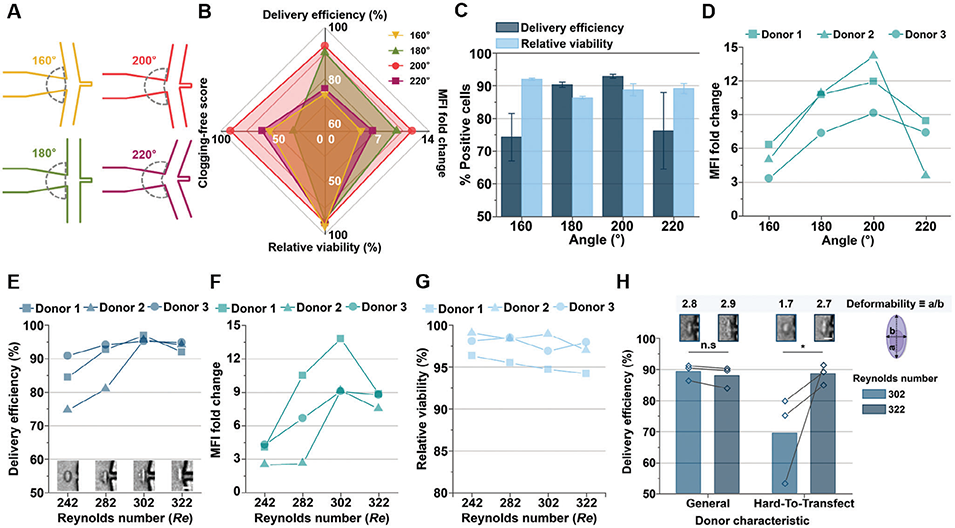
图2. 微流控细胞内递送的优化
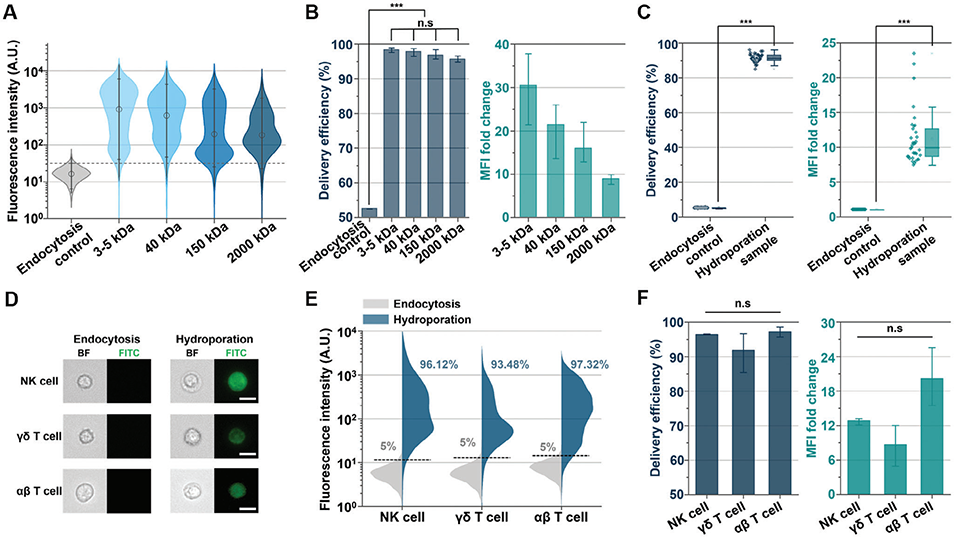
图3. 人原代NK细胞、γδ T细胞及αβ T细胞的细胞内递送特征分析
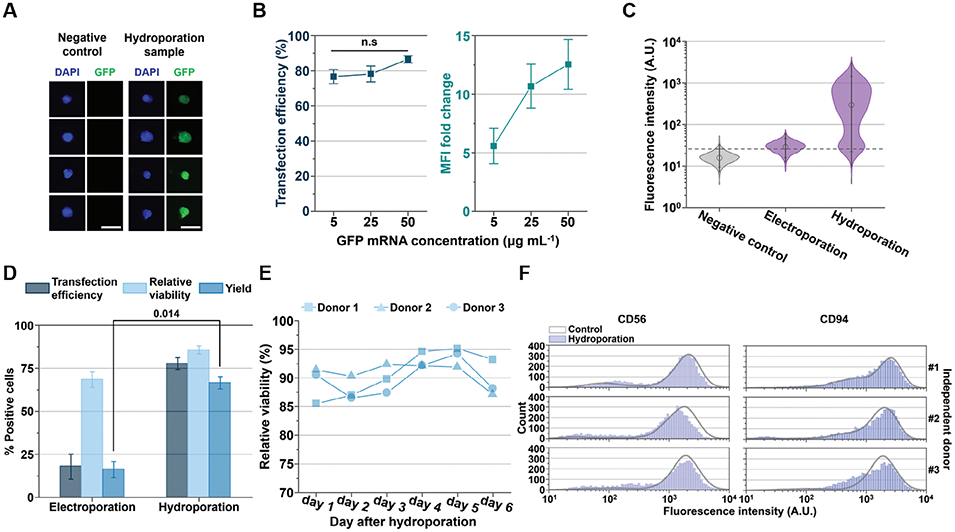
图4. NK细胞的mRNA工程改造及细胞存活率与表型稳定性验证
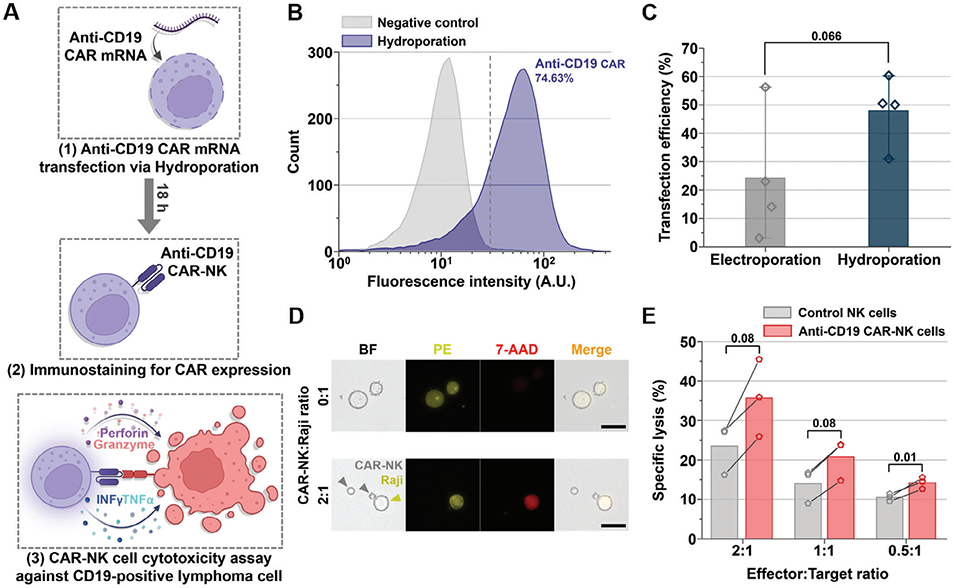
图5. 利用Y型水穿孔器制备抗CD19 CAR-NK细胞
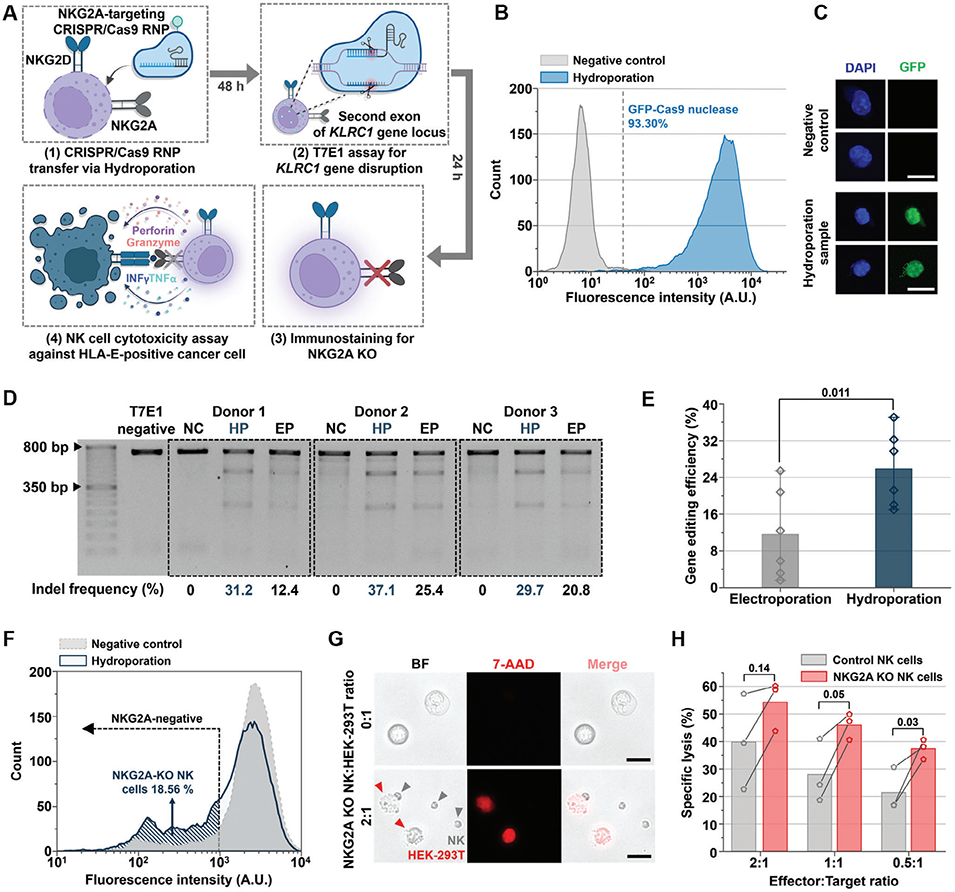
图6. 通过CRISPR/Cas9核糖核蛋白(RNP)递送实现下一代NK细胞免疫疗法
论文链接:https://doi.org/10.1002/advs.202412544
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














