
原文链接:https://pubs.acs.org/doi/10.1021/acsnano.5c02557
DOI号:10.1021/acsnano.5c02557
癌症转移是导致患者死亡的主要原因,但癌细胞如何突破血管屏障实现转移的细节,尤其是外泌体在其中的作用,一直是个黑箱。近日,一项研究在《ACS Nano》发表,成功开发出一种名为“肿瘤-跨内皮迁移芯片”(Tumoral-Transendothelial Migration-On-a-Chip, TEMOC)的微流控器官芯片,并结合机器学习技术,首次在单细胞和细胞簇水平上,清晰揭示了高转移性乳腺癌细胞释放的外泌体如何“教唆”低转移性癌细胞突破血管防线,实现致命转移(图1)。该研究通讯作者为新加坡国立大学Lim Chwee Teck教授、东北大学陈明丽教授、山西省人民医院张瑞平教授,第一作者为山西医科大学张璇博士和东北大学白俊杰博士,第一单位为山西医科大学。
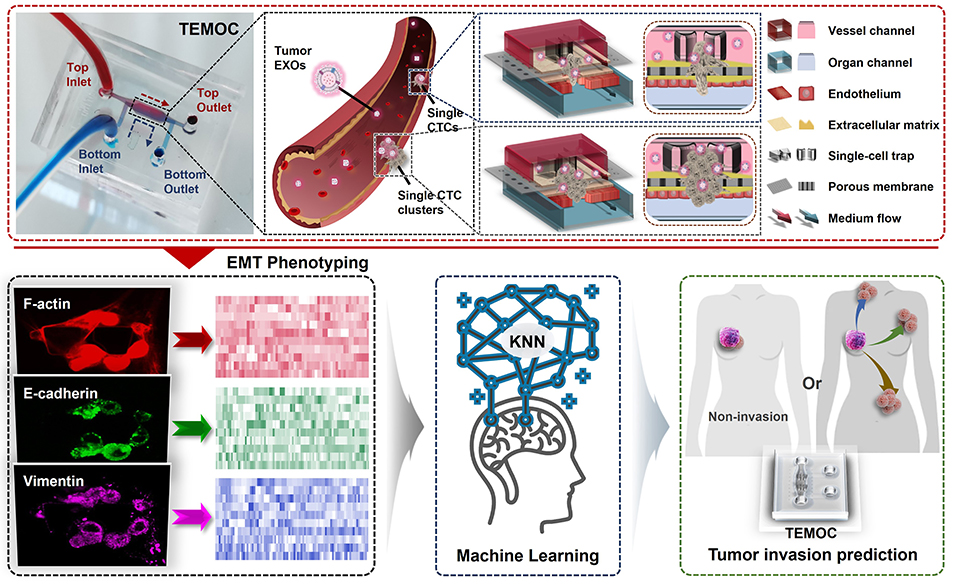
图1. 乳腺癌侵袭血管模型的单细胞或细胞簇水平示意图
这项研究的核心在于TEMOC芯片。它精妙地模拟了体内肿瘤细胞侵袭血管壁的复杂微环境。芯片采用三层设计:顶层模拟血管腔,带有微陷阱阵列,用于捕获流动的单个或成簇的肿瘤细胞及外泌体;中间是一层具有不同孔径的微孔膜,允许物质交换和细胞迁移;底层则由人脐静脉内皮细胞(HUVECs)构成血管壁。通过精确控制流体,芯片内成功构建了具有紧密连接的功能性血管内皮屏障,并能在长达7天内维持细胞的高活性,为研究提供了稳定可靠的平台(图2)。
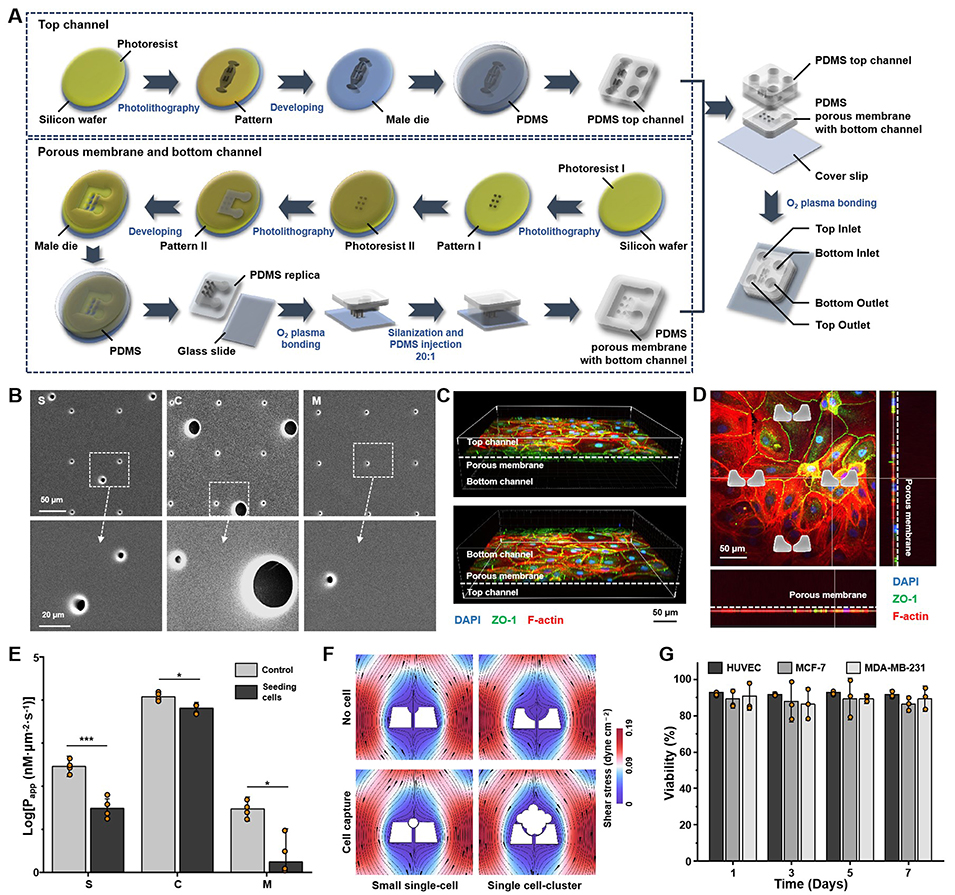
图2. TEMOC制作方法及表征结果图,包括SEM、共聚焦显微镜、透过性实验、剪切力以及生长活性。
研究人员聚焦于高转移性乳腺癌细胞(MDA-MB-231)分泌的外泌体(MDA-EXOs)(图2)。实验令人震惊地发现,这些纳米级的外泌体能够被低转移性的乳腺癌细胞(如MCF-7)摄取。一旦进入MCF-7细胞,MDA-EXOs会显著下调其上皮标志物E-钙粘蛋白(E-cadherin)的表达,同时上调间质标志物波形蛋白(Vimentin),诱导其发生上皮-间质转化(EMT),使其获得更强的迁移和侵袭能力。更关键的是,MDA-EXOs还能攻击血管内皮屏障——它们显著削弱了内皮细胞间的连接蛋白(如VE-钙粘蛋白)和细胞骨架(F-actin)的表达,破坏血管屏障的完整性,为肿瘤细胞“开路”。这种双管齐下的作用,使得低转移性的MCF-7细胞在TEMOC芯片中表现出接近高转移细胞的侵袭穿透能力。
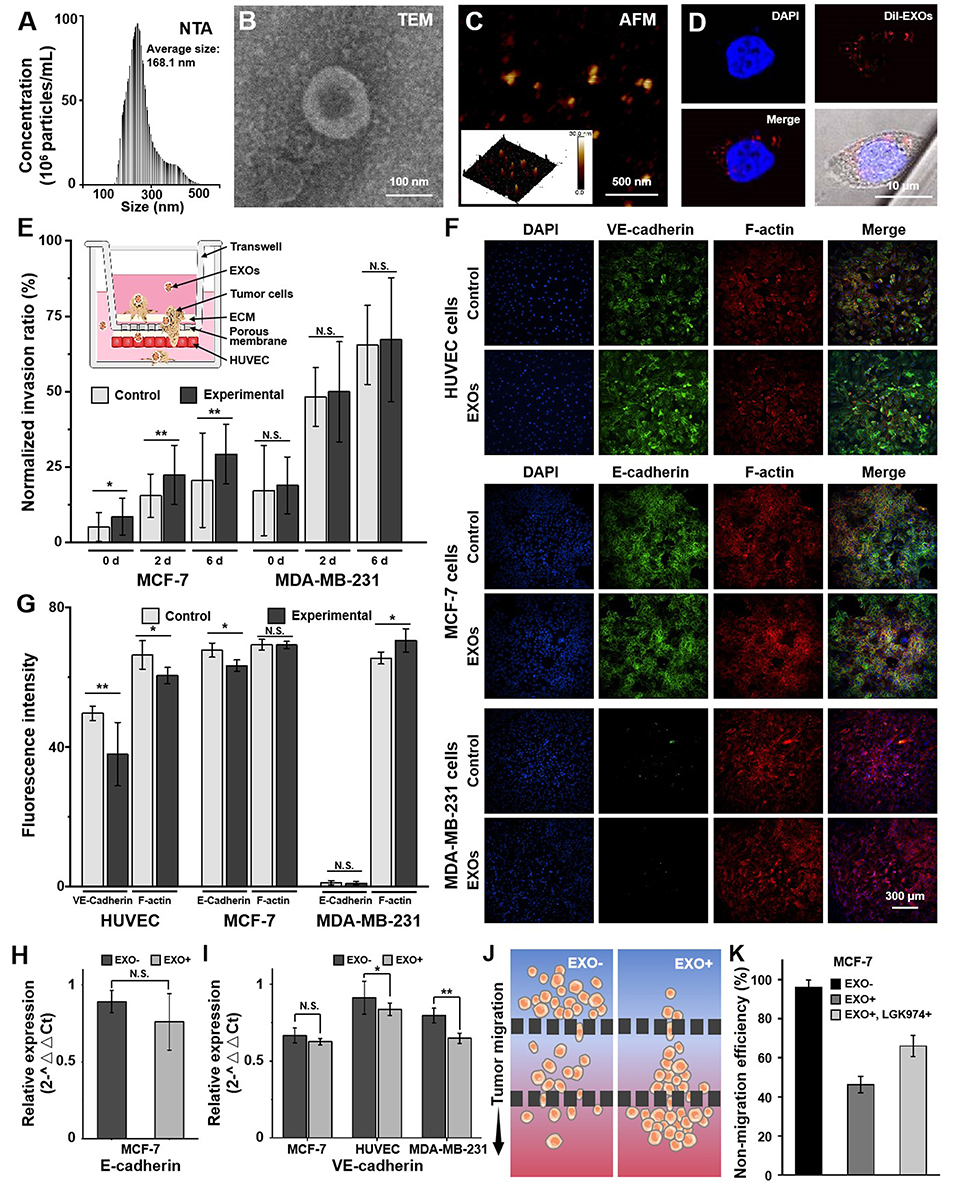
图2. MDA-EXOs诱导增强了乳腺癌细胞转移能力
随后,研究深入到更精细的单细胞和细胞簇层面(图4)。利用TEMOC芯片的高通量优势,研究人员捕捉并分析了121种特定的单肿瘤微环境。结果揭示相比单个细胞,成簇的肿瘤细胞在MDA-EXOs的“加持”下,表现出了更强大的穿透血管屏障的能力。荧光成像清晰地显示,细胞簇在穿越微孔时更为高效。同时,单细胞水平的蛋白表达热图证实,细胞簇在接受外泌体刺激后,其E-cadherin的下调和Vimentin的上调比单细胞更显著,这解释了它们侵袭力更强的内在原因。
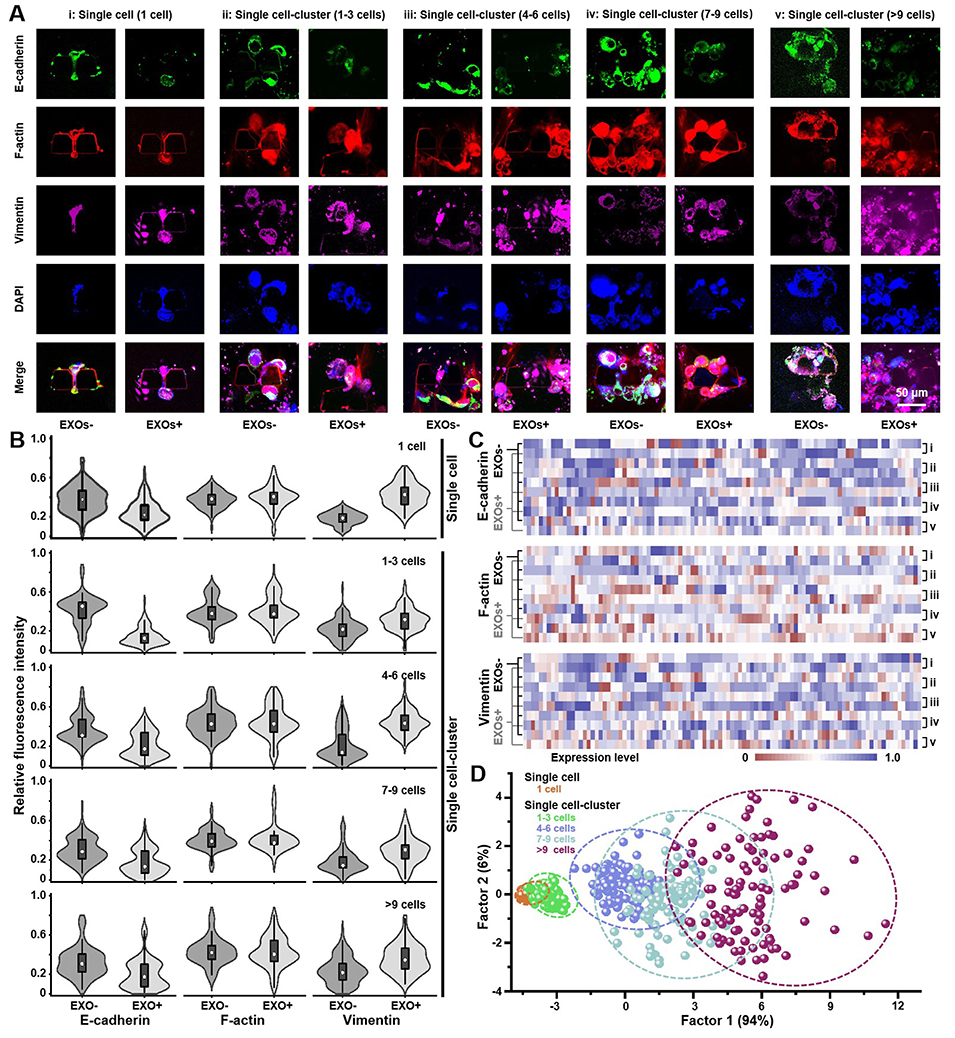
图4. 在单细胞和单细胞簇分辨率下,MDA-EXOs介导的肿瘤穿越血管内皮屏障。
为了将复杂的数据转化为精准的预测工具,研究人员引入了机器学习(ML)算法。他们收集了TEMOC中经MDA-EXOs处理的单细胞和细胞簇的多项生物标志物(如E-cadherin, F-actin, Vimentin)数据。通过训练K-最近邻(KNN)算法模型,研究者发现,结合多个生物标志物的信息(而非单一标志物)能显著提高预测癌细胞侵袭能力的准确性。优化后的三种标志物组合预测模型表现惊艳,对癌细胞侵袭能力的预测准确率高达93.5%。这种“器官芯片+AI”的整合策略,为快速评估肿瘤细胞的转移风险提供了强大平台(图5)。
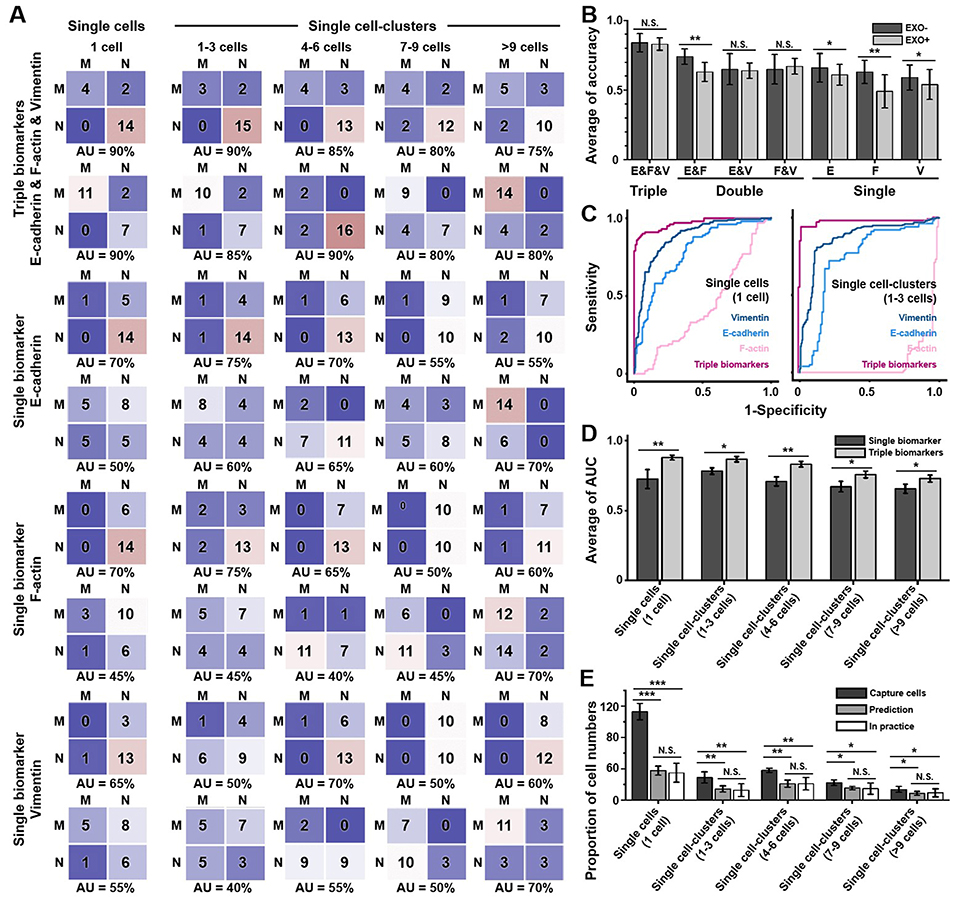
图5. 基于机器学习KNN模型的肿瘤转移预测。
这项研究意义重大。它不仅首次在体外芯片模型上清晰可视化了外泌体如何充当高转移癌细胞的“帮凶”,破坏血管屏障并诱导低转移癌细胞获得侵袭能力,揭示了癌症转移的新机制;更重要的是,所开发的TEMOC芯片结合机器学习预测模型,为抗转移药物的高通量筛选和癌症转移的早期预测提供了极具潜力的强大工具。未来,这种“器官芯片+人工智能”的融合策略,有望在癌症研究和精准医疗领域发挥更广泛的作用。














