
导读:
微塑料(MP)在个人护理产品中广泛存在,且已进入动植物及人体,因此亟需替代实验方法评估其细胞毒性、作用机制及长期影响。近期,清华大学马少华教授团队利用微流控液滴喷射打印技术构建了由E18孕鼠胎儿表皮和真皮细胞组成的皮肤类器官球,通过该模型揭示了微塑料的尺寸依赖性摄取规律、UVA照射对其毒性的增强作用及维生素C的防护效果,同时验证了该模型在皮肤毒性评估和药物测试中的应用价值。相关研究以“Epidermal and dermal cell-composed organospheres to assess microplastic-induced skin toxicity”为题发表于期刊《Biomaterials》。
本文要点:
1、利用微流控液滴喷射打印技术,从E18孕鼠胎儿中提取表皮和真皮细胞,构建出不同密度的皮肤类器官球。其中,中等密度的类器官球表现出良好的自聚集、迁移和细胞分化能力。
2、研究发现,微塑料的摄取率具有尺寸依赖性,较小的微塑料(100nm)内化率更高,能穿透表皮层向中心区域迁移,而较大的微塑料(500nm)则停留在周边区域。
3、经紫外线A(UVA)照射的微塑料会通过上调氧化应激相关基因(SOD、p53、Bax),显著增加氧化应激、细胞凋亡和活性氧(ROS)水平。
4、此外,维生素C处理能降低经UVA照射的微塑料所诱导的活性氧水平,减少细胞凋亡。
5、同时,使用常见皮肤相关药物进行的细胞活力测定表明,药物的细胞毒性具有剂量和时间依赖性,这体现了该类器官球在皮肤毒性评估和药物快速测试中的广泛应用前景。
6、不过,该模型也存在一定局限性,如细胞复杂性有限、小鼠与人类模型对微塑料的细胞反应存在差异等,未来研究需进一步优化。
微流控液滴喷射打印技术的原理是结合微流体系统的精准控制与喷射式打印机制,实现细胞或生物材料的有序构建。
该技术通过一个三通的聚二甲基硅氧烷(PDMS)立方体系统,将含特定密度细胞(如文中的表皮和真皮细胞)的基质胶(Matrigel)液体相,与HFE7000油相分别通过流体泵控制流速(细胞悬液流速设置为20μl/min,油相流速设置为300 μl/min),在微通道中形成均一的单分散液滴。这些液滴包含预设数量的细胞,经收集后在37°C、5%CO₂条件下固化30分钟,然后被注入到低附着性的6孔板中,形成结构稳定的类器官球。
其核心在于通过微流体系统对液滴生成的精确调控,结合喷射式打印的高效性,实现细胞的均匀分布、快速增殖及自组织,最终构建出具有类似天然组织功能和结构的三维模型(如皮肤类器官球),为生物材料研究、毒性评估等提供标准化实验平台。
类器官球在微塑料皮肤毒性评估中展现出多方面显著优势,具体如下:
1、模拟天然皮肤结构与功能,真实还原微塑料与皮肤的相互作用。
2、精准体现微塑料的尺寸依赖性摄取及动态迁移特性。
3、可模拟UVA等环境因素与微塑料的协同毒性,评估更全面。
4、借助标准化构建技术,支持高通量筛选,提升评估效率。
5、便于解析毒性分子机制,且能直接验证防护措施的有效性。
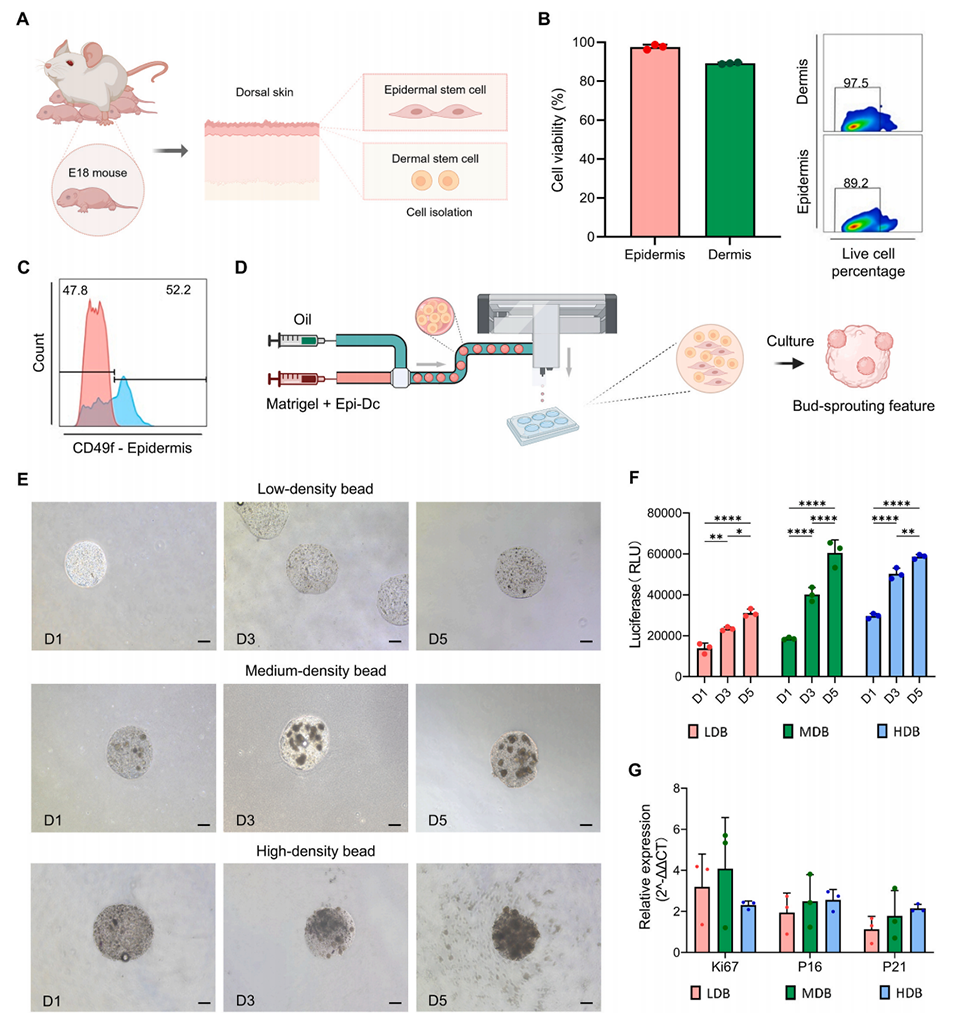
图1.表皮-真皮细胞类器官球的生物学评估。(A)E18小鼠表皮和真皮细胞分离示意图。(B–C)流式细胞术分析分离后表皮和真皮细胞的活力及纯度。(D)用于表皮-真皮细胞类器官球生物制造的微流控液滴喷射打印系统示意图。(E)低密度球(LDB,6×10³细胞/类器官球)、中密度球(MDB,10×10³细胞/类器官球)和高密度球(HDB,30×10³细胞/类器官球)组在第1、3、5天的明场显微镜图像;比例尺,200μm。(F)LDB、MDB和HDB组在第1、3、5天的荧光素酶检测结果。(G)孵育72小时后Ki67、P16和P21基因的qRT-PCR分析,以GAPDH为内参。****:p<0.0001,***:p<0.001,**:p<0.01;n=3。
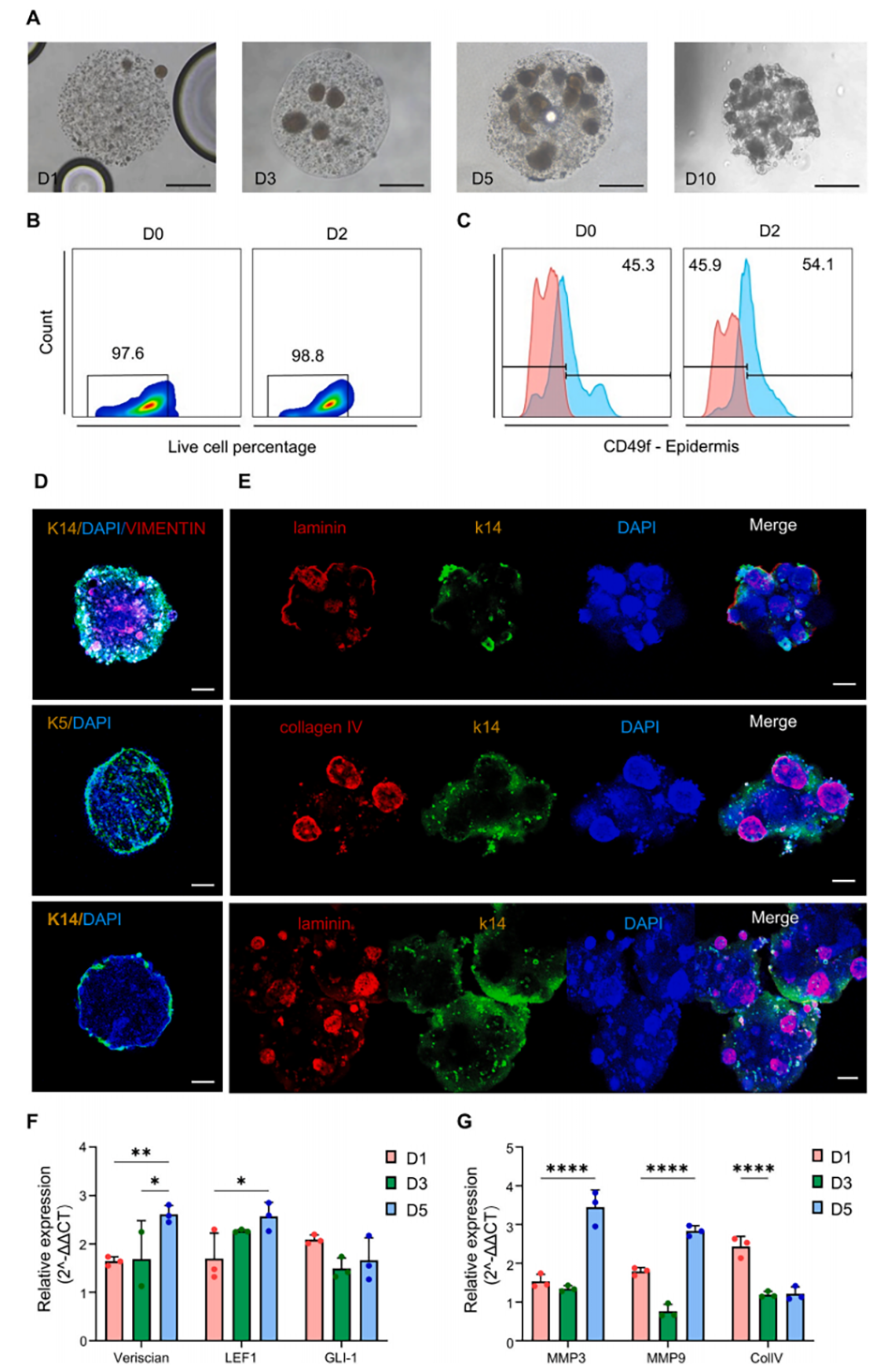
图2.中密度球(MDB)表皮-真皮细胞类器官球的表征。(A)MDB类器官球在第1、3、5天的明场显微镜图像;比例尺,200μm。(B–C)培养第0天和第2天表皮和真皮细胞的流式细胞术分析,显示细胞活力和纯度。(D–E)第3天类器官球形态的免疫荧光分析。(D)类器官球用表皮标志物(K14、K5、K10;绿色)和真皮标志物(波形蛋白;红色)染色。(E)类器官球细胞聚集结构的可视化,突出显示细胞外基质成分(胶原蛋白和层粘连蛋白;红色)和表皮标志物(K14;绿色),结构差异可能源于批次差异。(F)Wnt(多配体蛋白聚糖、LEF-1)和Hedgehog(Gli-1)信号通路相关基因的qRT-PCR分析。(G)类器官球中基质相关基因(MMP3、MMP9和IV型胶原蛋白)的相对表达,以GAPDH为内参。****:p<0.0001,***:p<0.001,*:p<0.05;n=3。
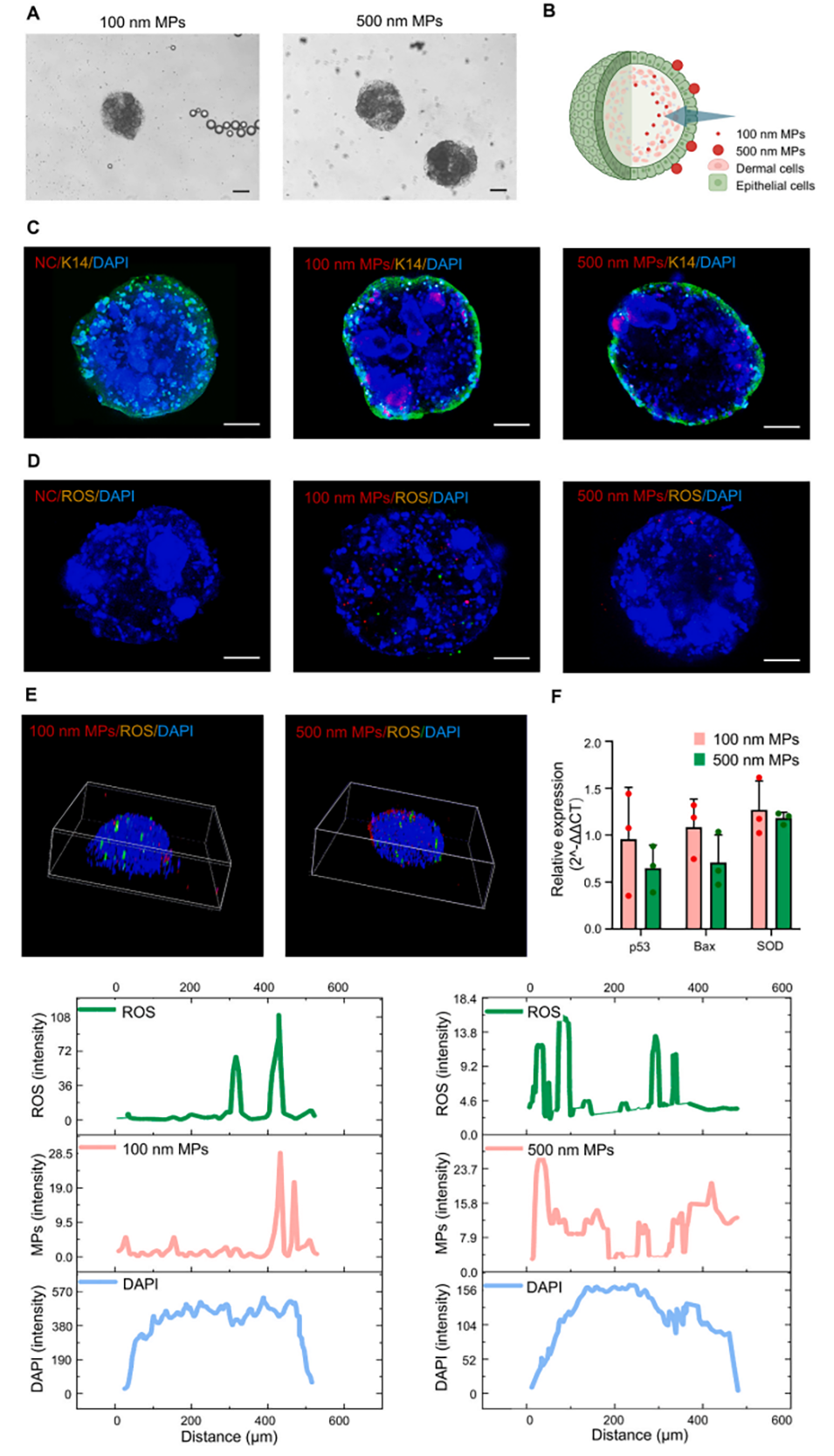
图3.表皮-真皮细胞类器官球对微塑料的摄取模式。(A)与100nm或500nm微塑料共培养的类器官球明场图像。比例尺:200μm。(B)不同尺寸微塑料摄取模式的示意图。(C–D)免疫荧光显微镜显示类器官球内微塑料(红色)的分布和活性氧(ROS)损伤。细胞核(DAPI,蓝色),上皮细胞(K14,绿色),活性氧(绿色),微塑料(红色);比例尺,100μm。(E)类器官球内活性氧和微塑料分布的强度轮廓图。(F)与100nm或500nm微塑料共培养的类器官球中基因(P53、Bax和SOD)表达的qRT-PCR分析,以GAPDH为内参。n=3。
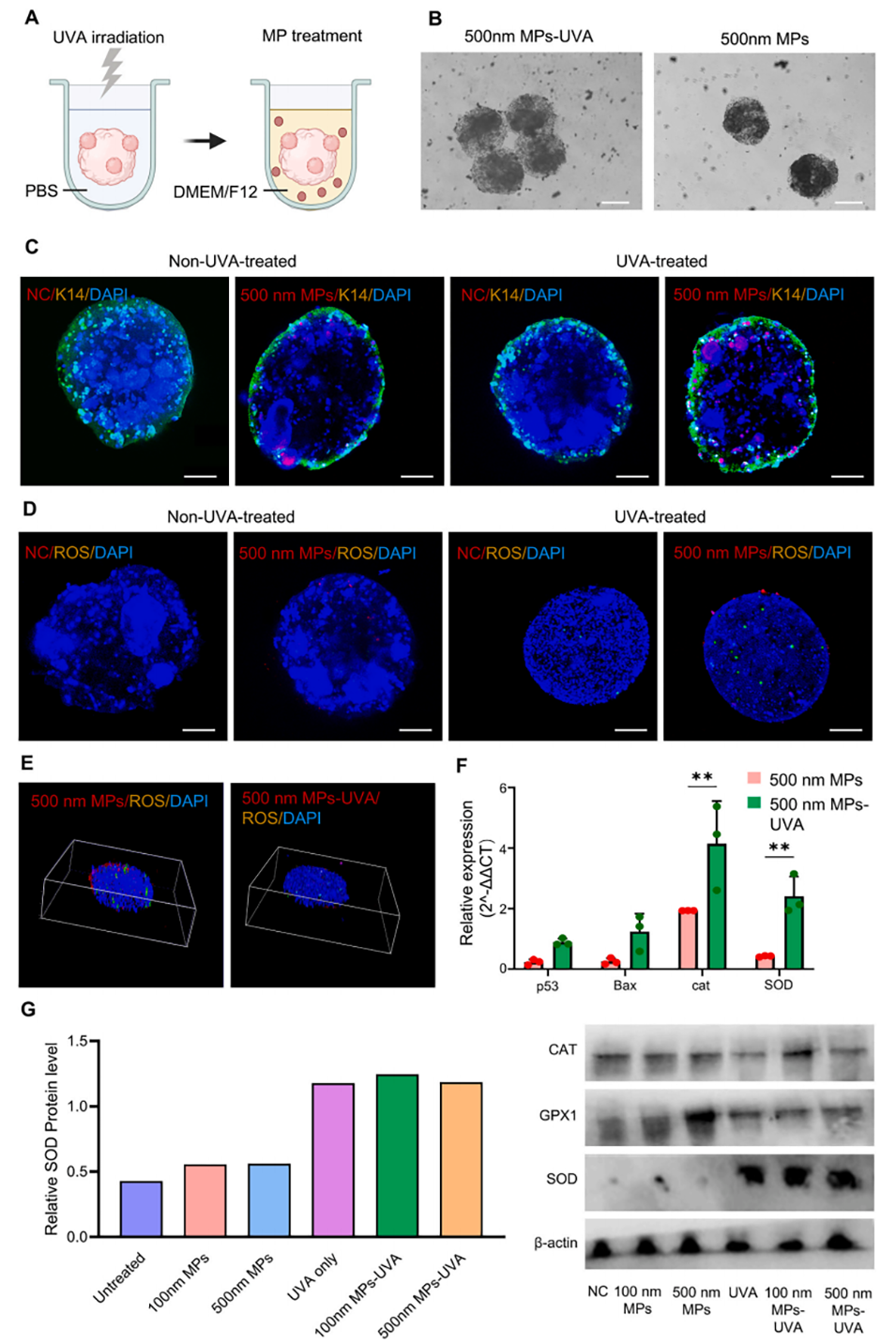
图4.长波紫外线(UVA)调控表皮-真皮细胞类器官球对微塑料的摄取模式。(A)类器官球UVA处理流程示意图。(B)与500nm微塑料共培养的类器官球明场图像。比例尺:200μm。(C)荧光显微镜图像显示四组类器官球内微塑料(红色)的分布;比例尺:100μm。(D)荧光显微镜图像显示与微塑料共培养的类器官球内活性氧损伤(绿色)。(E)类器官球内活性氧和微塑料分布的强度轮廓图;比例尺:100μm。(F)UVA处理组和非UVA处理组中基因(p53、Bax和SOD)表达的qPCR分析,以GAPDH为内参。(G)氧化应激标志物(CAT、GPX1、SOD)和内参蛋白β-肌动蛋白的蛋白分析及定量。**:p<0.01;n=3。
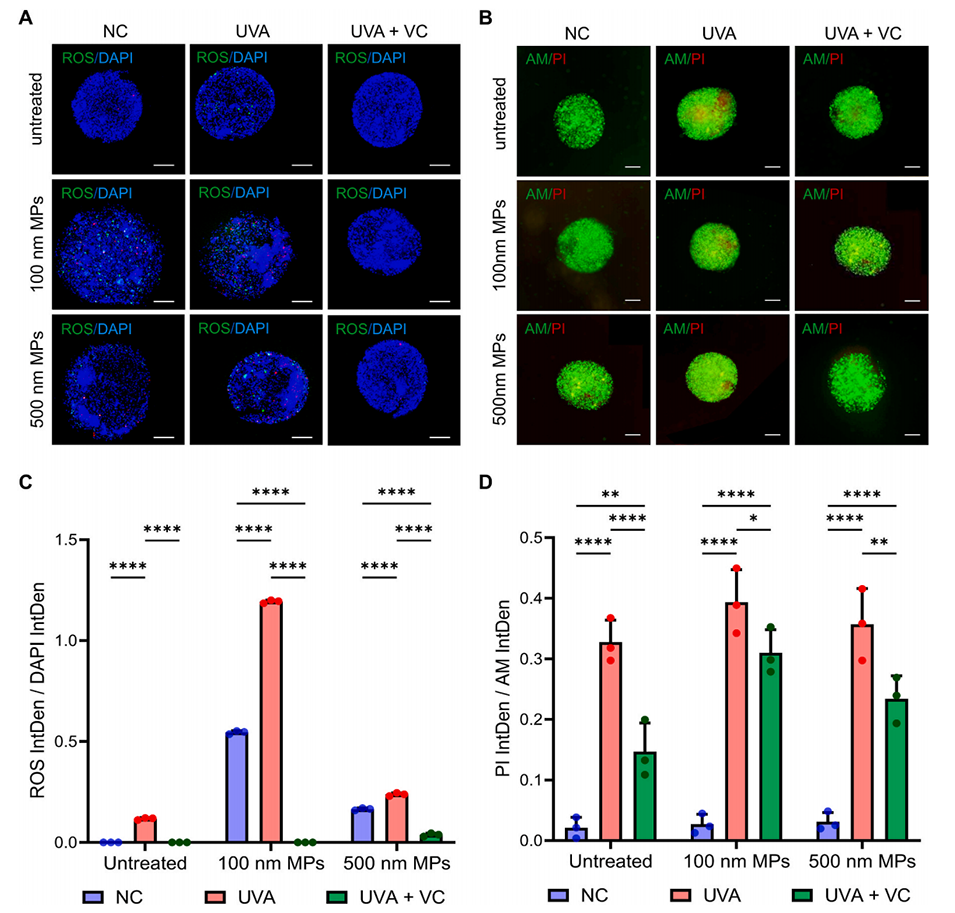
图5.维生素C(VC)处理后的表皮-真皮细胞类器官球。(A)荧光显微镜图像显示经UVA和UVA+VC处理后,与微塑料共培养的类器官球内活性氧损伤(绿色);比例尺:100μm。(B)未处理、微塑料-UVA处理及微塑料-UVA+VC处理的类器官球的钙黄绿素AM(AM)和碘化丙啶(PI)活死染色;比例尺:100μm。(C–D)使用Prism 10.4.1生成的显示微塑料-UVA和微塑料-UVA+VC暴露后氧化应激的强度轮廓图。
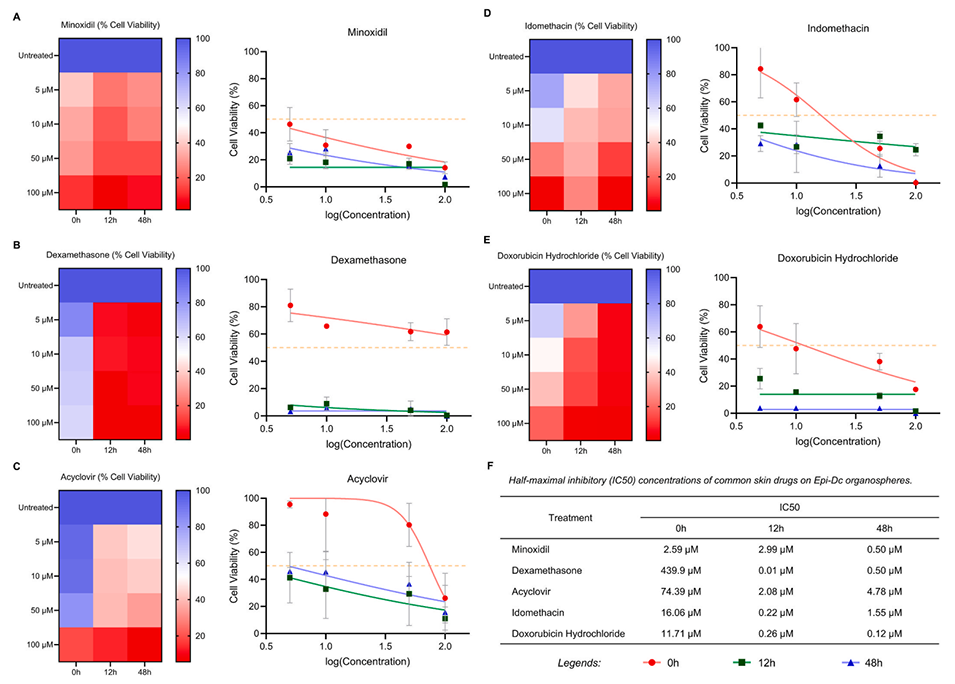
图6.利用表皮-真皮细胞类器官球评估皮肤相关药物。(A–E)不同浓度(5μM、10μM、50μM和100μM)的米诺地尔、地塞米松、阿昔洛韦、吲哚美辛和盐酸多柔比星的细胞活力测定。(F)各处理在暴露0、12和48小时后的半数抑制浓度(IC50)值。
论文链接:https://doi.org/10.1016/j.biomaterials.2025.123513














