水凝胶因其与细胞外基质(ECM)相似的结构和可调的理化性质,成为极具潜力的3D细胞培养支架。微流控技术通过精确控制流体,实现了水凝胶微球和微纤维的高精度制备,为可扩展的3D组织组装提供了模块化单元。结合3D生物打印技术,这些结构可进一步构建复杂空间构型。微流控与生物打印的协同整合克服了传统3D培养的局限(如静态微环境和低分辨率),并赋予体系微尺度异质性、动态剪切流和梯度生成能力,显著推动了类器官和器官芯片的发展。

近期,四川大学国家生物医学材料工程技术研究中心肖芸团队在中科院1区TOP期刊《Acta Biomaterialia》发表题为“Microfluidic-assisted engineering of hydrogels with microscale complexity”的综述文章。该综述系统探讨了三方面内容:(1)微流控制备水凝胶微球与微纤维的策略;(2)微流控技术与3D生物打印技术的整合;(3)上述技术在类器官及器官芯片中的变革性应用。
一张图读懂全文:
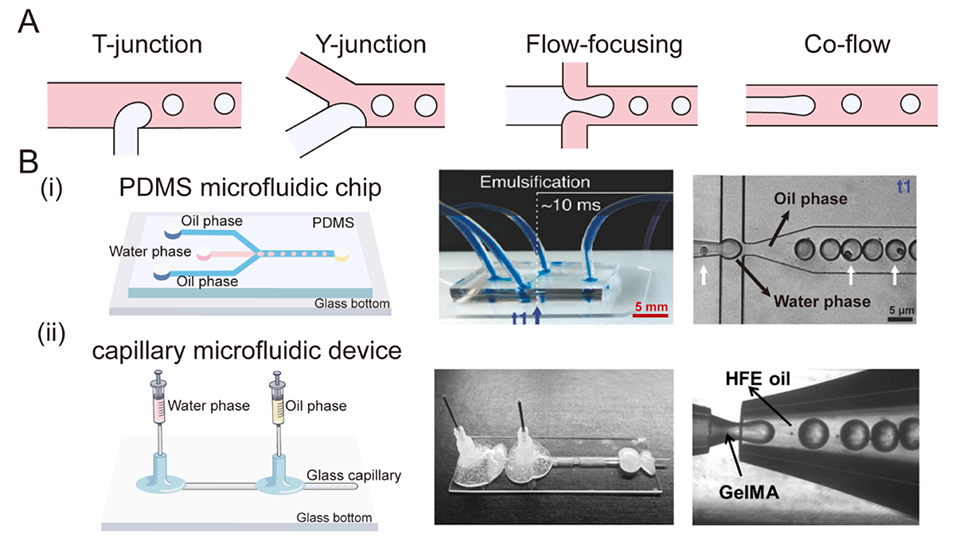
图1. A:微流控装置中用于生成水凝胶微球的通道几何结构。微流控装置主要有四种基本类型:T型结、Y型结、流动聚焦型、共流型。B:用于制备微流控水凝胶微球的装置及其各自的实验图像。(i)PDMS微流控芯片。(ii)毛细管微流控装置。
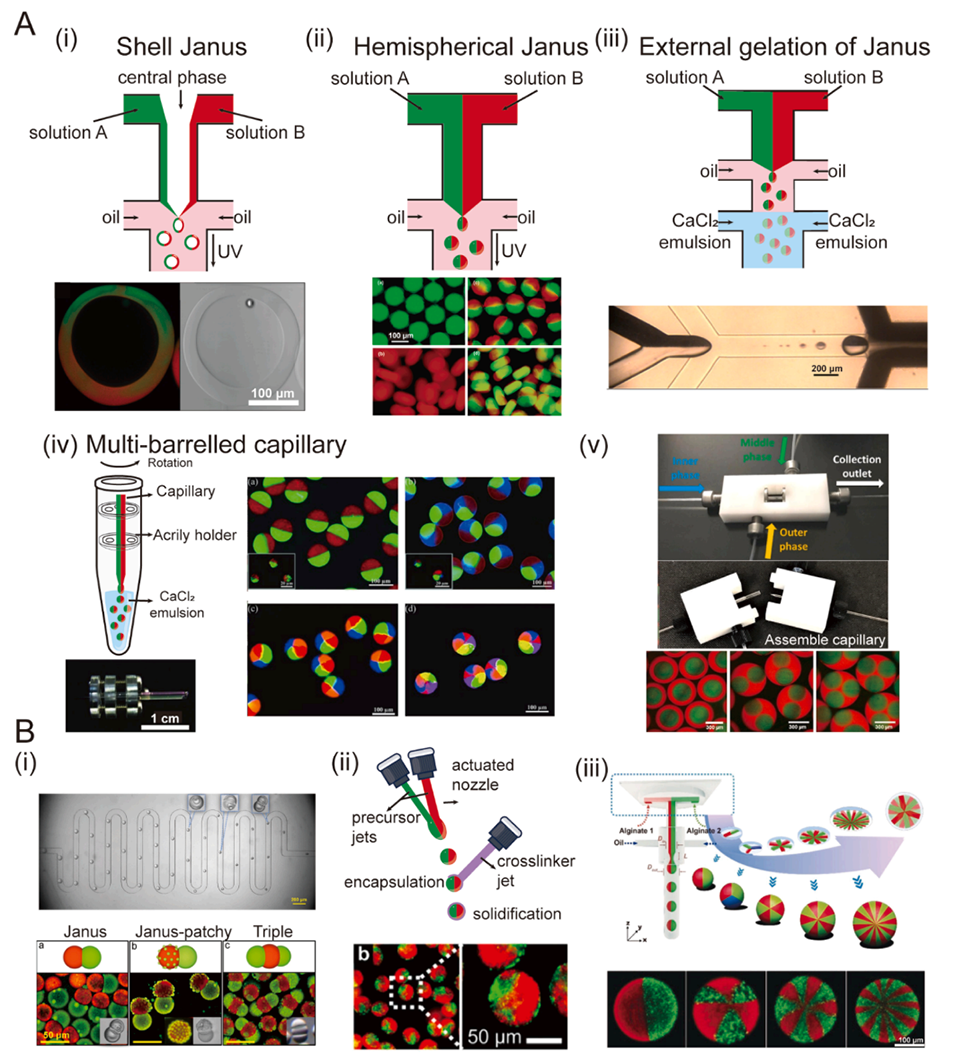
图2. A:经典Janus水凝胶微球的微流控设计。(i)由三个独立流形成水凝胶微球的微流控装置示意图。下图展示了实验中获得的中空Janus壳层的荧光图案和明场显微照片。(ii)一种带有两个Y型结的微流控装置用于制备Janus微球,以及通过该装置获得的不同形状水凝胶微球的荧光图像。(iii)通过外部凝胶法制备Janus水凝胶微球的示意图。通过控制两个上游输入,可制备负载半球形磁性纳米颗粒的Janus水凝胶微球。(iv)基于离心的多管毛细管装置可用于获得具有轴对称几何形状的多室水凝胶颗粒。(v)一种新型可自由拆卸和组装的玻璃毛细管装置。该新型装置通过移动内部毛细管来创建多核液滴。B:基于各种材料的其他微流控装置。(i)带有流动聚焦结构并结合相分离系统的微流控芯片示意图,以及制备出的具有Janus、Janus patchy和三重结构的微球。图中展示了Janus液滴在连续弯曲通道中的相分离全过程。(ii)用于生成Janus微球的“空气微流控”(IAMF)概念图。(iii)利用微流控芯片与毛细管装置集成的微球生成器,实现了六室、十室和二十室微球的制备。
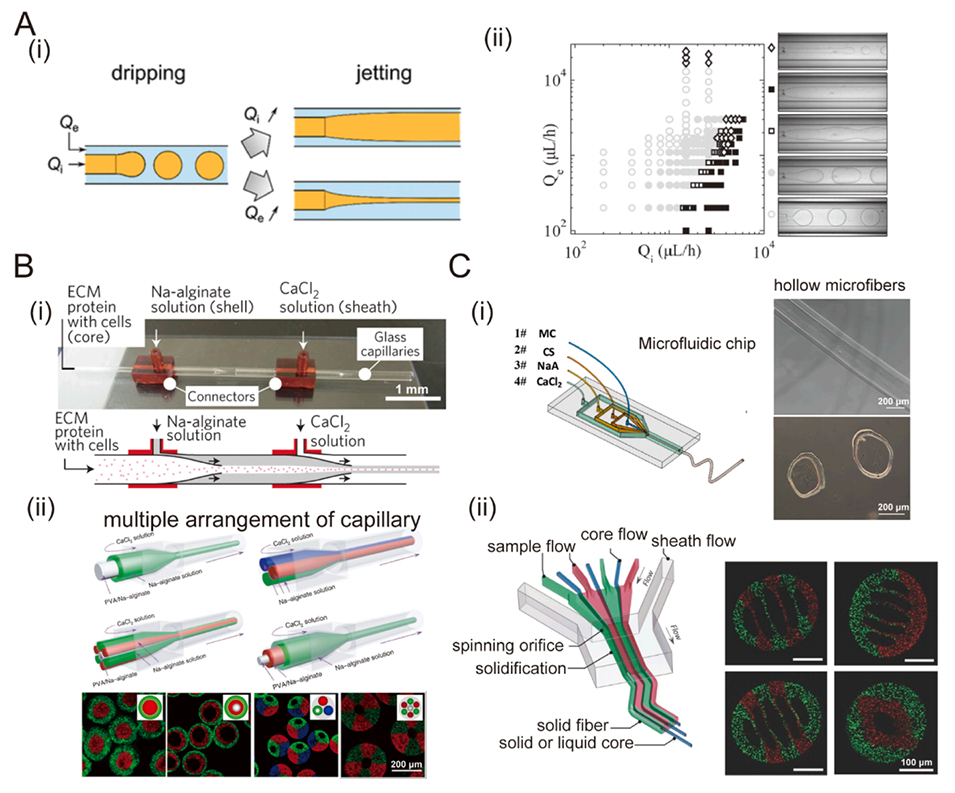
图3. A:(i)通过增加内相Qi或外相Qe的流速,在微流控结构中实现滴落-喷射转变。(ii)相图展示了在共流微流控装置中观察到的模式变化。B:(i)使用双同轴微流控装置制备的细胞包封水凝胶微纤维。(ii)用于生成核-壳型、多核型、多层型、多组分水凝胶纤维的毛细管装置示意图。C:(i)用于制造水凝胶纤维的微流控芯片及水凝胶纤维的图像。(ii)微流控芯片具有多个不同深度的平行凹槽结构,可提供海藻酸盐和水用于生成分离的多种Janus多孔纤维。
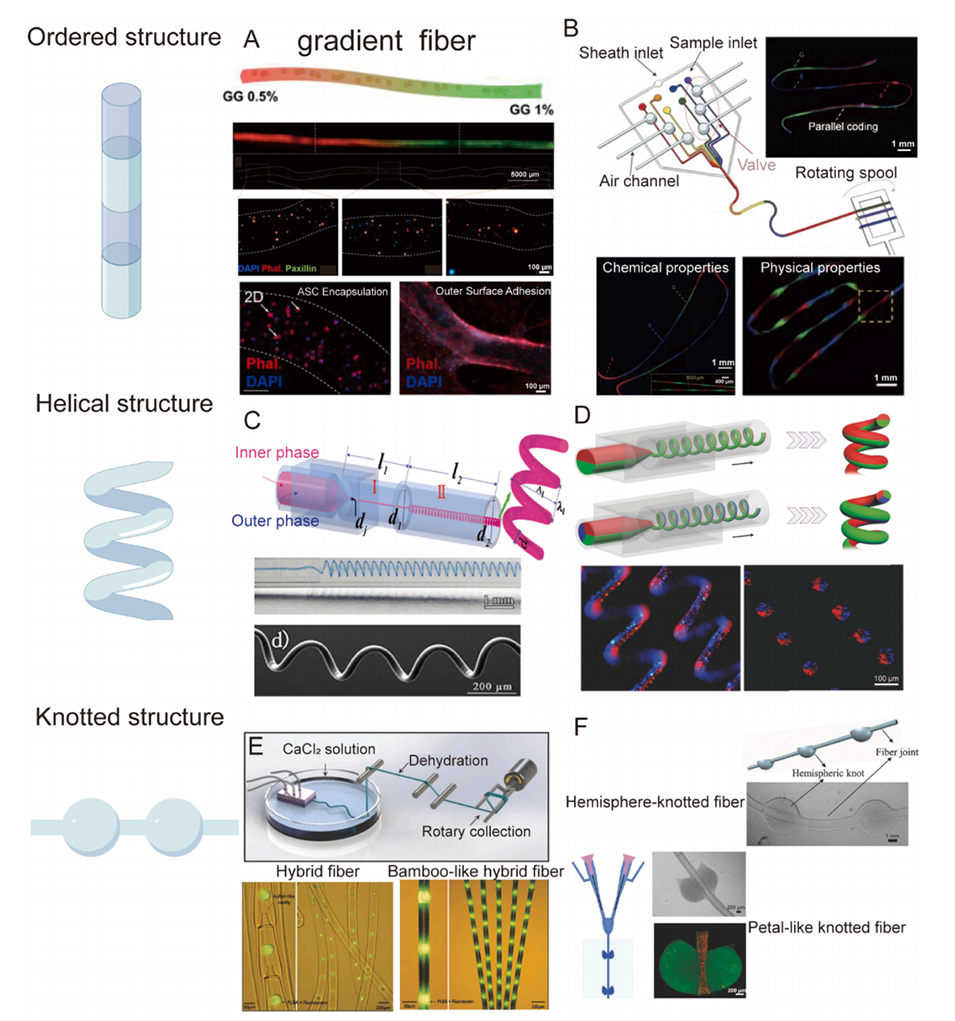
图4. 通过微流控技术控制纤维的形态:有序结构、螺旋结构和打结结构。A:梯度水凝胶纤维以及梯度中不同的细胞响应。B:纵向生成的具有不同化学和物理性质的区域。C:通过毛细管微流控装置生成的螺旋纤维。D:微流控制备的多组分螺旋水凝胶纤维。E:带有三个流动通道的平面芯片生成的竹节状纤维。F:半球形打结纤维和花瓣状打结纤维的形成。
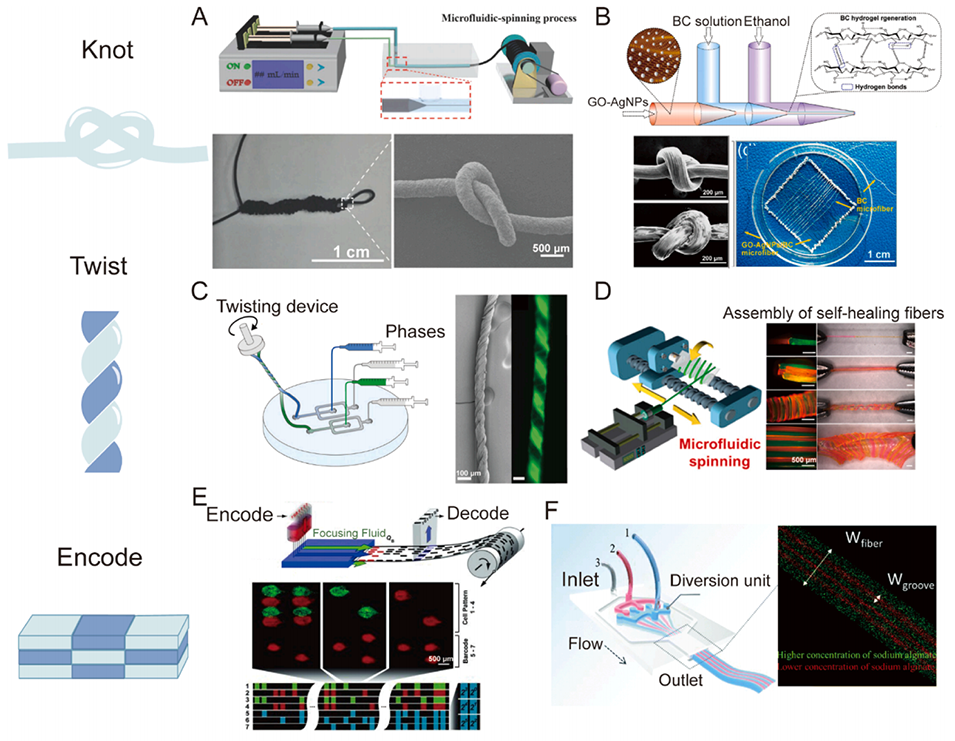
图5. 微流控水凝胶纤维之间的相互作用。A:微流控纺丝后紧密打结的纤维。B:同轴微流控装置制备的具有优异机械强度和柔韧性的水凝胶纤维,并进行了织物演示。C:通过电机旋转将纤维扭转在一起。D:微流控纺丝水凝胶纤维构建水凝胶阵列,以进一步组装多维材料。E:马赛克水凝胶中的动态编码信息。F:用于制造带沟槽微纤维的多通道微流控芯片。
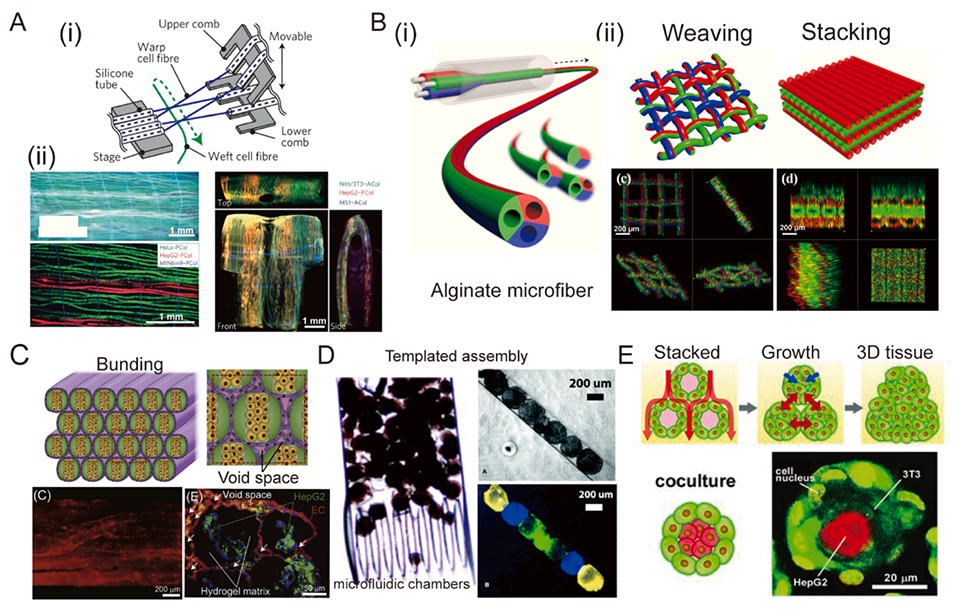
图6. 复杂3D组织的构建单元。A:(i)用于制造3D细胞结构的微流控“器官编织”装置。(ii)复合水凝胶微纤维的编织应用。B:(i)带有三个平行注射毛细管和支架的微流控装置。(ii)通过编织或堆叠纤维,制备出具有可调节化学组成和物理结构的水凝胶纤维。C:水凝胶纤维被捆绑并培养成多细胞肝组织。D:包含三组不同标记细胞的凝胶模块的模板组装。单分散水凝胶微球与另一种细胞类型包封成3D组织结构。
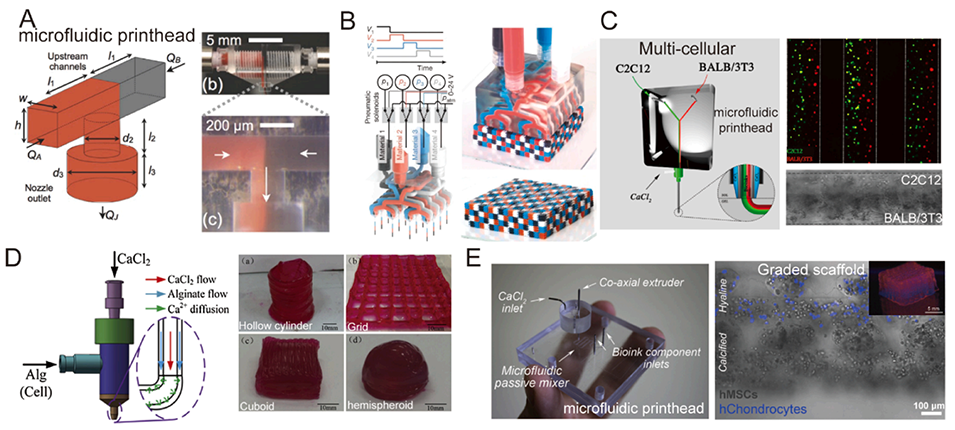
图7. 微流控打印头的结构和研究进展。A:多材料微流控打印头示意图。B:使用4×4喷嘴和四种材料进行MM3D打印产生的体素化物质。C:通过微流控打印头对C2C12成肌细胞和BALB/3T3成纤维细胞进行3D生物打印。D:使用同轴喷嘴辅助的3D生物打印系统打印3D海藻酸盐结构。E:由微流控打印头和同轴适配器组成的微流控挤出系统,展示了打印的3D生物打印梯度支架。
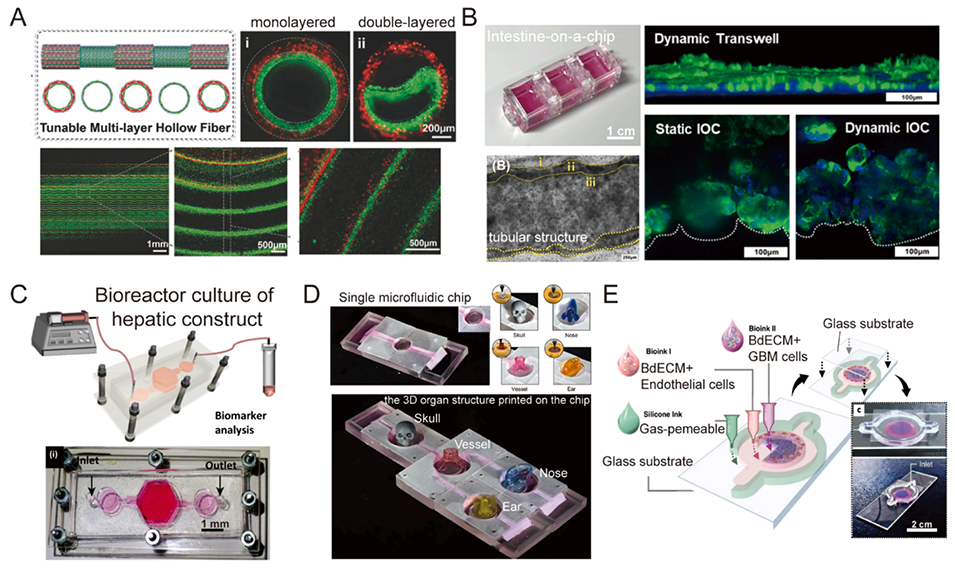
图8. 应用于不同器官的微流控器官芯片。A:双层中空管的示意图,以及双层到单层中空管的动态转换。B:类似小肠的预期管状结构,以及Transwell和肠芯片的静态培养与动态培养对比。C:肝脏微流控芯片平台的制造:在装置中构建微组织生物打印,随后组装生物反应器芯片并灌注细胞培养基。D:单个微流控芯片和多器官微流控芯片上3D器官结构的示意图。E:在微流控芯片上使用各种生物墨水打印胶质母细胞瘤,以构建分区结构。
论文链接:https://doi.org/10.1016/j.actbio.2025.05.023














