一、实验背景
在组织工程和细胞递送领域,多孔微球因其高比表面积、良好的生物相容性和优异的细胞负载能力而备受关注。然而,传统乳化法往往难以精确控制微球的粒径和孔隙结构,导致微球的均匀性和性能不稳定。微流控技术作为一种新兴的微球制备方法,能够通过精确控制流体流动和乳化条件,实现微球粒径和孔隙结构的高度可控性。
本实验通过将传统乳化和微流控技术结合,制备基于聚乳酸-羟基乙酸共聚物(PLGA)的多孔微球,既保证了初乳化的效率,又提高了最终产品的均一性和结构控制,满足细胞递送和组织工程对微球性能的高要求。
二、实验目标
利用微流控技术制备PLGA多孔微球。
优化制备条件以获得均匀尺寸和高孔隙率的微球。
实验材料与设备
一、材料与仪器
主要材料、试剂
明胶(Gelatin),PVA,PLGA,去离子水,二氯甲烷(DCM)
主要仪器
MONO型号毛细管液滴微流控芯片;

液滴微流控工作站:MF-3G;

体式显微镜;倒置显微镜;高速相机。
四、实验步骤
1、均相乳化法制备水包油初级乳液
水相:7.5%(w/v)的明胶水溶液
油相:2%(w/v)的PLGA二氯甲烷溶液
方法:按照水油体积比为1:2,利用超声乳化,得到水包油初级乳液后静置。
2、微流控制备微液滴:
内相:均相乳化法制备水包油初级乳液
外相:1%(w/v)PVA水溶液
收集相:同连续相,收集瓶置于冰浴中
将一定量的内相、外相溶液分别抽取到10毫升规格的注射器中,并将其固定在工作站的注射泵上。
使用特氟龙(PTFE)导管,一端通过鲁尔接头与各注射器连接,确保连接牢固无泄漏。另一端通过倒锥接头与微流控芯片(MONO芯片)进液口连接。
将特氟龙导管通过倒锥接头与芯片的收集口连接,作为收集管使用,以便收集生成的乳液液滴。
确保收集管的出液端浸没在收集相中,以便乳液液滴能够顺利进入收集相。
在工作站上设定各相相的流速。首先启动外相溶液,确保通道完全充满。
外相稳定后,再开启内相溶液。
通过调节两相溶液的流速,控制乳液液滴的尺寸。
将生成的乳液液滴收集至含收集相的瓶中,将其置于4°C冰箱中过夜以进一步稳定。

微流控制备PLGA微液滴

MONO芯片内PLGA微液滴实时生成画面
3、多孔微球:
最后,通过清洗和冷冻干燥,得到了具有高孔隙率和均匀孔径分布的PLGA多孔微球。
清洗
去除DCM:玻璃棒搅拌1小时去除残留DCM。
去除PVA:去离子水进行多次水洗,去除残留的PVA。
去除明胶:将微球置于37°C水浴中30分钟,溶解明胶,再用去离子水冲洗多次。
冷冻干燥
预冻:将清洗后的微球在-80°C冷冻24小时。
干燥:进行冷冻干燥,去除水分。
保存:干燥后的微球置于-20°C保存,备用。
五:实验结果与结论
1、微球形貌:
实验结果表明,PLGA微球具有均匀的粒径和开放孔隙,孔隙相互连通。
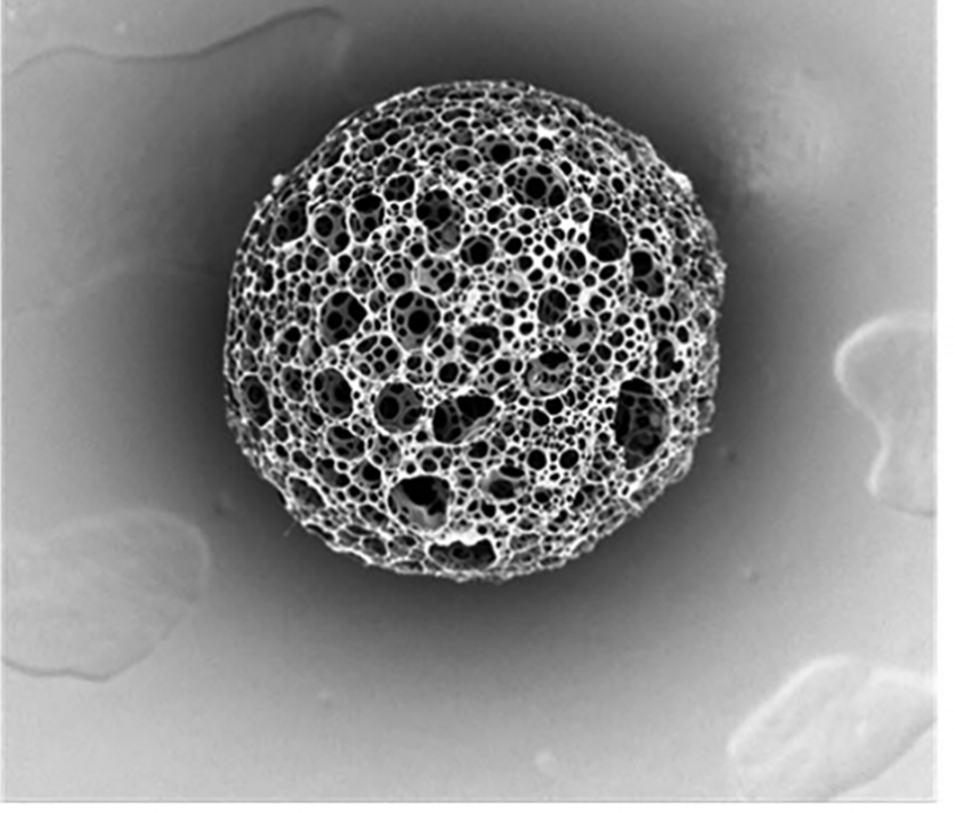
PLGA多孔微球SEM图
(图片引自Small 2019, 15, 1901397,展示了类似制备条件下微球的典型结构,仅供参考)
五、结论
本实验成功利用微流控技术制备了具有均匀粒径和高孔隙率的PLGA微球,该技术为组织工程和药物筛选提供了新的材料平台。
实验小贴士:实验中如何确保微球的均匀性?
在实验中确保微球的均匀性是至关重要的,因为这直接影响到微球的性能和应用效果。以下是一些确保微球均匀性的关键步骤和技巧:
1、精确控制乳化过程:
使用精确的流量控制:在微流控装置中,连续相和分散相的流速需要精确控制。流速的波动会导致微球大小的不均匀。
保持稳定的乳化条件:乳化过程中的温度、压力和超声功率等参数需要保持一致,以确保乳化液滴的大小均匀。
2、优化微流控装置:
选择合适微流控芯片:选择高质量且适合实验需求的芯片,可以显著提高微球的尺寸均一性。
保持毛细管芯片内部清洁:芯片堵塞或污染会导致微球大小的不一致。定期清洁微流控芯片,并确保所有配制的溶液在与设备连接前通过0.2微米孔径的过滤器进行过滤,以去除杂质,从而确保微球的均匀性。
3、使用高质量的材料:
确保PLGA和明胶等的质量和纯度:材料的质量和纯度对微球的均匀性有重要影响。使用高纯度的材料可以减少微球尺寸的变异性,从而提高实验的可重复性。
4、一致的后处理步骤:
溶剂提取和冷冻干燥:溶剂提取和冷冻干燥过程应在一致的条件下进行,以确保微球的大小和孔径分布均匀。
通过上述步骤和技巧,可以有效地确保微球的均匀性,从而提高实验的可重复性和微球的应用效果。