微藻培养是一种在受控条件下培育微藻的过程,旨在利用其生物学和生化特性进行多种应用,例如从微藻细胞中快速生产蛋白质、脂质和碳水化合物,这些生物质可用于生物燃料生产、碳捕获以及食品补充剂和药品的开发。近年来微流控技术在微藻研究中的应用,尤其是将培养过程微型化到微观尺度,不仅显著减少了细胞、培养基及营养物质的用量,还提供了更高效的样品制备、更好的培养条件控制,并降低了污染风险。同时,液滴微流控技术的崛起为微藻研究带来了新的研究方法,可以通过生成离散的微液滴对微藻进行包埋及培养,极大地推动了单细胞水平的深入研究和复杂生长环境的模拟分析。

近期,有研究人员利用液滴微流控技术结合外部凝胶化方法生成单分散海藻酸钙水凝胶珠,用于包埋和培养小球藻(Chlorella vulgaris),验证了其在微藻稳定生长和受控培养中的应用潜力。相关研究以“Microfluidic Generation of Calcium Alginate Hydrogel Beads using External Gelation for Microalgae Cultivation”为题发表于期刊《ChemNanoMat》。
本文要点:
1、本研究采用液滴微流控技术结合外部凝胶化方法制备了单分散海藻酸钙水凝胶珠,用于包埋和培养小球藻。
2、含有乳化钙离子的乳液作为交联相,初步几何分析表明,当钙离子浓度为1 g/mL时,生成的水凝胶微珠在尺寸均匀性和形状一致性方面表现最佳。
3、在为期5天的培养实验中,水凝胶微珠展现了显著的结构稳定性,小球藻在其内持续稳定生长,仅在培养末期观察到轻微的细胞泄漏现象。
4、这种创新方法为微藻培养提供了一种新平台,展现了在受控生长环境构建与生物技术领域的广泛应用潜力。
海藻酸钙水凝胶微球的制备步骤如下:
1、前期准备:
分散相制备:
空白微球:使用质量浓度为1%的海藻酸钠(Sodium Alginate)溶液。
含包埋小球藻(Chlorella vulgaris)的微球:将预培养的小球藻菌液与质量浓度为2%的海藻酸钠溶液以1:1的体积比混合。
连续相制备:
第一连续相:将矿物油与Span® 80表面活性剂(质量浓度5%)混合。
第二连续相(用于交联):将矿物油(含Span® 80,质量浓度25%)与氯化钙(CaCl2)溶液按1:5(水相:油相)的比例混合并超声乳化,制备稳定的油包水(W/O)乳液。
2、微流控装置的使用:
将微流控装置放置在倒置显微镜下,连接注射泵,按以下流速注入液体:
分散相(海藻酸钠溶液)从入口1输入,流速为400 µL/h。
矿物油连续相分别从入口2和入口3输入,流速均为1000 µL/h。
初始阶段仅引入矿物油连续相,确保第一交叉结形成稳定的水滴,防止因早期交联导致装置堵塞。
待水滴稳定形成后,将入口3的矿物油连续相替换为含氯化钙的乳液,以引发乳液中的钙离子与海藻酸钠液滴之间的交联反应,形成海藻酸钙微球。
3、微球的收集与交联:
收集出的微球被置于含氯化钙溶液(质量浓度05 g/mL)的离心管中,进一步完成交联。
整个微球收集操作持续2分钟,预计获得约300-400个微球。
4、微球的提取与清洗:
通过振荡混匀和离心分离去除油相,得到含有微球的水相。
用氯化钙溶液(质量浓度05 g/mL)多次冲洗微球,直到无乳液残留。
清洗后的海藻酸钙微球可以用于后续的生长实验和几何性状分析。
上述步骤结合微流控技术和外凝胶化方法,制备出高度均一化、形状规则的海藻酸钙微球,用于小球藻的包埋培养实验。
外部凝胶法与内部凝胶法在水凝胶微珠制备中的主要区别在于:
1、交联离子的来源与释放方式:
内部凝胶法:交联离子(如钙离子)直接嵌入分散相内,通常以弱溶解性钙盐(如碳酸钙或Ca-EDTA)的形式存在。这些钙离子在遇到酸化环境(如酸化油相)时缓慢释放,从而触发凝胶化反应。
外部凝胶法:交联离子(如钙离子)存在于连续相中,通常通过将高水溶性钙盐(如氯化钙)乳化后引入油相。钙离子由连续相向分散相迁移,实现凝胶化。
2、操作复杂性与器件堵塞风险:
内部凝胶法:由于快速发生的凝胶化反应,容易在微流控通道的交叉点处引起堵塞,尤其是在使用高浓度钙盐时。此外,该方法机制复杂,需要使用特殊的盐类,并通过精确控制释放速率来避免器件失效。
外部凝胶法:通过钙离子乳液的逐步迁移来进行交联凝胶化,反应速率较慢,可以显著减少通道堵塞的风险,适合更高效和稳定的微珠生成。
3、结构均一性与微珠形态:
内部凝胶法:由于快速的凝胶化反应,生成的微珠尺寸和形态的一致性可能较差,尤其在交联离子释放不均时。
外部凝胶法:通过逐步迁移的钙离子实现均匀交联,能显著提高微珠的尺寸一致性(单分散性)和形态稳定性。
4、生物适配性:
内部凝胶法:可能引入较高浓度的未反应钙盐或副产物,因此在生物体系下的应用可能需要进一步优化。
外部凝胶法:由于控制性较好,更适合用于包埋和培养生物细胞(如微藻或干细胞),且被认为是一种相对更加环保和生物亲和的方法。
总体而言,外部凝胶法在生成单分散水凝胶微球、减少设备堵塞以及应用于生物体系时显示出明显优势。
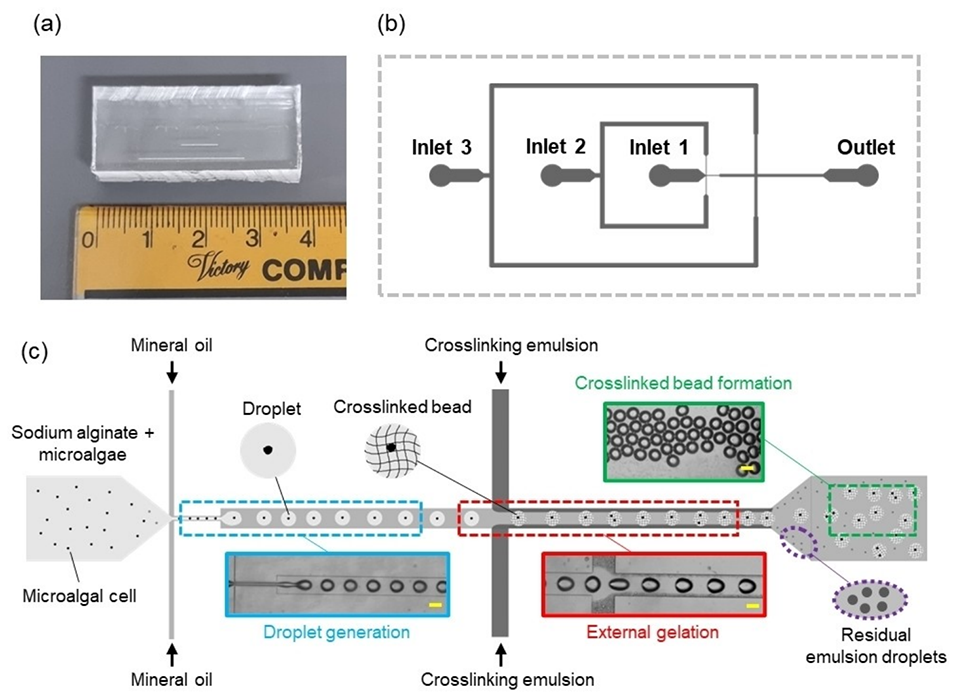
图1.用于生成海藻酸钙水凝胶微珠的微流控装置:(a)微流控装置的实物图;(b)微通道设计,3个入口和1个出口;(c)微流控生成包封微藻的海藻酸钙水凝胶微球示意图。比例尺表示100μm。
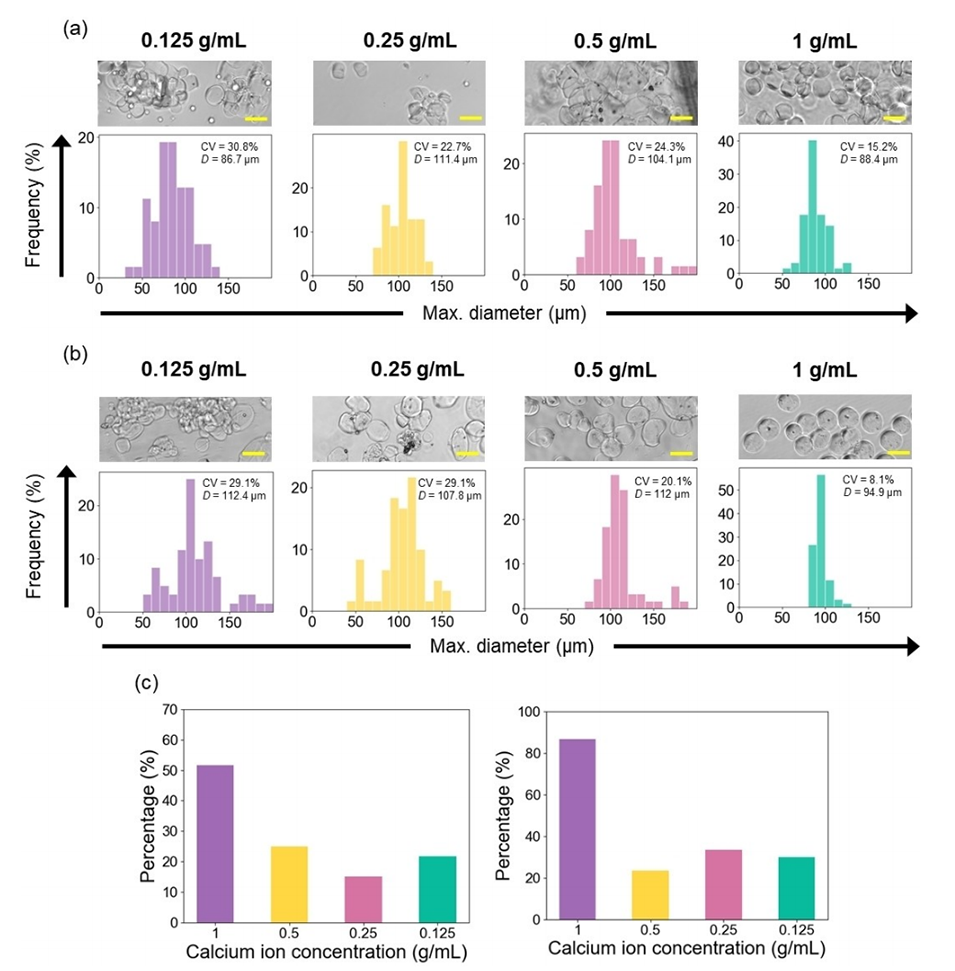
图2.不同钙离子浓度交联的海藻酸钙水凝胶微球的几何分析,(a)空白微球和(b)包封微藻的微球的显微图像以及粒径分布;(c)高度球形(球形度S<0.05)的空白微球(左)和包封微藻的微球(右)的比例。D值表示最大直径的平均值。比例尺表示100μm。

图3.明场显微图像和荧光图像显示微藻细胞在海藻酸钙水凝胶微珠(钙离子浓度1g/mL)中的生长情况,培养时间为5天。在荧光图像中,包封微藻细胞的微球的边界用白色虚线圆圈标记。比例尺表示100μm。
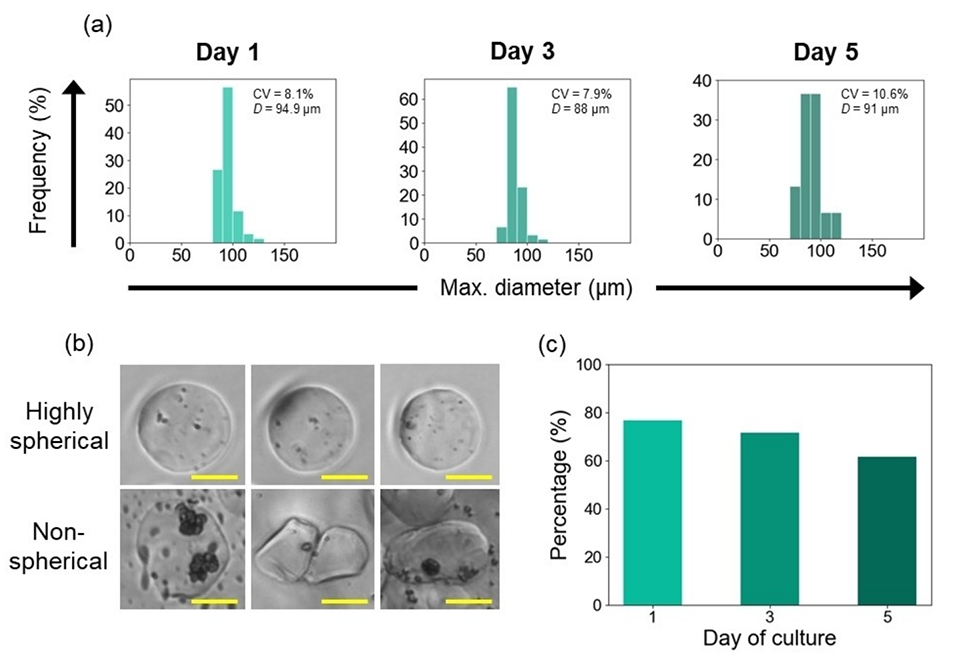
图4.海藻酸钙水凝胶微球在5天培养期内的几何变化:(a)培养期内的粒径分布;(b)典型的高度球形和非球形珠的显微图像;(c)高度球形的水凝胶微珠的比例(球形度S<0.05)。Max.D表示最大直径的平均值。比例尺表示50μm。
论文链接:https://doi.org/10.1002/cnma.202400549














