
近期,西南交通大学王垚磊副教授、郭建秀老师与无锡市第五人民医院刘洪副主任医师合作,提出了一种新的策略,通过液滴微流控和占位符生成多孔GelMA微球,作为构建三维空间可控细胞共培养的支架。多孔GelMA微球的孔径、孔隙数量和粒径均可以灵活调控。相关研究以“Microfluidic Droplet-Based Tailorable Porous GelMA Microspheres for 3D Spatio Controllable Cell Coculture”为题目,发表在期刊《Advanced Materials Technologies》上。
本文要点:
1、本研究提出了一种基于液滴微流控技术结合占位符的简便方法,用于制备具有可定制孔隙结构和尺寸的GelMA微球,以构建具有空间可控细胞分布的3D共培养模型。
2、研究中利用ATPS(双水相体系)乳液模板生成占位符,并通过UV交联和螯合反应形成多孔GelMA微球。
3、以肝细胞癌(HCC)模型为例,将HepG2细胞封装在微球外侧,HUVEC细胞封装在孔隙内,结果表明,3D共培养模型中的细胞活性、增殖能力和药物抗性均优于对照组。
4、该方法为体外构建3D组织模型提供了一种新途径,可用于组织工程、细胞运输和药物筛选等领域。
多孔GelMA微球的具体制备步骤如下:
1、制备ATPS体系:
将8 g的聚乙二醇(PEG, 8 kDa)和8 g的右旋糖酐(Dex, 500 kDa)加入到含有84 mL无菌水的烧杯中,搅拌12小时以达到相平衡,上层为PEG富集相,下层为Dex富集相。
2、制备Alg-Ca微球(占位符):
将1 wt%的Dex-Alg溶液加入到Dex富集相中,并将10 wt%的CaCl2溶液加入到PEG富集相中以制备PEG-CaCl2溶液。
通过振荡混合Dex-Alg和PEG溶液(体积比为1:3),形成Dex-Alg/PEG乳状液。
然后将乳状液注入10 wt% PEG-CaCl2溶液中进行离子交联,形成单分散的Alg-Ca微球。
3、多孔GelMA微球的生成:
将Alg-Ca微球与GelMA前体溶液按照1:3的体积比混合,形成分散相。
用注射泵将分散相以20 μL/min的流速泵入液滴微流控装置,同时以100 μL/min的流速泵入连续相(植物油)。
在液滴生成单元中形成液滴后,通过紫外线交联固化,生成Alg-Ca/GelMA微球。
4、形成多孔结构:
用50 mM EDTA溶液螯合去除Alg-Ca微球,从而在微球内部形成多孔结构。
5、纯化与灭菌:
用PBS对生成的GelMA微球清洗3-5次以去除残留的植物油,并使用10%灭菌链霉素和青霉素PBS溶液进一步清洗。
紫外线灭菌12小时。
上述步骤确保制备的多孔GelMA微球具有优异的单分散性和良好的生物相容性,适用于3D细胞培养及组织工程应用。
所制备的多孔GelMA微球在3D共培养模型中具有以下优势:
1、空间可控的细胞分布
GelMA微球支持异质细胞的空间分布,将不同细胞精准地封装在指定位置(例如HUVEC细胞在孔隙内,HepG2细胞在孔隙外),能够更好地模拟体内组织微环境。
2、良好的生物相容性与可定制物理特性
GelMA具有优异的生物相容性,且其孔隙结构和尺寸可以通过占位符技术灵活调整,从而适配不同细胞和组织模型需求。
3、改善营养和废物交换
多孔GelMA微球结构通过提高氧气和营养物质的扩散能力,同时促进代谢废物的排除,解决了传统非多孔微球在扩散受限方面的缺陷。
4、确保细胞增殖与活性
在3D共培养模型中,GelMA微球内部和表面提供更优越的附着与生长环境,显著提高了细胞的生长和代谢活性。
5增强功能表现
GelMA微球模型在功能蛋白分泌(如白蛋白和MRP)以及抗药性(如对DOX和CIS)方面均优于对照模型,显示出卓越的生物学功能模拟能力。
在研究中,HCC共培养模型在第7天显示出初步的血管化结构,进一步提升整体功能表现。

图1.制备多孔GelMA微球的示意图。
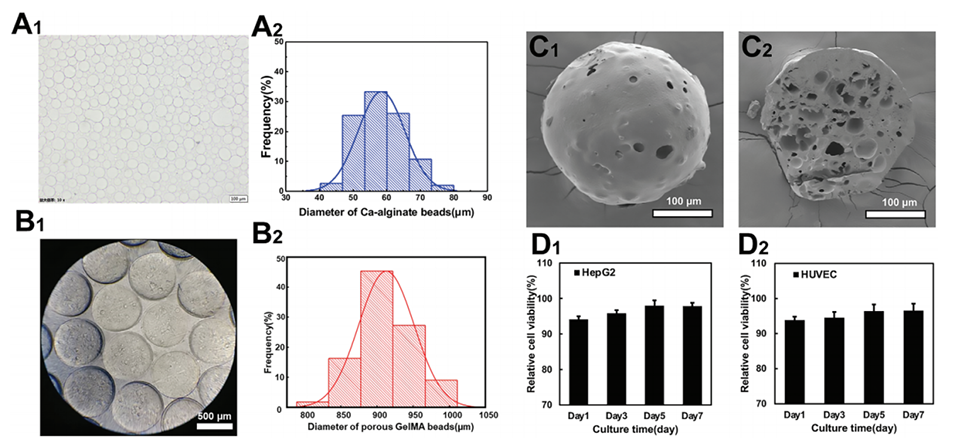
图2.多孔GelMA微球的特性。A1)海藻酸钙微球的光学图像。A2)海藻酸钙微球尺寸分布统计。B1)多孔GelMA微球的光学图像。B2)多孔GelMA微球尺寸分布统计。C1)多孔GelMA微球表面的SEM图像。C2)多孔GelMA微球横截面的SEM图像。D1)多孔GelMA微球对HepG2细胞的细胞毒性。D2)多孔GelMA微球对HUVEC细胞的细胞毒性。
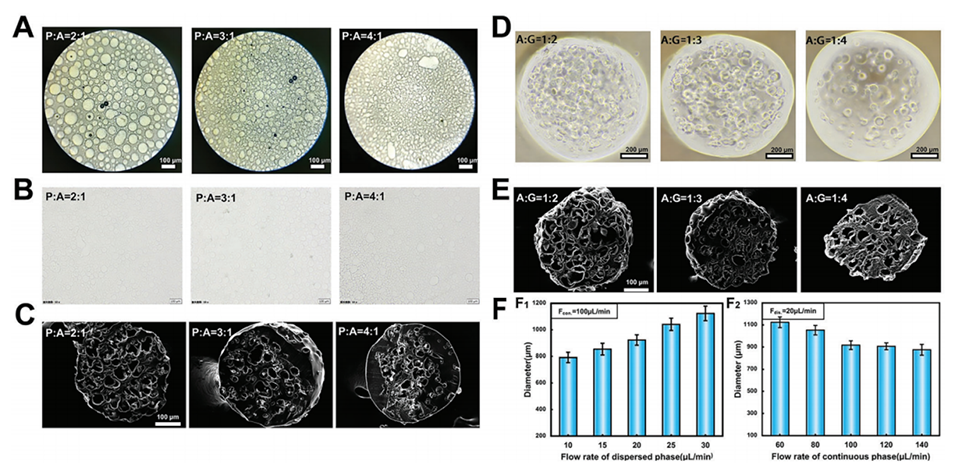
图3.A)w/w乳液的光学显微照片。B)不同直径海藻酸钙微球的光学显微照片。C)不同孔径的多孔GelMA微球的SEM图像。D)具有不同孔数的多孔GelMA微球的光学图像。E)具有不同孔数的多孔GelMA微球的SEM图像。F)分散相(F1)和连续相(F2)流速对多孔GelMA微球平均直径的影响。
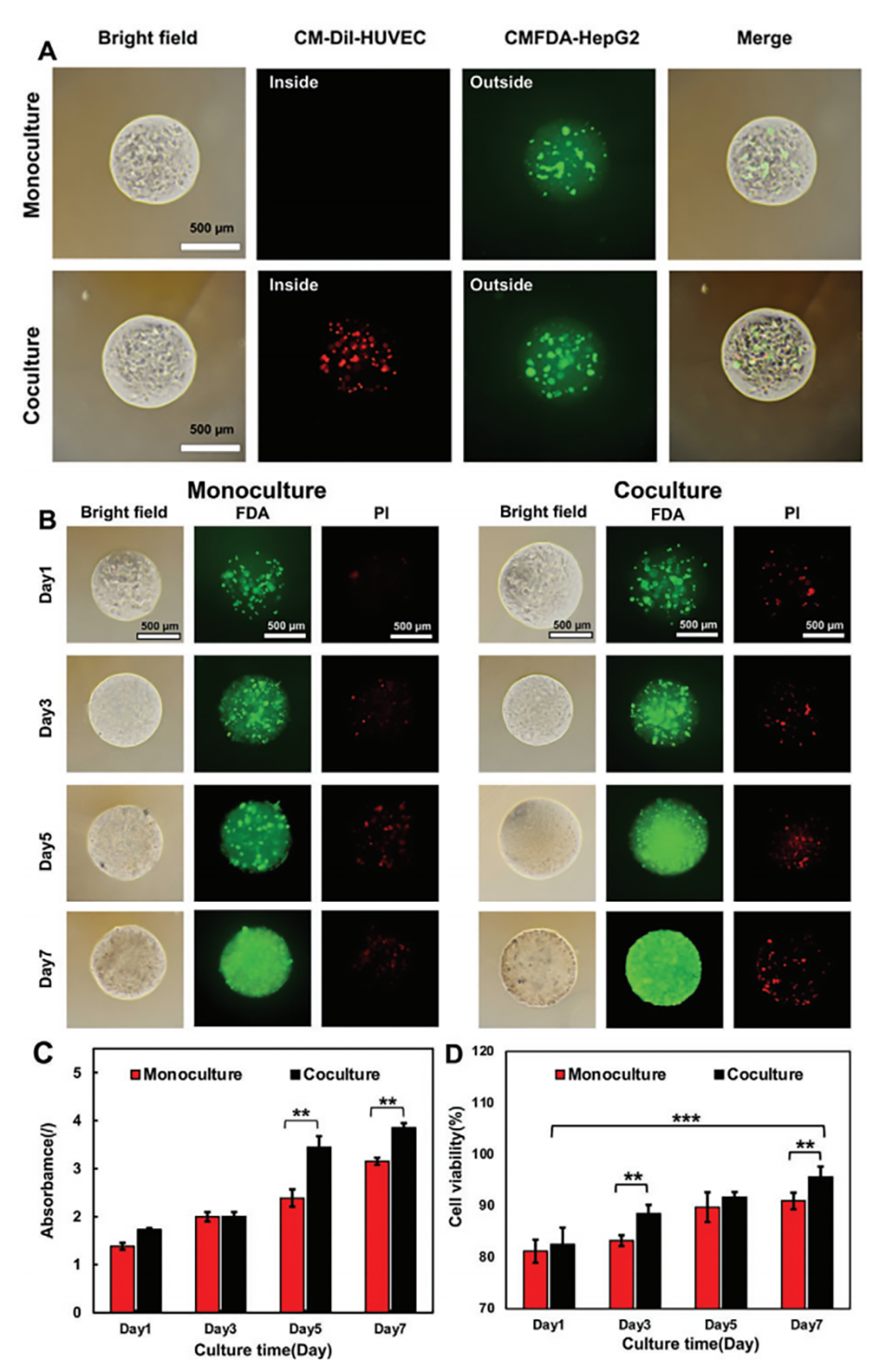
图4.两种3D HCC模型体外细胞存活和增殖的特征。
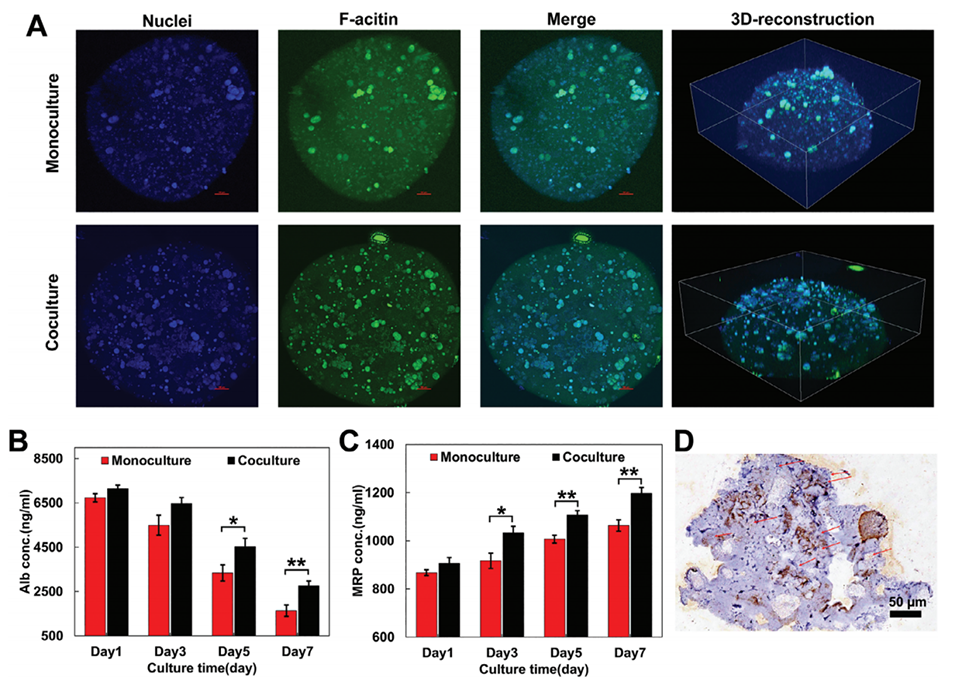
图5.两种体外3D HCC模型的细胞形态和功能蛋白特征。
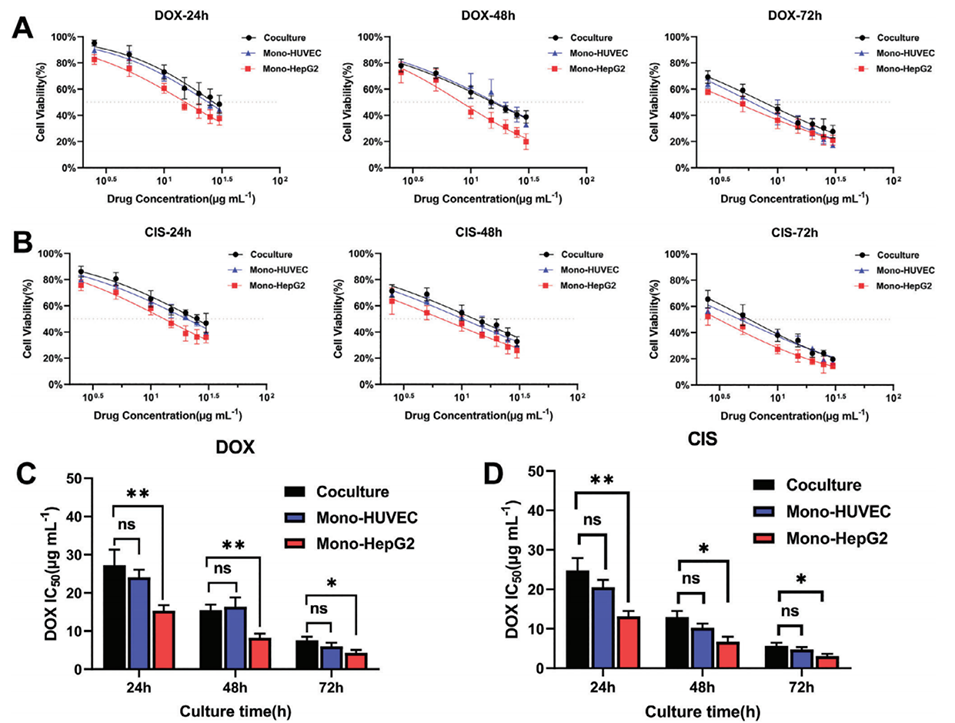
图6.体外3D模型的药物评估。A)用不同浓度的DOX孵育不同时间后细胞的相对存活率。B)用不同浓度的CIS孵育不同时间后细胞的相对存活率。C)不同模型对DOX的剂量反应。D)单培养和共培养HCC模型对CIS的剂量反应(*p<0.05、**p<0.01和***p<0.001)。
论文链接:https://doi.org/10.1002/admt.202301697














