胶质瘤是成人中枢神经系统中最常见的原发性恶性肿瘤,其预后极差,患者中位生存时间非常短。尽管标准治疗方案有所进展,但新药的开发和临床应用仍面临重大挑战。传统二维(2D)细胞培养模型无法准确模拟体内复杂的肿瘤微环境,而三维(3D)模型虽然有所改进,但在高通量药物筛选和广泛使用方面仍存在局限性。因此,开发能够高效、可靠地进行药物筛选的先进胶质瘤模型显得尤为迫切。

近期,成都中医药大学张艺教授与清华大学林金明教授、吴增楠博士等人合作,首次通过生物相容性气溶胶微流控技术构建了基于多室水凝胶微球的胶质瘤微模型。该微球具有工程化粗糙表面,可精准容纳多种肿瘤相关细胞并形成功能性内皮屏障,相比传统模型更贴近体内胶质瘤微环境。通过绿原酸药物测试验证,该模型能从基因、免疫、代谢多维度反映药物作用效果,为胶质瘤药物筛选提供了高效可靠的体外平台。相关研究以“Microfluidic Construction of Glioma Micromodels on Hydrogel Microspheres for Drug Testing”为题目,发表在国际权威期刊《Engineering》上。
本文要点:
1、该研究开发了一种基于水凝胶微球的胶质瘤微模型(glioma-on-a-microsphere),旨在为药物筛选提供更贴合生理环境的体外平台。
2、研究通过生物相容性气溶胶微流控技术,制备出具有粗糙表面的六室水凝胶微球,精准分隔 U251 胶质瘤细胞、M2 极化 THP-1 巨噬细胞,并在微球表面构建了功能性内皮屏障。
3、该模型具有高细胞活力(7 天培养期存活率 > 95%)、可控的分子通透性,且与传统二维培养相比,胶质瘤相关基因(Notch1、MMP9)表达上调,更贴近体内胶质瘤微环境。
4、以绿原酸(CGA)为模型药物进行验证,结果显示该模型可有效评估药物效果:CGA 能抑制胶质瘤相关基因表达、诱导巨噬细胞向抗瘤 M1 表型极化,且显著改变色氨酸、谷氨酸等关键代谢物水平,与体内药效一致。
5、该模型具备高通量、结构可控、生物相关性强等优势,为胶质瘤的药物筛选、疾病建模及个性化治疗研究提供了有力工具,未来可通过整合干细胞衍生细胞进一步提升生理相关性。
水凝胶微球的制备采用“微流控精准构形 + 气溶胶表面改性 + 离子交联固化”的三步协同工艺,核心流程可拆解为:
制备前准备
材料选择:以生物相容性中等粘度海藻酸盐为基底材料,搭配 1 mol・L⁻¹ CaCl₂溶液(交联剂)、荧光微球(结构示踪)、磁性纳米颗粒(空间定位)。
设备搭建:组装六通道 PDMS 微流控芯片(上游)、导电针(中游)、气溶胶喷射器(两侧)、CaCl₂收集池(下游),配套高速显微镜(实时监测)。
分散相配置:将 5% 海藻酸盐溶液与含荧光微球 / 细胞 / 磁性颗粒的生理盐水按 9:1 体积比混合,制备 6 种独立分散相(对应六室结构)。
微流控成滴与表面粗糙化
精准成滴:6 种分散相以总流速 2500 μL・h⁻¹ 通入微流控芯片,维持层流状态形成稳定六室流体结构;芯片出口施加 6000 V 高压电场,使流体在电场应力与重力协同作用下连续断裂为均匀液滴。
表面改性:液滴下落过程中,两侧气溶胶喷射器生成 CaCl₂雾滴,液滴与气溶胶碰撞后,表面发生局部非均匀离子交联(Ca²⁺与海藻酸盐羧基结合),形成不规则固化域,最终构建粗糙表面拓扑结构。
固化与收集
经气溶胶预交联的液滴落入含 CaCl₂的收集池,完成整体凝胶化,形成结构稳定的六室水凝胶微球;
最终微球尺寸均一(CV<4%),制备通量达 3 个 / 秒,可通过调整电场强度或海藻酸盐流速精准调控直径。
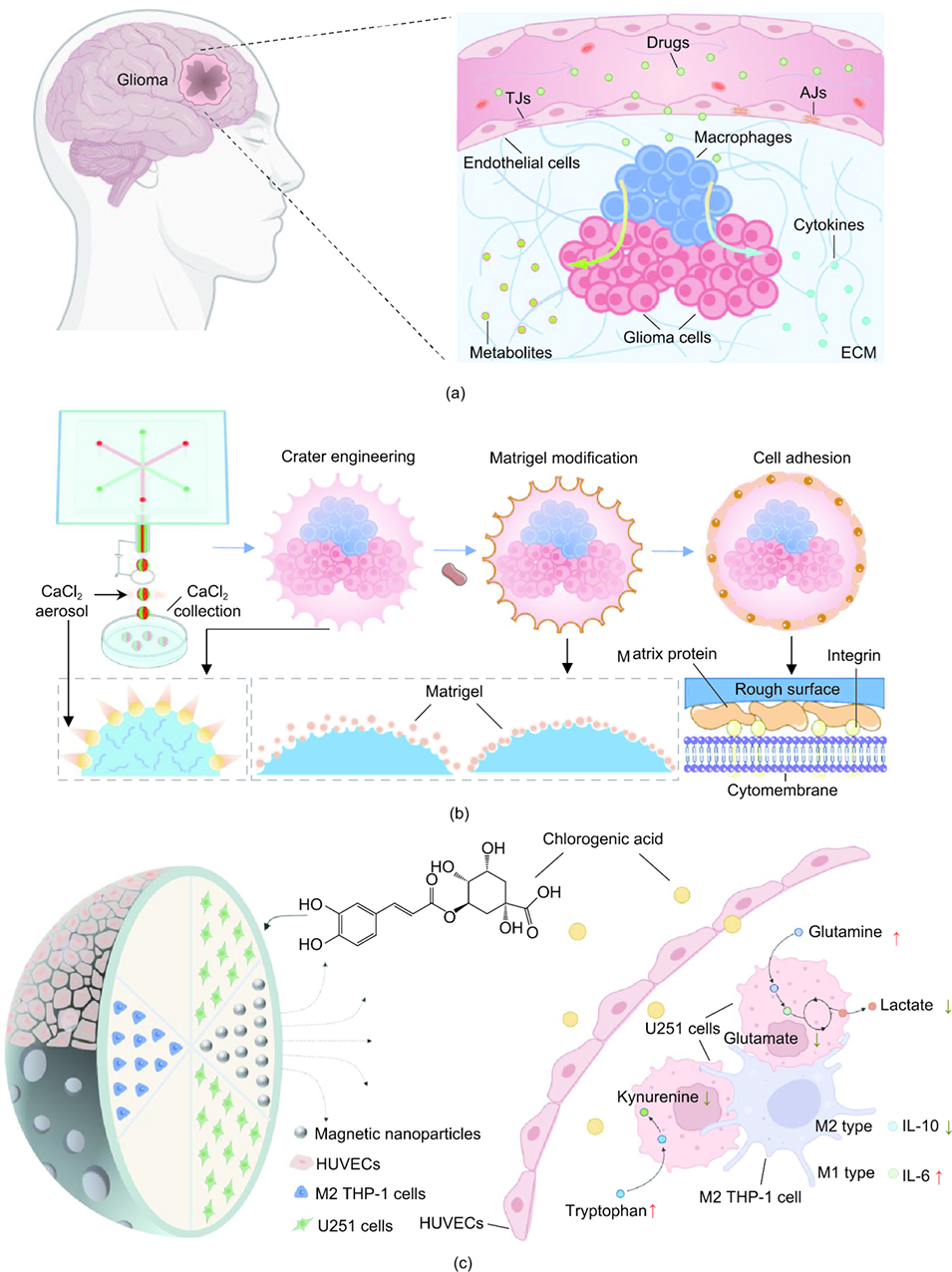
图1. 用于药物测试的微球基胶质瘤模型示意图。(a) 胶质瘤的生理结构特征;(b) 具有表面细胞黏附能力的六室微球制备流程;(c) 胶质瘤微球在绿原酸治疗研究中的应用。TJ:紧密连接;AJ:黏着连接;ECM:细胞外基质;IL:白细胞介素。
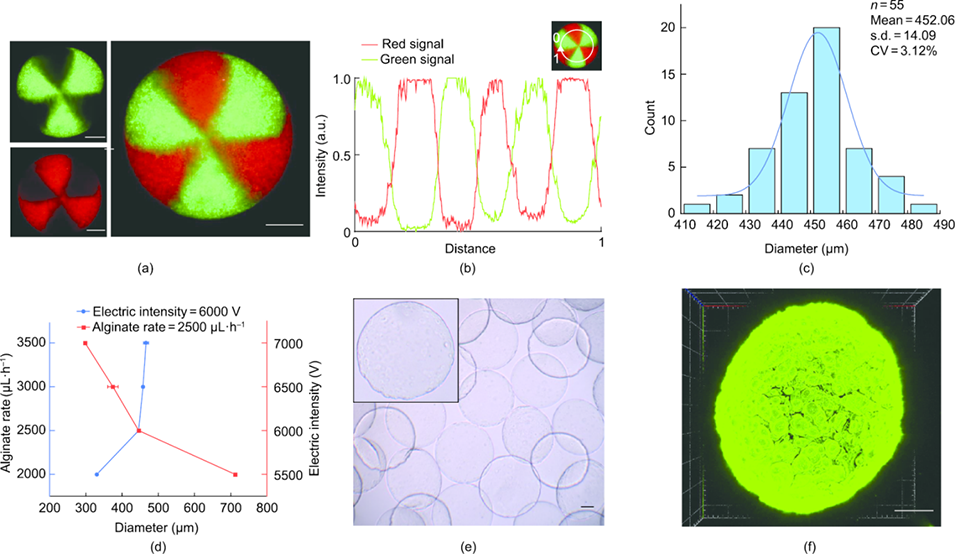
图2. 六室微球的制备与表征。(a) 荧光微球的显微镜图像;(b) 微球内单个隔室的荧光强度分析;(c) 制备微球的尺寸分布;(d) 通过调节电场强度或海藻酸盐浓度实现的微球尺寸可调性;(e) 具有粗糙表面形貌的微球明场图像;(f) 经 FITC 标记基质胶修饰的粗糙表面微球荧光图像。比例尺:100 μm。
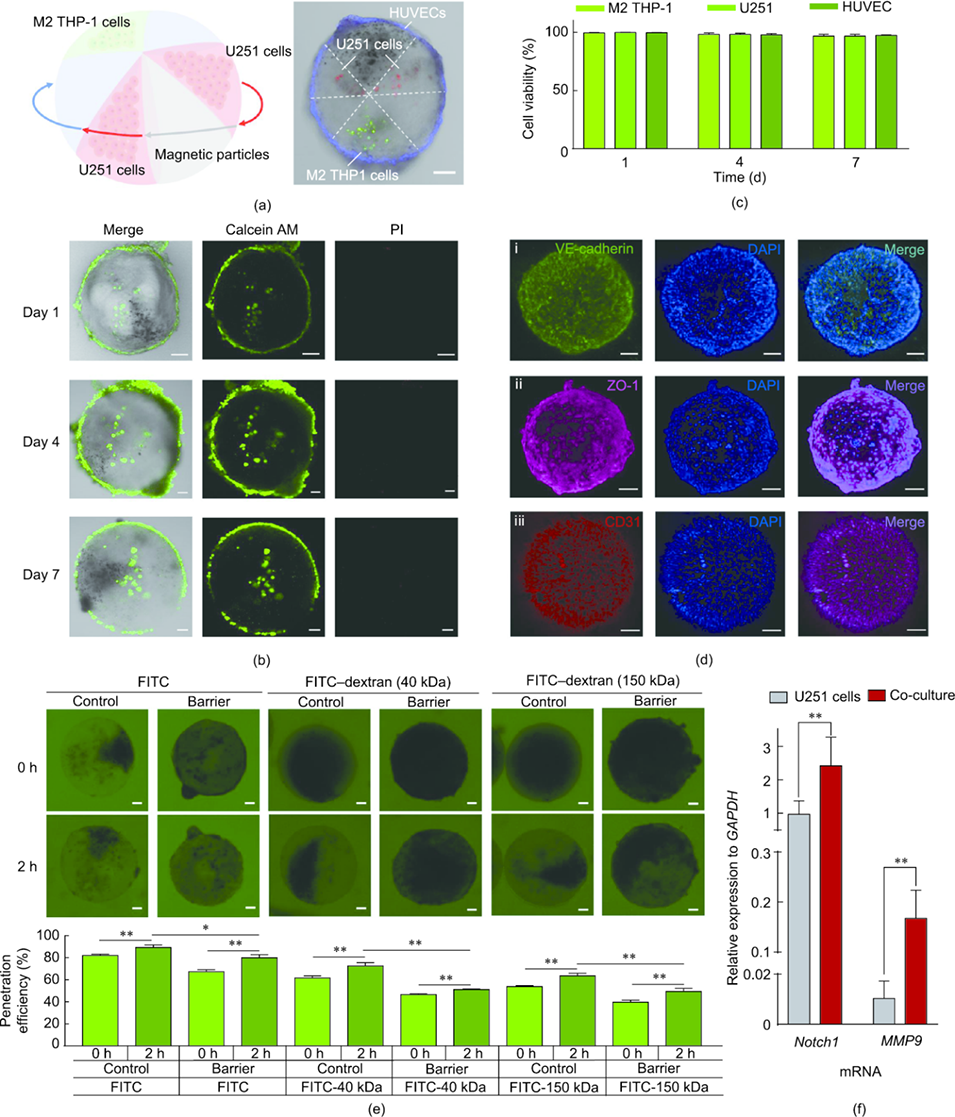
图3. 胶质瘤微球的制备与功能验证。(a) 利用细胞追踪剂鉴定微球内细胞类型:U251 细胞(红色标记)、M2 型 THP-1 细胞(绿色标记)、人脐静脉内皮细胞(蓝色标记);(b) 动态流培养 7 天后的细胞活力荧光图像;(c) U251 细胞、M2 型 THP-1 细胞和人脐静脉内皮细胞在 7 天培养期内的存活率;(d) 培养 3 天后,人脐静脉内皮细胞单层屏障中 VE - 钙粘蛋白 / 紧密连接蛋白 1/CD31 及细胞核的共聚焦显微镜图像;(e) 通过监测 FITC 及 40 kDa、150 kDa FITC - 葡聚糖在有无内皮细胞层的微球中的扩散,评估内皮屏障通透性;(f) 胶质瘤微球与传统 2D U251 细胞培养中 Notch1 和 MMP9 mRNA 水平的定量 PCR 分析。数据以平均值 ± 标准差表示;n=3,*P<0.05,**P<0.01。比例尺:100 μm。
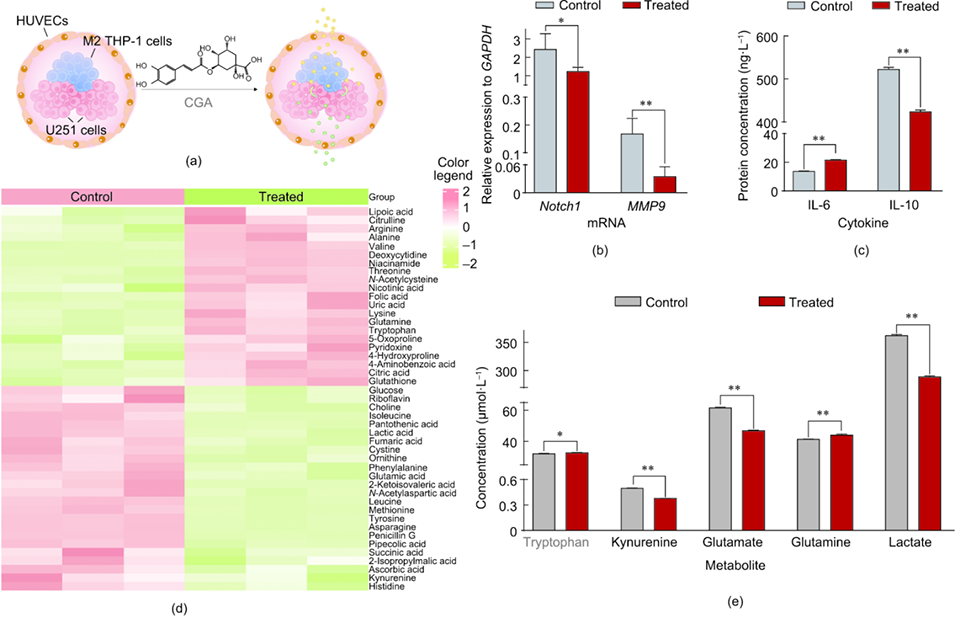
图4. 绿原酸对微球基胶质瘤模型的治疗效果评估。(a) 绿原酸穿透屏障并对胶质瘤微球产生生物学影响的示意图;(b) 未处理与绿原酸处理的胶质瘤微球中 Notch1 和 MMP9 mRNA 水平的比较分析;(c) 绿原酸刺激后胶质瘤微球中 IL-6 和 IL-10 表达与对照组的差异;(d) 各组间 45 种代谢物丰度差异的热图;(e) 绿原酸处理组与未处理组微球中目标代谢物(包括色氨酸、犬尿氨酸、谷氨酸、谷氨酰胺和乳酸)的水平变化。RNA **P<0.01。
论文链接:https://doi.org/10.1016/j.eng.2026.01.010
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














