
导读:
近期,上海科技大学刘一凡课题组开发了一种基于微流控气泡触发的高通量水凝胶微胶囊制备新方法。该方法通过向微流控器件引入恒定气压的气流,利用气泡诱导的瑞利-普拉托不稳定性,成功克服了高粘度双水相(ATPS)溶液难以高效生成液滴的瓶颈,实现了频率超过36 kHz、单分散性优异的微胶囊的连续制备。研究进一步将基因工程大肠杆菌封装于微胶囊中,构建了可特异性检测砷离子和己内酰胺的高性能全细胞生物传感器,验证了该平台在生物医学应用中的实用性与稳定性。相关研究以“High-throughput generation of aqueous two-phase microcapsules using microfluidic bubble triggering”为题目,发表在期刊《Droplet》上。
本文要点:
1、该研究开发了一种基于微流控气泡触发策略的双水相(ATPS)水凝胶微胶囊高通量制备方法,旨在解决传统ATPS法因溶液粘度高导致的微胶囊生成通量低、单分散性差等问题。
2、通过在微流控装置中引入恒压气流产生气泡,借助气泡诱导的瑞利-普拉托不稳定性及弯曲通道的离心力作用,高效操控ATPS液滴形成,最终经紫外交联等步骤固化为微胶囊。
3、该方法生成的微胶囊单分散性优异(变异系数通常低于5%),生成频率超36kHz,较传统方法实现量级提升,且液滴尺寸可通过气压、水相及油相流速灵活调控,还能通过调整两种水相比例获得不同核壳结构的微胶囊。
4、应用验证方面,研究将基因工程大肠杆菌(分别对砷离子、己内酰胺敏感)封装于微胶囊中,成功制备出生物传感器,其对目标分析物的检测限分别为2.5μM和5μM,且在4℃下储存7天仍保持良好的活性和稳定性。
5、该方法具备良好的生物相容性、可扩展性,为生物传感、类器官培养、高通量筛选等生物医学领域提供了高效的微胶囊制备工具,不过其对复杂生物实体(如哺乳动物细胞)的适配性及极端环境下的兼容性仍需进一步研究。
微流控气泡触发策略的核心机制在于“气泡诱导的瑞利-普拉托不稳定性+弯曲通道的离心力作用”的协同效应。具体如下:
恒压气体产生的气泡使水油界面周期性变形,形成颈部收缩区域,该区域拉普拉斯压力高于自由区域,驱动液滴自收缩断裂;
弯曲通道中,气(气泡)、水、油三相密度差异(ρg<ρa<ρo)导致气泡受到的离心力远小于液体,气泡向内挤压水相,进一步促进液滴破裂;
该机制抵消了ATPS溶液高粘度带来的内摩擦阻力,解决了传统方法液滴生成频率低、单分散性差的瓶颈,实现超36kHz的高通量制备。
影响微流控气泡触发策略制备ATPS液滴的关键参数有哪些?如何调控液滴尺寸以适配不同应用场景?
(1)关键参数
核心参数:空气压力、水相流速、油相流速,三者共同决定液滴尺寸、生成稳定性和产率;
次要参数:两种水相(PEGDA/葡聚糖)的流量比,主要影响液滴核壳结构。
(2)调控规律与应用适配
① 空气压力与液滴尺寸负相关:压力升高(2.7-3.3 PSI),液滴直径从120.20 µm降至78.76 µm;
② 水相流速与液滴尺寸正相关:流速升高(1800-2600 µL/h),液滴直径从80.10 µm增至126.38 µm;
③ 油相流速与液滴尺寸负相关:流速升高(600-1800 µL/h),液滴直径从143.68 µm降至101.47 µm;
④ 应用适配:
生物传感场景(需较小液滴,如78-100µm):提高空气压力和油相流速、降低水相流速;
类器官培养场景(需较大液滴,如120-140µm):降低空气压力和油相流速、提高水相流速。
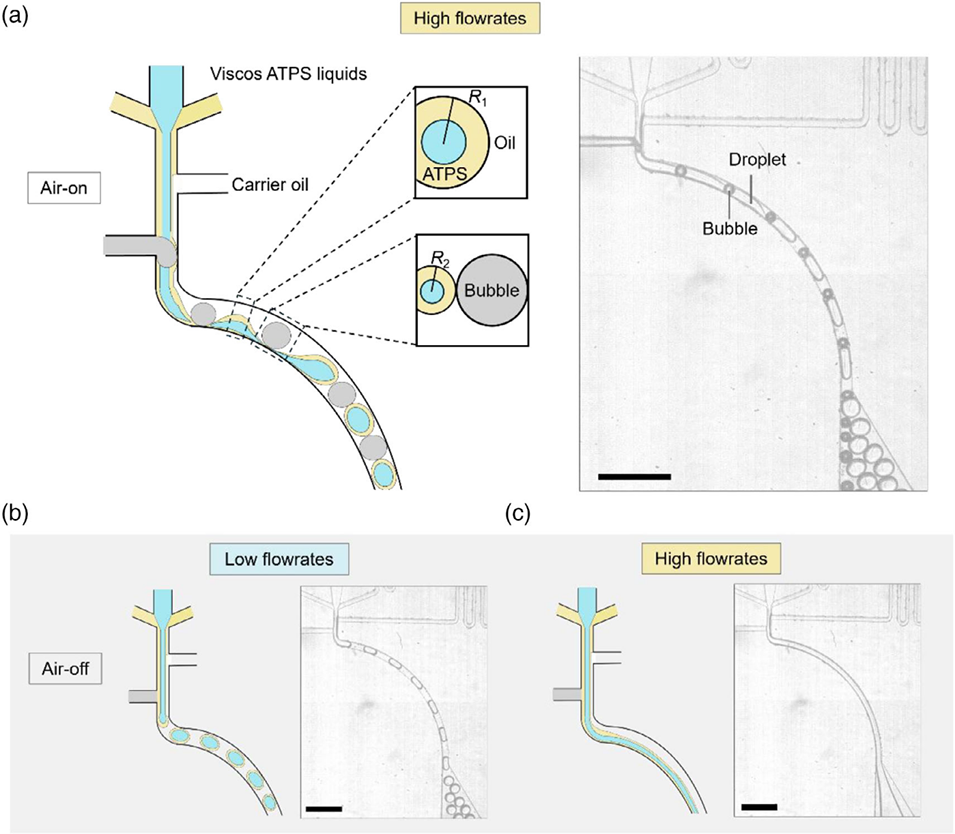
图1. 气泡触发式液滴生成策略示意图。(a)气泡触发式液滴生成策略的原理示意图,比例尺:600微米;另附两个辅助示意图:(b)传统方法在低水相流速下的液滴生成情况,(c)同一传统方法在高水相流速下的射流现象。ATPS:双水相体系。
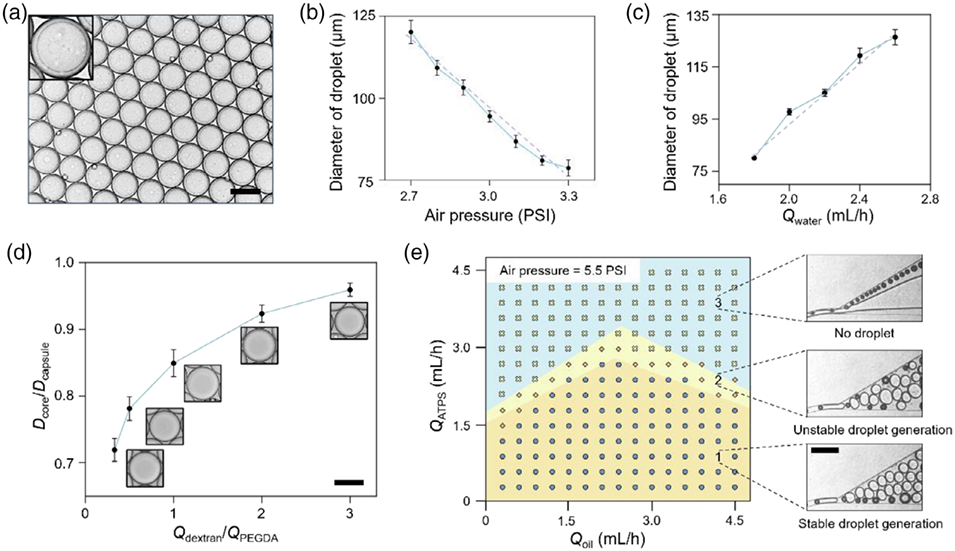
图2. 基于气泡触发策略的水凝胶微胶囊制备结果。(a)气泡触发策略制备的单分散性液滴分布情况,比例尺:100微米;(b)在水相和油相流速恒定的条件下,液滴平均直径(微米)随气压(PSI)的变化趋势;(c)在气压恒定且油相流速与水相流速相等的条件下,液滴平均直径(微米)随水相流速(毫升/小时)的变化趋势;(d)在总水相流速、总油相流速(与总水相流速相等)及气压均保持不变的情况下,微胶囊核壳比随聚乙二醇二丙烯酸酯(PEGDA)与葡聚糖流速比的变化关系;(e)恒定气压为5.5 PSI时,不同油相和水相流速下的液滴形成相图(左图),及相图中不同点位对应的液滴形成行为(右图),比例尺:200微米。ATPS:双水相体系。
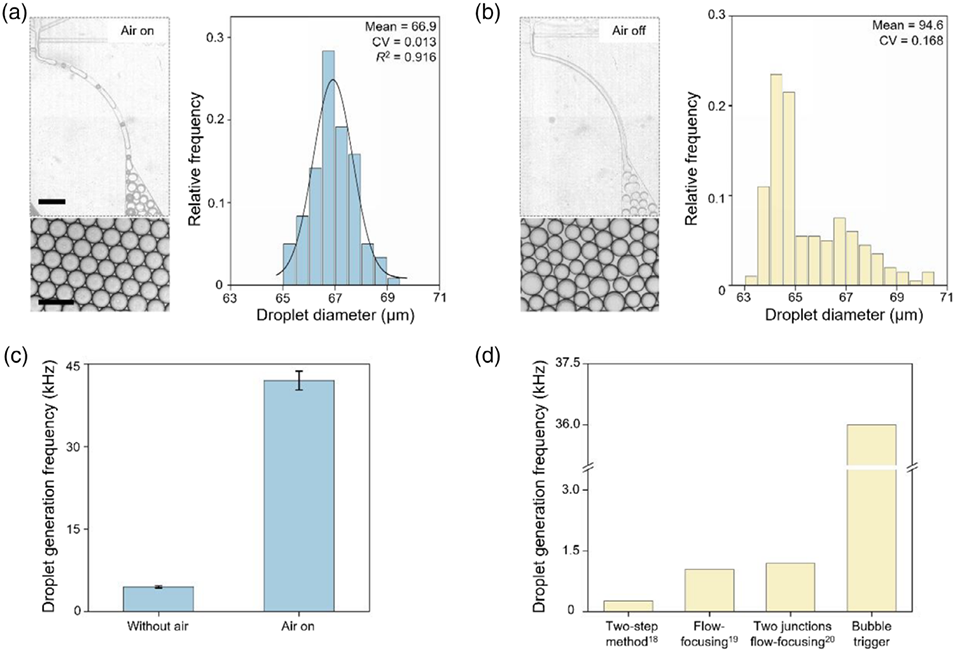
图3. 气泡触发式双水相体系(ATPS)液滴生成策略的性能表征。(a)“通气”条件下的液滴形成过程及分布(左图),右侧为对应的液滴尺寸分布直方图,比例尺:600微米(上图)、200微米(下图);(b)“不通气”条件下的液滴形成过程及分布(左图),右侧为对应的液滴尺寸分布直方图(水相和油相流速与(a)一致,但两种方法的液滴尺寸及均一性差异显著);(c)“通气”与“不通气”条件下的液滴生成频率对比;(d)气泡触发法与其他常用技术的液滴生成频率对比。
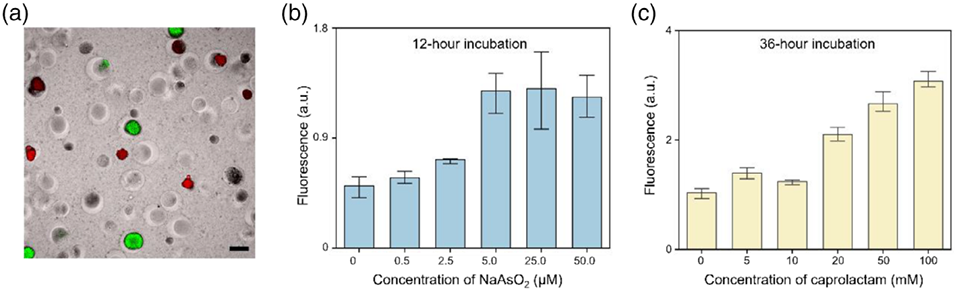
图4. 高通量全细胞细菌生物传感微胶囊的制备及离子传感性能。(a)生物传感微胶囊在LB(溶菌肉汤)培养基中检测目标分析物时的荧光成像图;(b)(c)目标分析物浓度对生物传感微胶囊荧光强度输出的影响:微胶囊分别在不同浓度的砷离子(b,孵育12小时)和己内酰胺(c,孵育36小时)条件下培养,误差线代表三次独立重复实验的标准差(n=3)。
论文链接:https://doi.org/10.1002/dro2.70034
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














