
导读:
毛囊再生技术有望治疗脱发,但构建模拟自然毛囊微环境的仿生结构仍具挑战。近期,南方医科大学南方医院整形外科黄俊飞博士等人开发了一种基于粘多糖热力学不相容性的新型生物工程毛囊胚芽(BHG)。他们利用微流控技术制备了具有湿态粘附性的HME水凝胶外壳包裹GelMA核心及Wnt3a蛋白的双层微球,成功实现了Wnt3a的缓释,并在动物模型中显著激活Wnt信号通路,有效促进了体内毛囊再生。相关研究以“Construction of Large‐Scale Bioengineered Hair Germs and In Vivo Transplantation”为题发表于期刊《Advanced Science》。
本文要点:
1、本研究利用热力学不相容的粘多糖开发了一种新型生物工程毛囊胚芽(BHG),通过接枝氨基和二乙氨基合成HME水凝胶,结合共流微流控系统制作双层微球(HME为壳、GelMA为核),并封装Wnt3a蛋白以实现持续释放,通过RNA测序等手段研究毛囊再生的分子机制。
2、结果表明,HME水凝胶具有优异的粘附力、剪切稀化行为和生物相容性;微球释放Wnt3a达9天,高通量测序表明毛囊再生相关基因上调、Wnt信号通路激活,缺氧相关基因下调,通路富集分析证实了HF再生通路的富集。
3、综上,基于HME的BHG微球能有效促进体内毛囊再生,为脱发治疗与再生提供了有前景的解决方案。
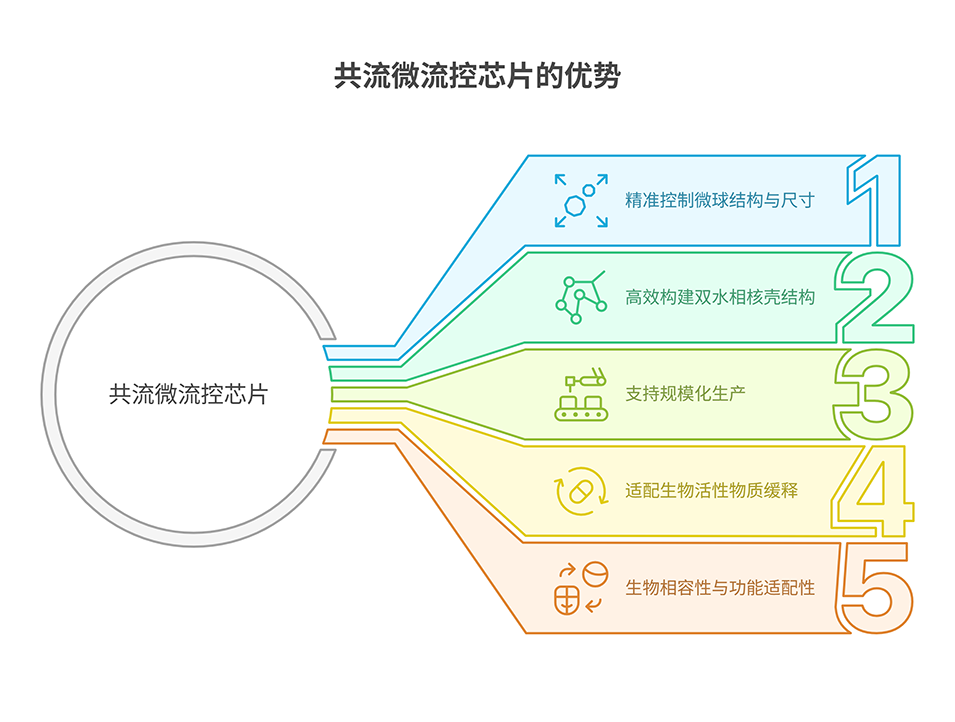
共流微流控芯片制备核壳微球的核心原理基于层流剪切力主导的液滴成型与材料热力学不相容性维持的结构稳定双重机制协同作用,具体实现路径如下:
1、微通道结构与流体动力学控制
芯片采用三入口通道(内相、中间相、外相)与共流交界处的特殊几何设计,使多相流体在微通道内以层流状态流动(无湍流混合)。外相矿物油在通道中形成连续相,通过剪切力作用于中间相(HME)和内相(GelMA),将其“切割”为均匀液滴。层流状态确保各相界面清晰,为核壳结构的稳定形成提供基础。
2、流速参数的精确调节
通过微型泵精准控制三股流体的流速比例:
内相(GelMA)流速设为 0-2.0 mL/h,中间相(HME)固定为 1.5 mL/h,外相(矿物油)为 5.0-7.5 mL/h。
流速直接影响微球尺寸:外相流速越高,剪切力越强,微球直径越小(可控制在9-286.3 μm);调节内相/中间相流速比,可实现核壳直径比接近 1.5:1(模拟自然毛囊结构)。
3、材料热力学特性的协同作用
带负电的 HME(粘多糖基)与带负电的 GelMA(蛋白)因电荷排斥产生热力学不相容性,阻止内相和中间相水溶液混合,进一步稳定核壳界面。这种材料特性与流体剪切作用协同,确保液滴在形成过程中保持核壳结构,避免融合或变形。
4、光交联固化
含光引发剂(LAP)的 HME 和 GelMA 在出口处经紫外光(365 nm)照射 4-5 s 后迅速交联固化,将上述过程形成的核壳液滴结构固化成型,最终获得尺寸均一、结构稳定的微球。
通过以上多维度调控,共流微流控芯片可高效制备具有精准核壳结构的微球,为细胞分层封装和生物活性物质缓释提供理想载体。
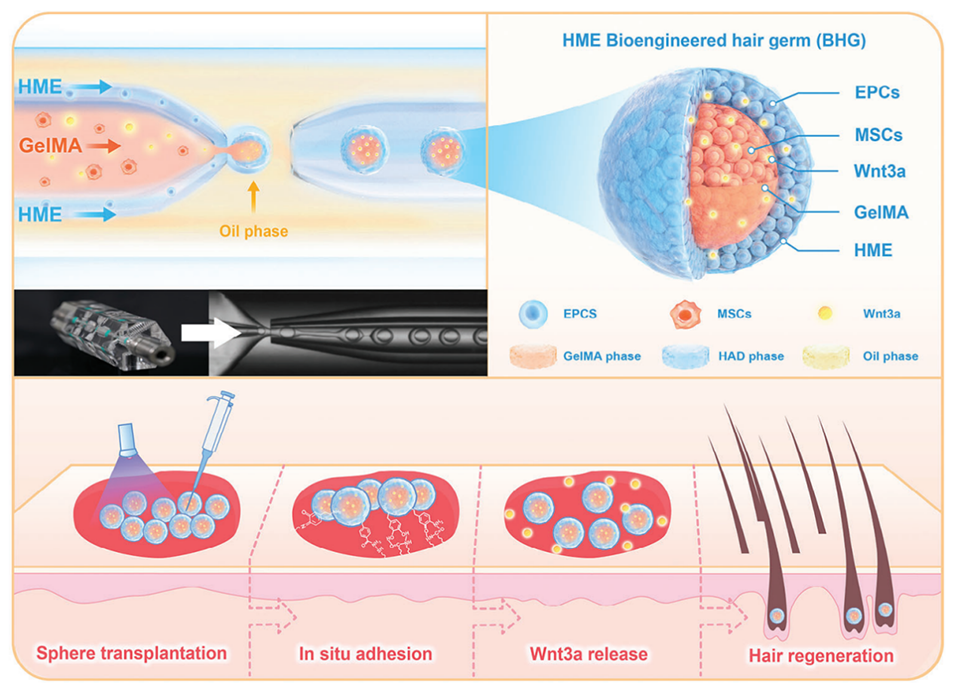
图 1. 大规模制备生物工程毛囊胚芽(BHGs)的示意图。通过共流微流控芯片,设计用二羟苯丙氨酸接枝透明质酸(HME)和甲基丙烯酰化明胶(GelMA)分别包裹间充质细胞(MSCs)和上皮细胞(EPCs)。图中展示的关键特征包括水相分离、湿态粘附特性、Wnt3a 的长效释放以及增强的毛囊(HF)诱导潜能。
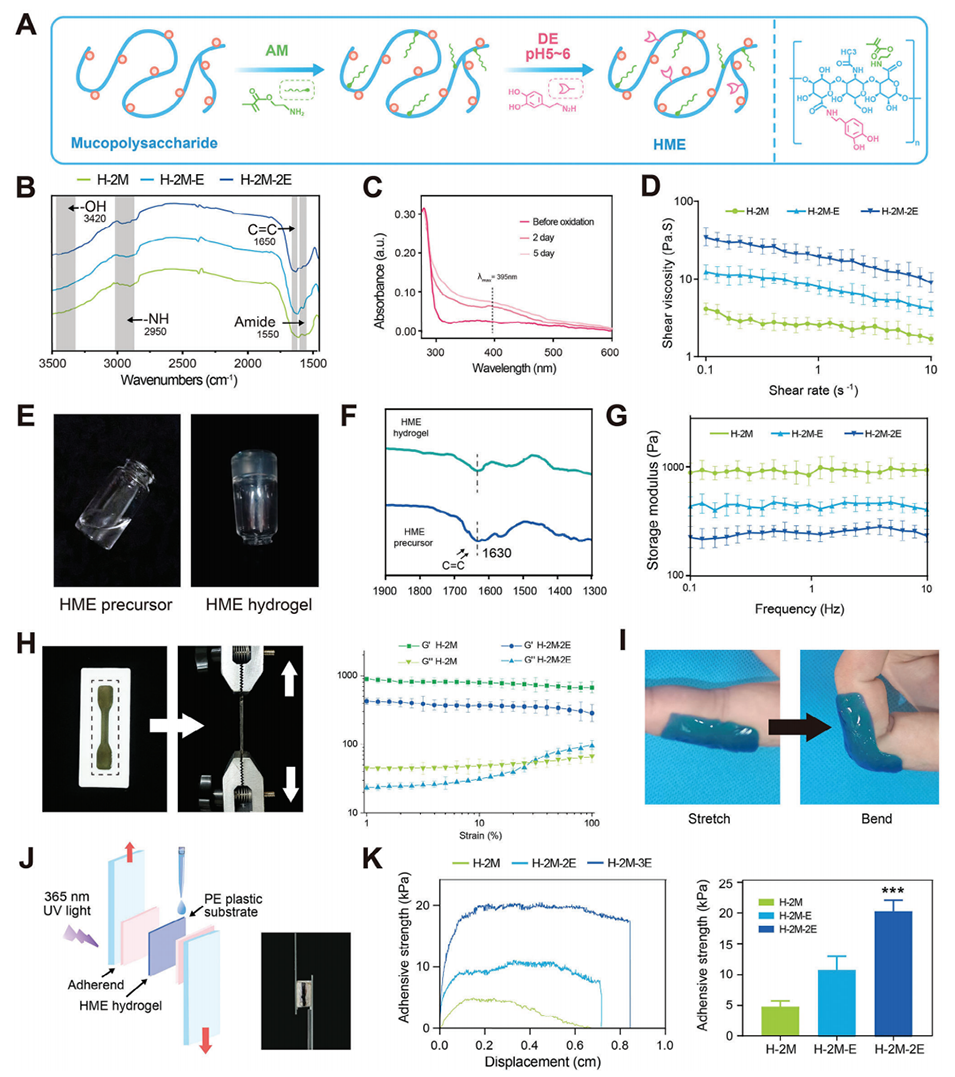
图 2. 粘多糖基水凝胶(HME)的表征。
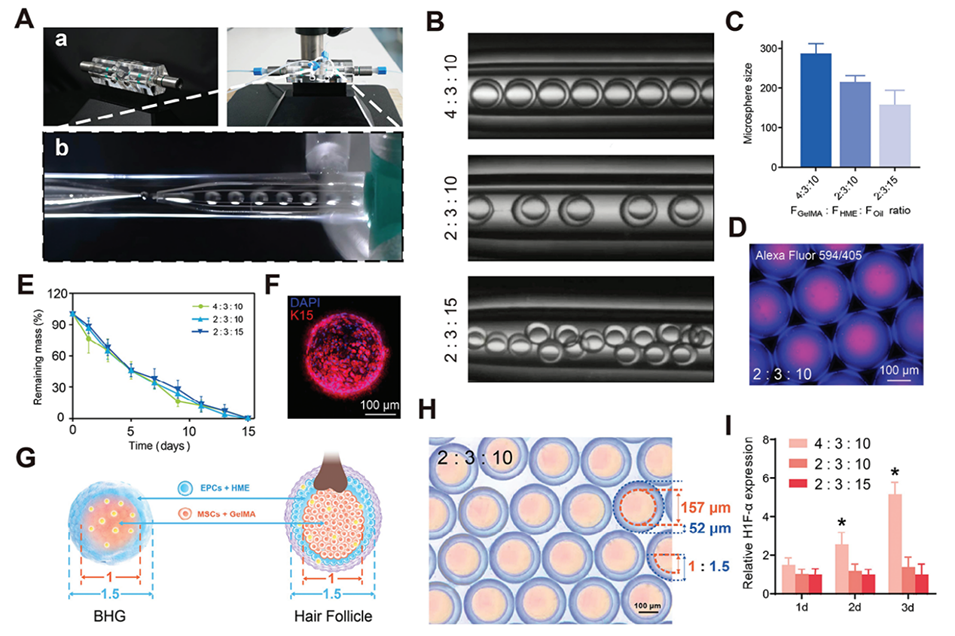
图 3. HME 生物工程毛囊胚芽的微流控制备。
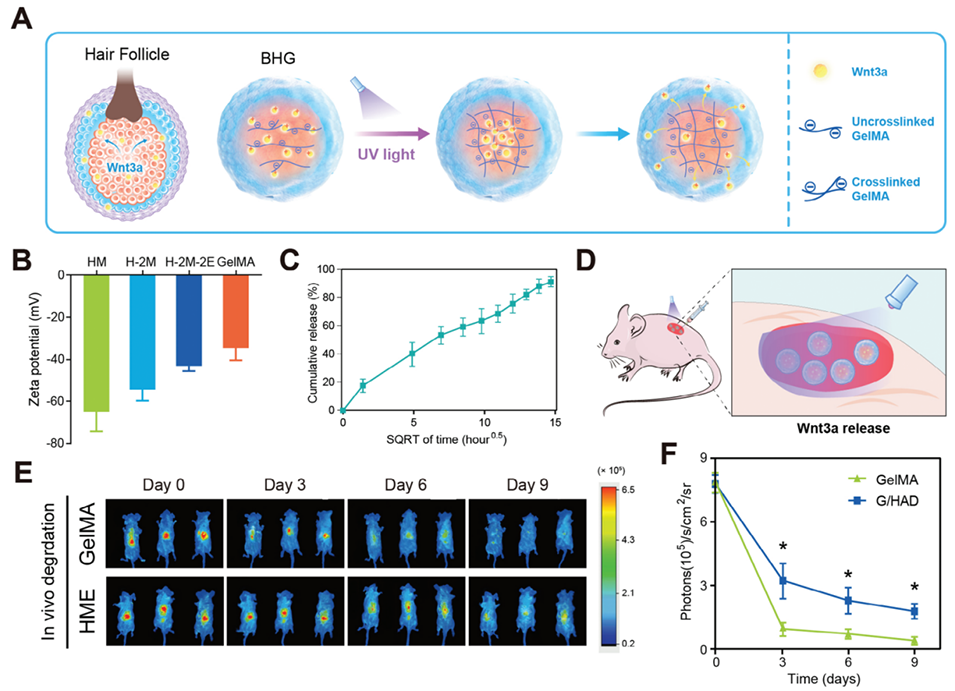
图 4. Wnt3a 在体内外的持续释放机制。
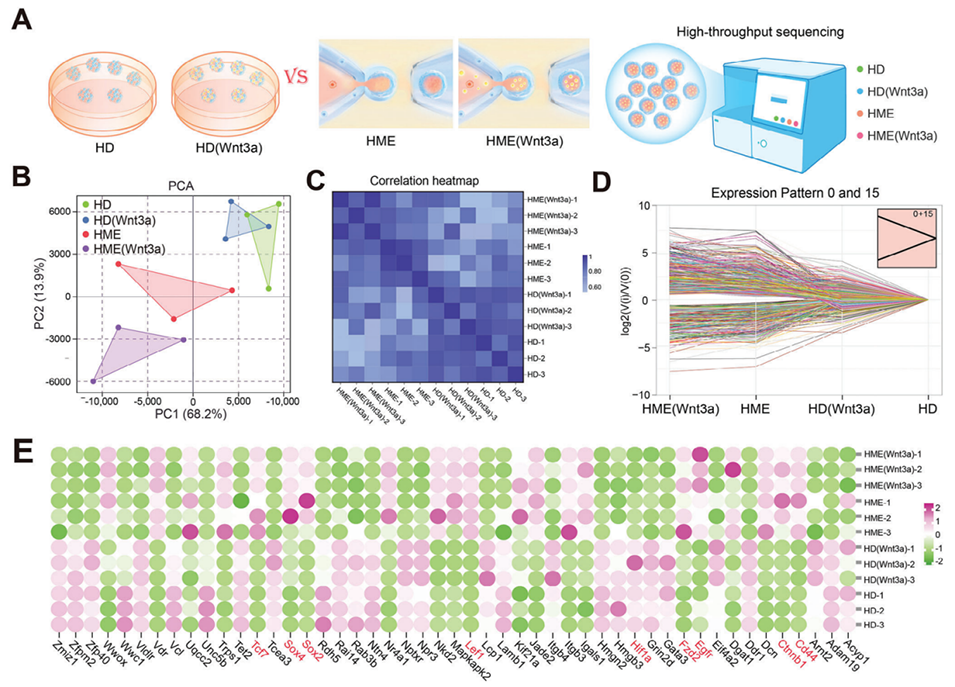
图 5. 转录组分析揭示 HME 微环境与 Wnt3a 释放的影响。
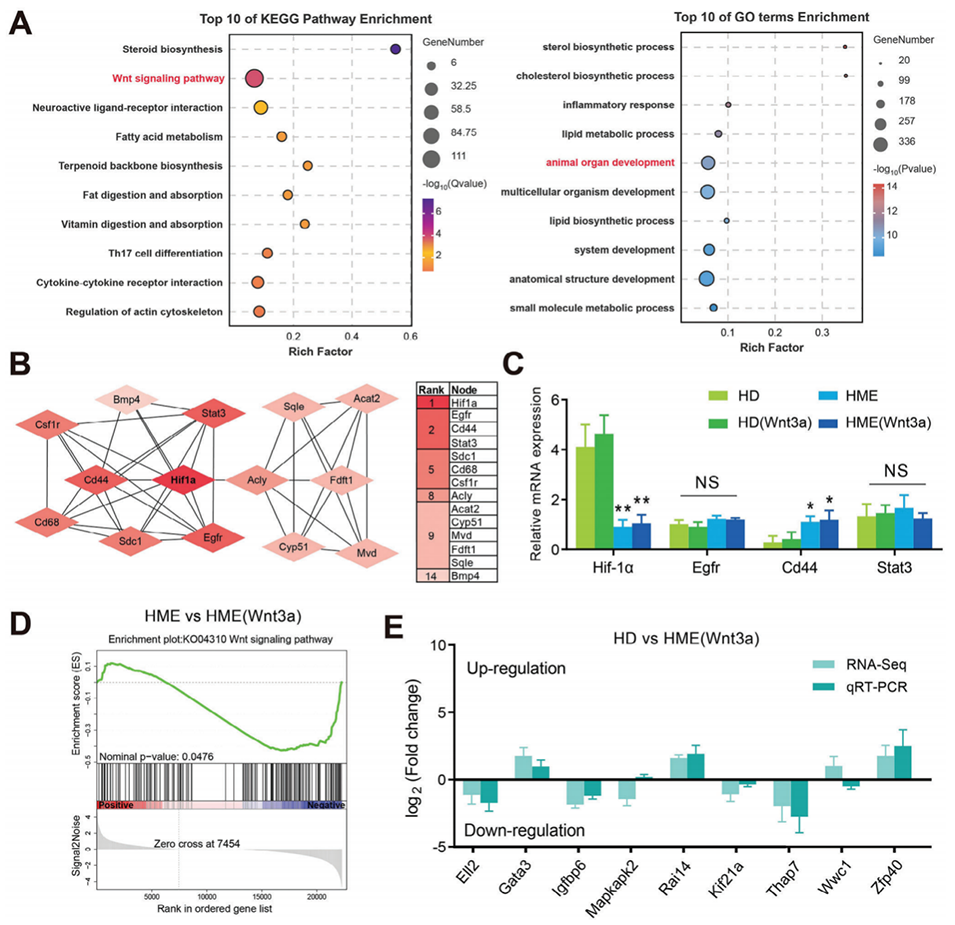
图 6. 功能分析揭示 HME 微环境的影响。
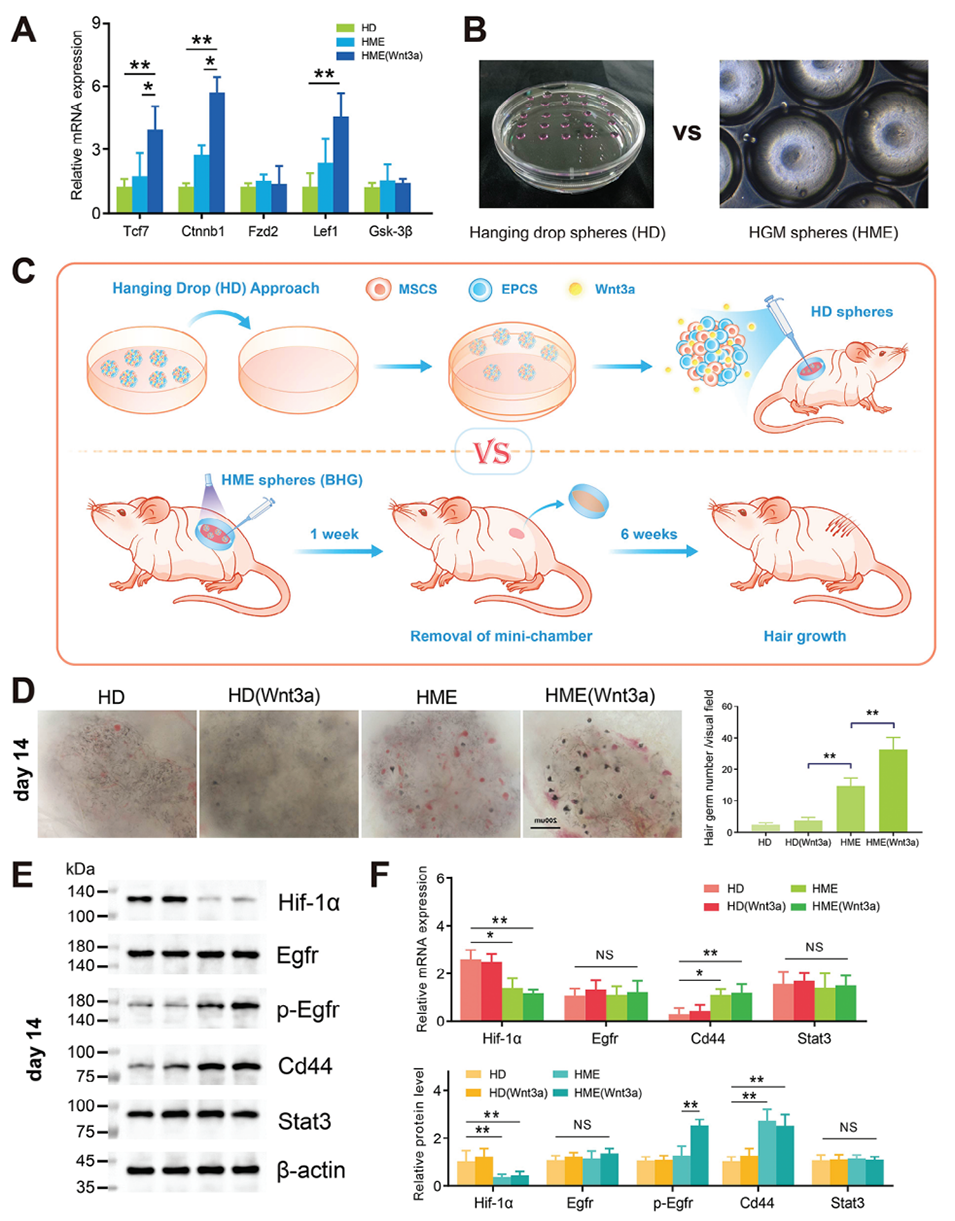
图 7. 生物工程毛囊胚芽的体内移植与再生。
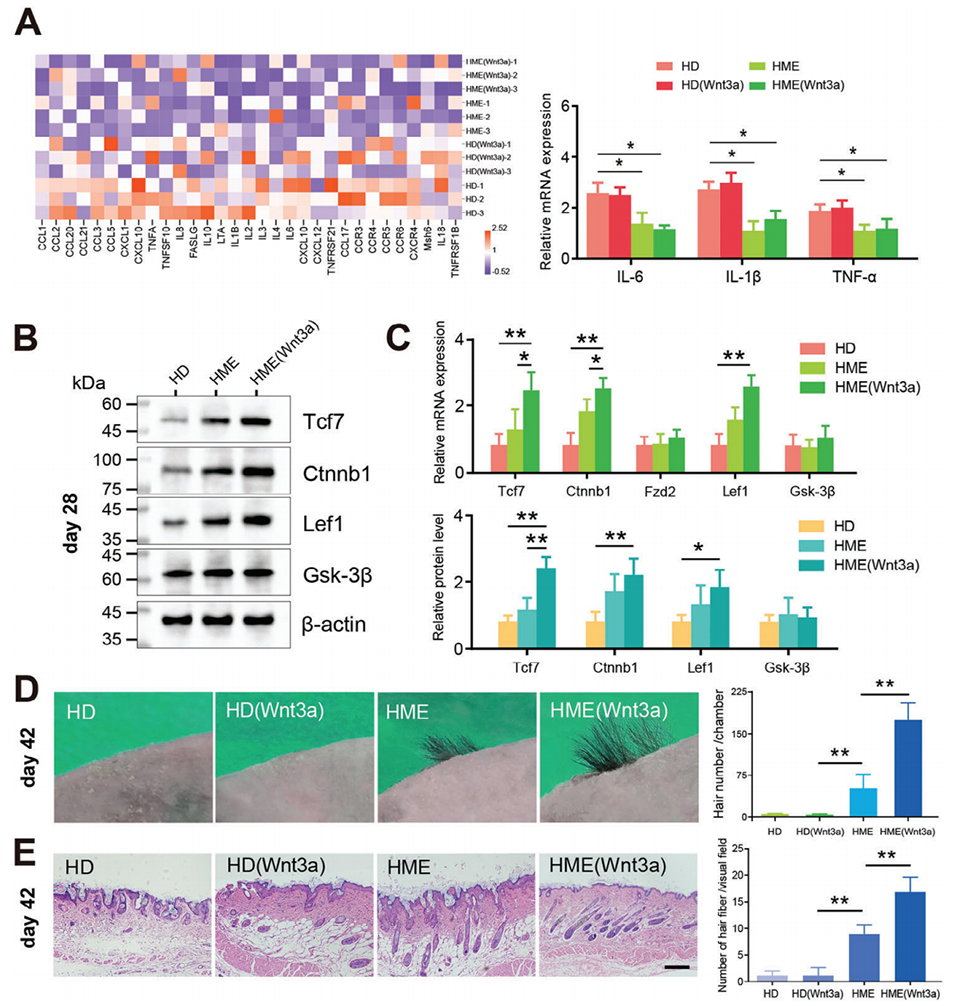
图 8. 生物工程毛囊胚芽体内毛囊再生能力的研究。
论文链接:https://doi.org/10.1002/advs.202416361
(本文仅供参考学习及传递微流控研究成果,版权归原作者所有,如侵犯权益,请联系删除)














