
导读:
海藻酸盐水凝胶因其生物相容性和可调特性而被广泛研究用于生物医学应用,但传统的微球制备在结构精度、工艺复杂性和灵活性方面面临挑战。近期,苏州大学杨浩教授、孙海振副教授联合诺斯贝尔化妆品股份有限公司邱晓锋等人开发了一种基于多相剪切诱导乳化/内部凝胶化的一步微流控策略,成功制备出结构可调的海藻酸盐水凝胶微球,该方法能精准调控微球的直径和形态,且所制备的微球在环境修复等领域展现出良好应用潜力。相关研究以“Microfluidic One-Step Fabrication of Structurally Tunable Alginate Hydrogel Microspheres via Multiphase Shear-Induced Emulsification/Internal Gelation”为题目,发表在期刊《Colloids and Surfaces A: Physicochemical and Engineering Aspects》上。
本文要点:
1、本研究开发了一种基于多相剪切诱导乳化/内部凝胶化的创新一步微流控策略,解决海藻酸盐微球制备中精确结构控制的关键挑战。
2、利用同轴毛细管装置中的相序反转技术,实现了实心核或胶囊型结构的选择性生成,通过协同优化流动参数、浓度和粘度,可精确调控微球直径(500–950μm)和形态(长径比0.95–1.05)。
3、系统研究发现,热固化过程中微球存在不同的体积收缩行为,胶囊型微球收缩动力学更快。
4、将TiO₂/Fe₃O₄纳米颗粒整合到胶囊结构中,能够完全光催化降解亚甲基蓝,验证其环境修复效用。
5、该研究为可调水凝胶载体的制备建立了一个可扩展平台,同时推动了微流控液滴工程在生物医学和环境领域的基础研究发展。
相序反转技术的原理是通过改变微流控装置中不同相溶液的注入通道,实现对微球内部结构的选择性调控,从而生成实心核或胶囊型结构。具体如下:
在同轴毛细管-方管复合微流控装置中,存在三个同心通道(内层、中间层、外层),外层通道始终通入硅油基连续相(PDMS与硅油体积比3:1)。装置中毛细管经过精密加工,内层细毛细管的孔径为100-150 μm,中间粗毛细管的孔径为300-400 μm,这种通道直径差是实现相序反转后结构调控的关键硬件基础——细内径通道限制内层流体的流量与扩散范围,粗内径通道为中间相提供充足的空间形成包裹或支撑结构。
当制备实心核微球时,内层通道注入海藻酸钠-碳酸钙溶液(W₂),中间通道注入柠檬酸溶液(W₁);而制备胶囊型微球时,通过相序反转,将柠檬酸溶液(W₁)注入内层通道,海藻酸钠-碳酸钙溶液(W₂)注入中间通道。
这种相序的切换,结合内部凝胶化反应(柠檬酸中的H⁺诱导碳酸钙释放Ca²⁺,与海藻酸盐交联),使得液滴在形成过程中因不同相的空间分布差异,分别形成实心核结构(单一凝胶网络)或胶囊型结构(壳-核分离结构)。
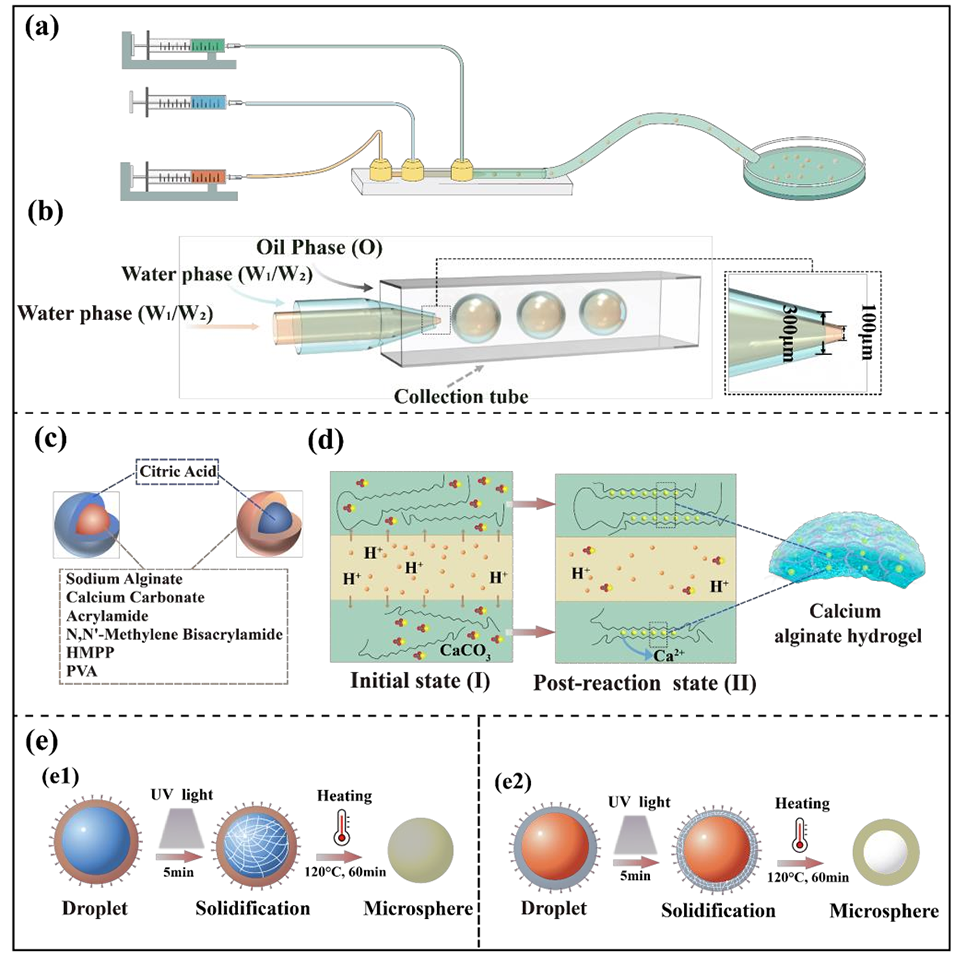
图1.所设计的微流控系统及可控水凝胶微球制备过程示意图
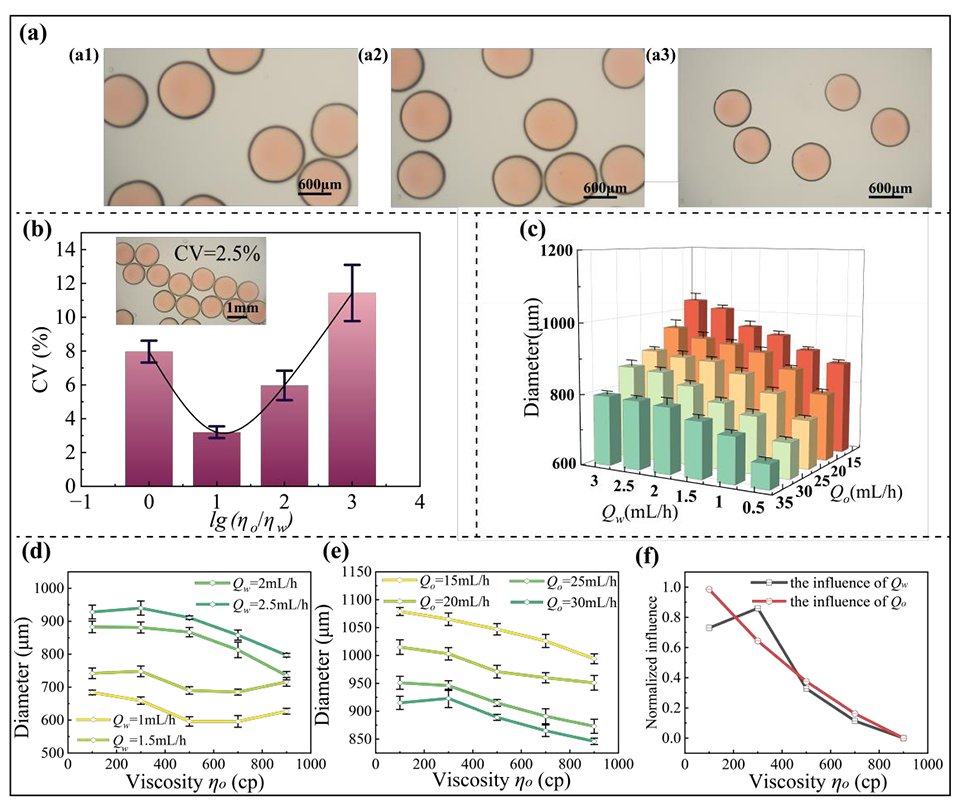
图2.通过流体动力学和组分参数对实心核液滴尺寸的多变量调控
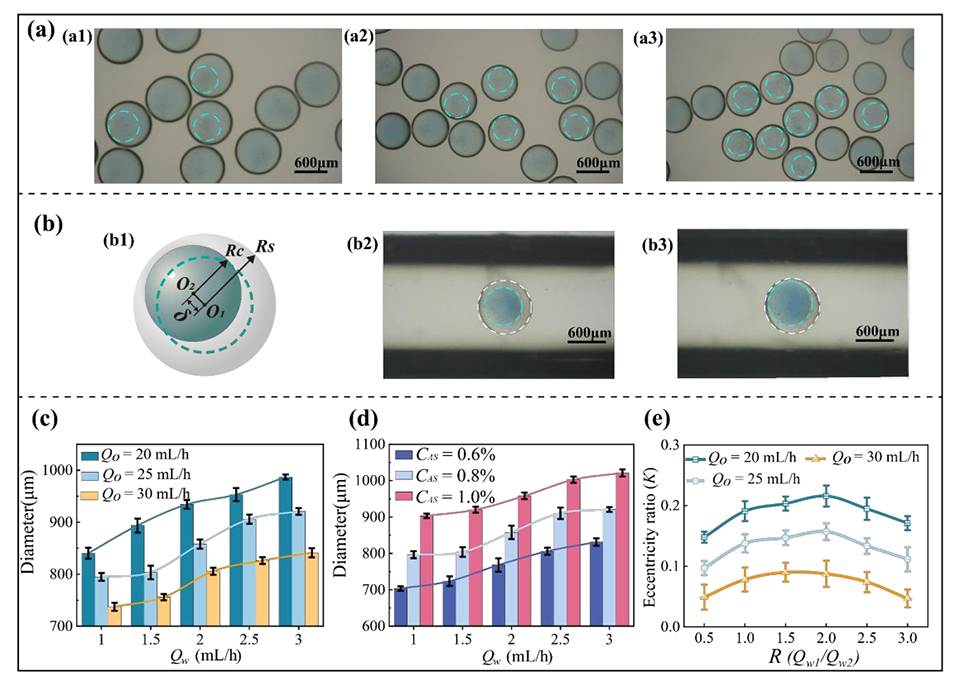
图3.胶囊型液滴尺寸调控及偏心度控制的多变量分析(比例尺:600 μm)
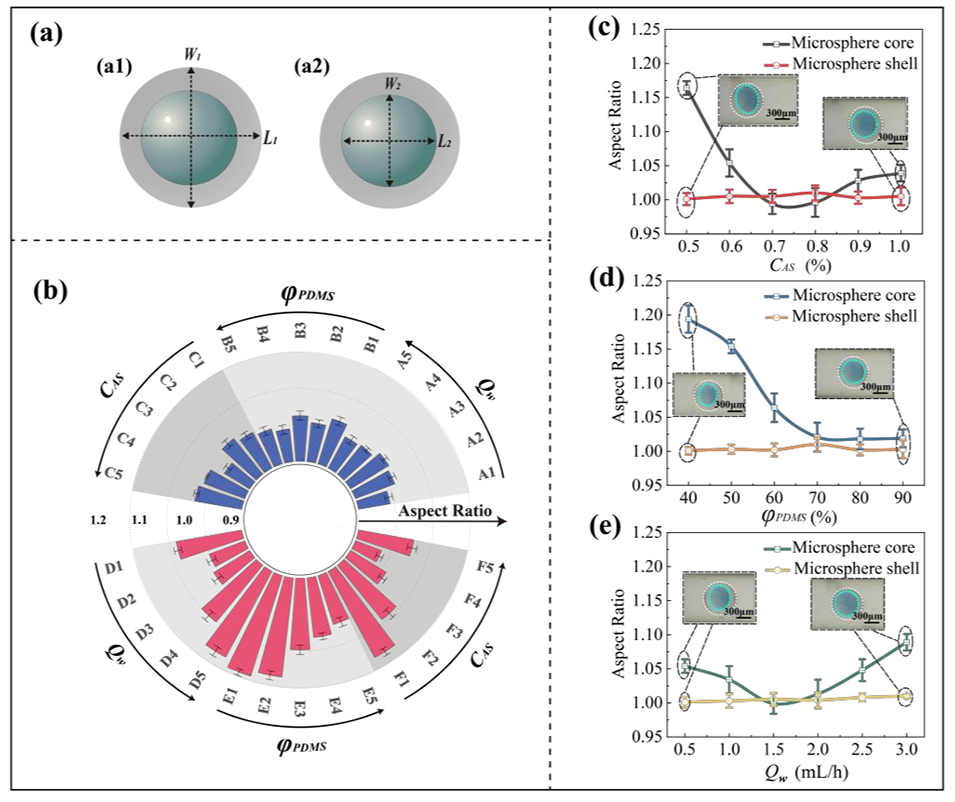
图4.不同可控变量对空心液滴壳层与核心形态的影响研究(比例尺:300 μm)
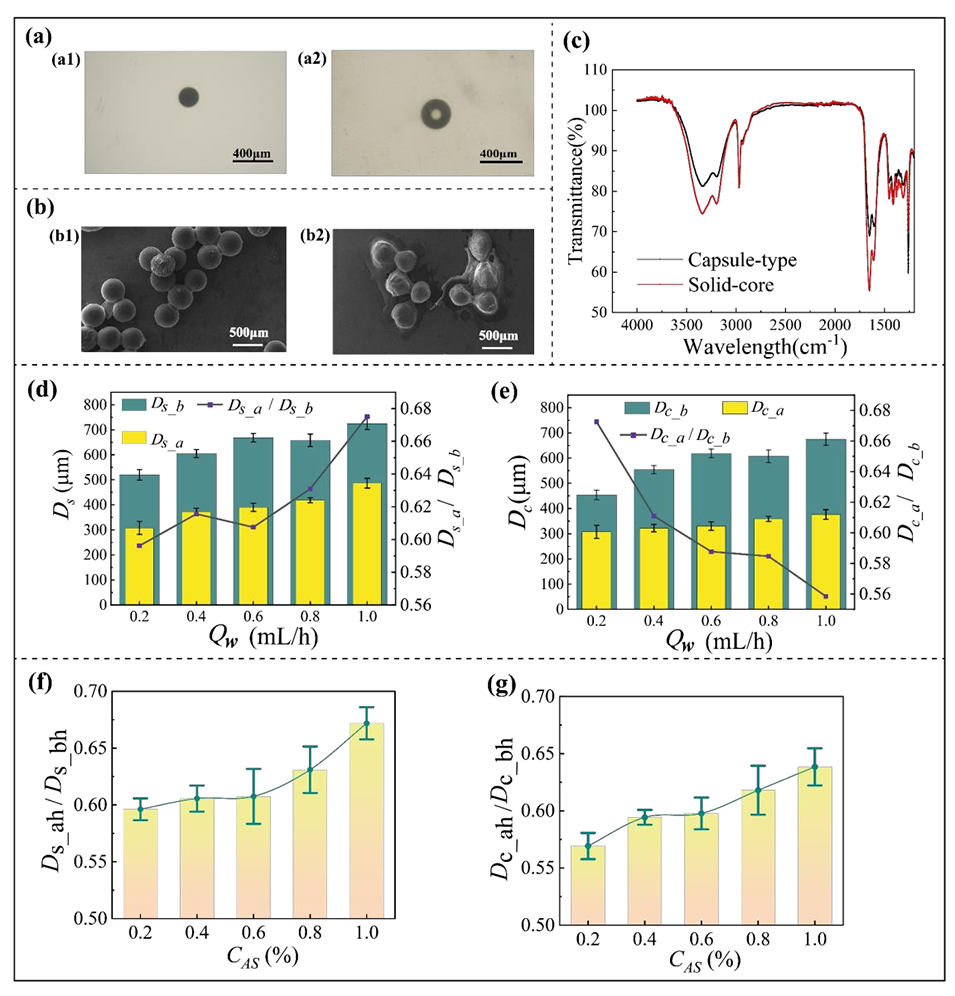
图5.海藻酸盐水凝胶微球的形态演变及结构表征
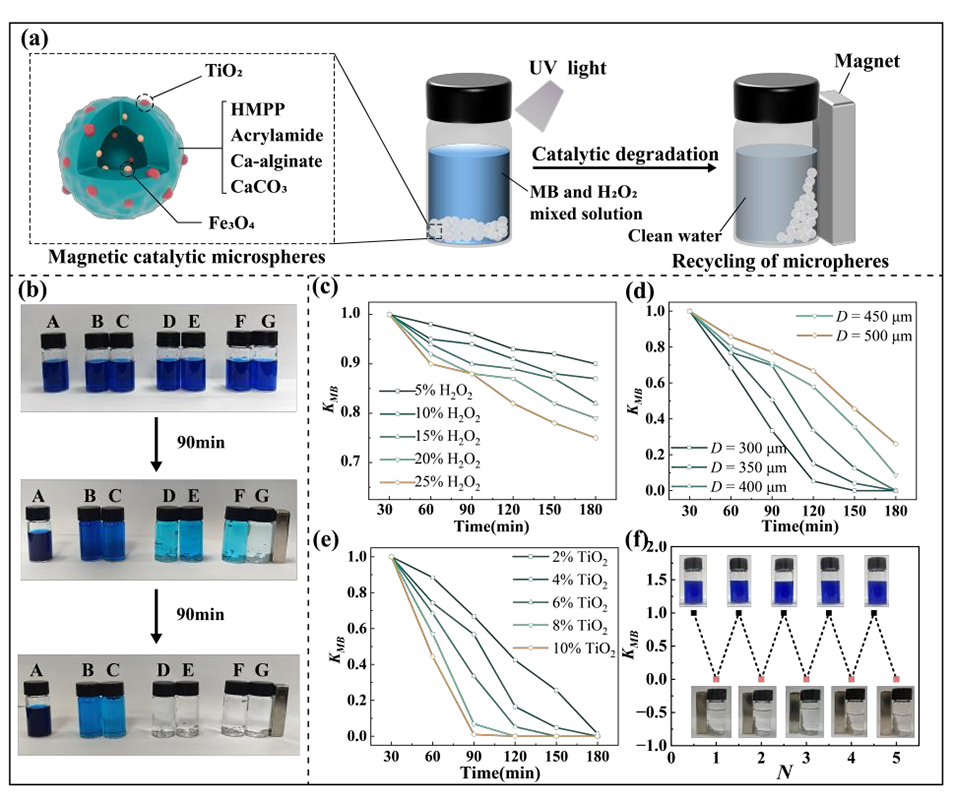
图6.利用磁性微球催化降解亚甲基蓝(MB)的过程
论文链接:https://doi.org/10.1016/j.colsurfa.2025.137727














