
导读:
近期,有研究人员开发了一种基于聚苯乙烯核与热敏共聚物壳层的纳米颗粒体系,其壳层在38–40°C下可逆收缩,通过抑制光激发分子的内部转换显著增强了近红外染料荧光强度和光敏剂的单线态氧生成效率。实验表明,该体系在体外加热后细胞荧光信号增强2–3倍,并在小鼠模型中通过局部激光加热实现了肿瘤区域的高对比度成像与光动力治疗协同增效。相关研究以“Polymeric nanoparticles with a thermoresponsive shell loaded with fluorescent molecules allow for thermally enhanced fluorescence imaging and singlet oxygen generation”为题目,发表在期刊《Nanoscale Advances》上。
本文要点:
1、本研究开发了一种热响应型聚合物纳米制剂(NF),由聚苯乙烯核与共聚物poly(NIPAM-co-AA)壳层组成,其壳层在38–40°C(较低的临界溶液温度,LCST)下发生可逆收缩,纳米颗粒尺寸从250 nm降至140 nm。
2、通过后负载近红外染料3782SL或光敏剂HPPH,该体系在温度超过LCST时表现出显著增强的荧光强度和单线态氧(1O2)生成。
3、机理研究表明,壳层压缩和纳米颗粒聚集抑制了光激发分子的内部转换,促进了荧光发射与系间窜越,从而提升三重态产率及后续的1O2生成。
4、体外实验显示,加热至40°C后细胞荧光信号增强2–3倍;体内实验通过皮下、静脉或瘤内注射NF并结合1.3 μm激光局部加热,验证了热增强荧光成像效果。
5、此外,HPPH负载的NF在加热后延长了荧光寿命并增强了光动力疗效。该纳米制剂兼具热响应荧光成像与光动力治疗功能,为精准诊疗提供了新策略。
热响应核壳纳米颗粒的制备过程包括以下几个步骤:
1、聚苯乙烯(PolySt)核的合成
首先通过微乳液聚合生成聚苯乙烯纳米核。以苯乙烯为单体,在十二烷基硫酸钠(SDS)和磷酸二氢钠缓冲体系下,通过过硫酸钾(K2S2O8)引发70°C高温聚合反应。反应过程中持续通氮除氧并保持1200 rpm高速搅拌,最终生成约30 nm的均一聚苯乙烯纳米核。
2、聚(NIPAM-co-AA)壳层的共聚
在聚苯乙烯核表面引入温度敏感的共聚物壳层。将N-异丙基丙烯酰胺(NIPAM)、丙烯酰胺(AA)与交联剂N,N'-亚甲基双丙烯酰胺(BIS)按约9:1的摩尔比例混合,注入核分散液中,于70°C下进行共聚反应。通过调节NIPAM与AA的比例,壳层的低临界溶解温度(LCST)被精准调控至39°C,接近生理温度。反应结束后,通过72小时透析(截留分子量3500 Da)去除未反应单体和表面活性剂,获得尺寸约250 nm的核壳纳米颗粒分散液。
3、功能分子的后加载
荧光分子(如3782SL染料)或光敏剂(如HPPH)通过“后加载”策略负载至壳层。将染料溶解于DMF中形成1 mM储备液,与纳米颗粒分散液避光混合静置过夜,利用壳层疏水微区吸附染料分子。最终稀释定容,制得含5 μM染料的纳米制剂(如NP1D或NP1PS)。
4、关键特性验证与优化
通过动态光散射(DLS)和透射电镜(TEM)验证了纳米颗粒的尺寸可逆变化特性(20°C时250 nm→60°C时140 nm)。荧光寿命与单线态氧磷光检测进一步证实,壳层收缩通过抑制非辐射弛豫途径,同步增强荧光强度与单线态氧产率。优化策略包括调节单体比例、交联剂用量及纯化工艺,以平衡温度敏感性与生物相容性。
5、挑战与改进方向
当前制备工艺需解决批次一致性与规模化生产的难题,例如采用连续流反应器提升反应均一性,或通过切向流过滤(TFF)替代耗时透析。未来可引入动态共价键或靶向修饰(如PEG链),进一步提升纳米颗粒的稳定性和肿瘤靶向能力。
如何实现体内精准温控以激活纳米颗粒的热响应行为,同时避免对正常组织的热损伤?现有激光加热技术的局限性及改进方向是什么?
激光加热技术的当前局限
穿透深度与均匀性:3 μm激光虽处于NIR-II生物窗口,但对深层组织(如实体瘤内部)的加热效率受组织散射和吸收限制,可能导致表面过热而内部响应不足。
缺乏实时反馈:依赖外部测温(如热偶)无法动态调节激光功率,易造成局部温度超过安全阈值(>42°C),引发正常组织损伤。
改进方向与多模态整合策略
闭环温控系统:结合磁共振热成像(MRTI)或光声测温技术,实时监测靶区温度并反馈调节激光参数,将温度精确控制在LCST附近(如39–41°C)。
自适应纳米设计:通过调节共聚物中丙烯酰胺(AA)的比例,将LCST提高至略高于体温(如42–43°C),确保仅在激光照射区域触发响应,减少非靶向激活。
脉冲式能量递送:采用间歇性激光照射,结合纳米颗粒的热弛豫特性,避免热量累积,提升治疗安全性。
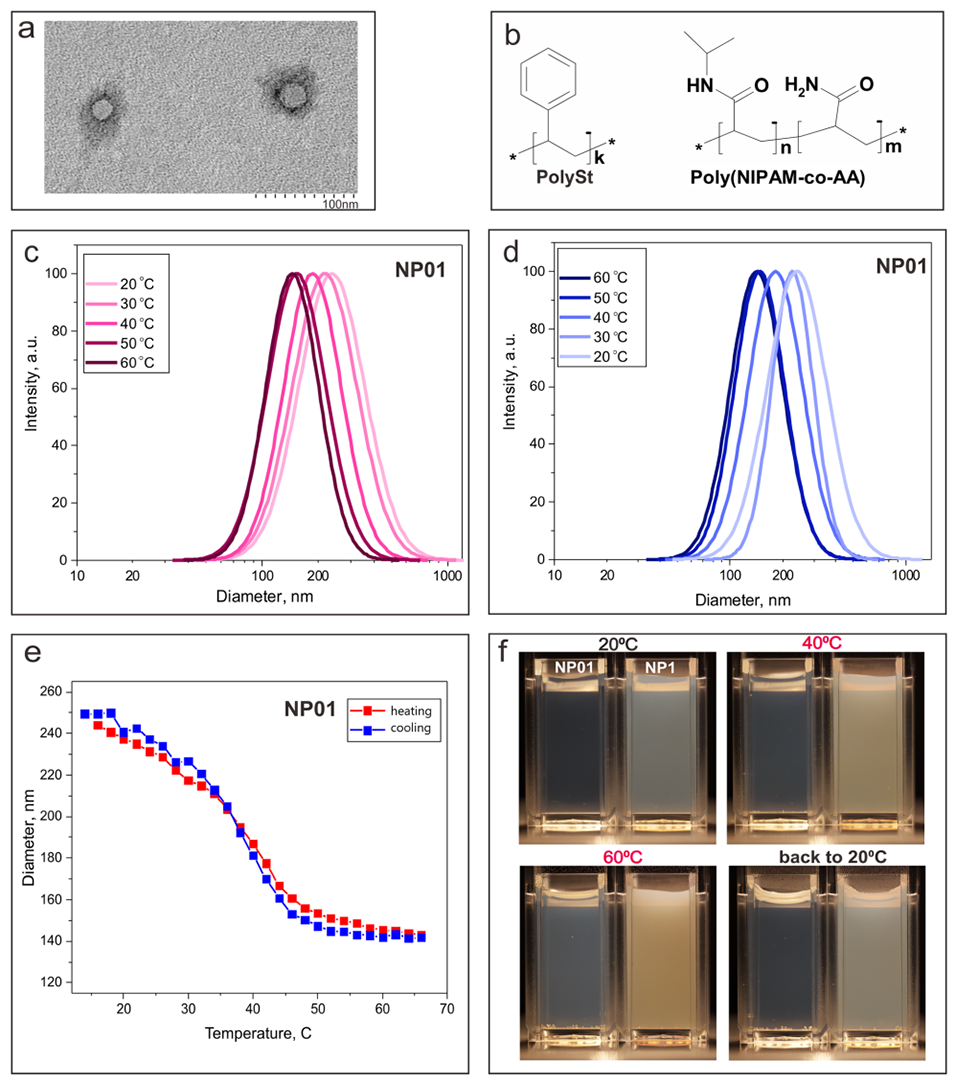
图1.(a):聚苯乙烯-聚(N-异丙基丙烯酰胺-co-丙烯酰胺)核壳纳米颗粒的透射电子显微镜(TEM)图像。(b):组成纳米颗粒的聚合物的化学结构。(c):动态光散射(DLS)结果显示纳米颗粒尺寸分布随纳米颗粒水分散液加热(0.1% w/v)的变化。(d):DLS结果显示纳米颗粒尺寸分布随纳米颗粒水分散液冷却(0.1% w/v)的变化。(e):DLS结果显示纳米颗粒尺寸随纳米颗粒水分散液(0.1% w/v)加热和冷却的变化。(f):纳米颗粒水分散液(浓度分别为0.1% w/v和1% w/v)在20°C下加热至40°C和60°C后,再冷却回20°C的光学照片。
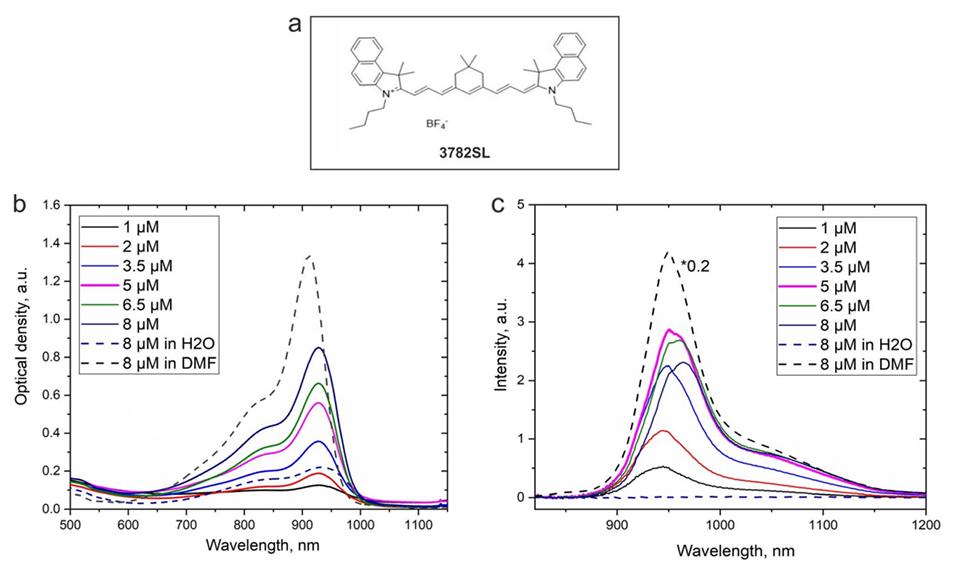
图2.(a):近红外荧光染料3782SL的化学结构。(b):3782SL染料在水、DMF以及纳米颗粒水分散液(NP01D纳米制剂)中的吸收光谱。(c):3782SL染料在水、DMF以及纳米颗粒水分散液(NP01D纳米制剂)中的荧光光谱。
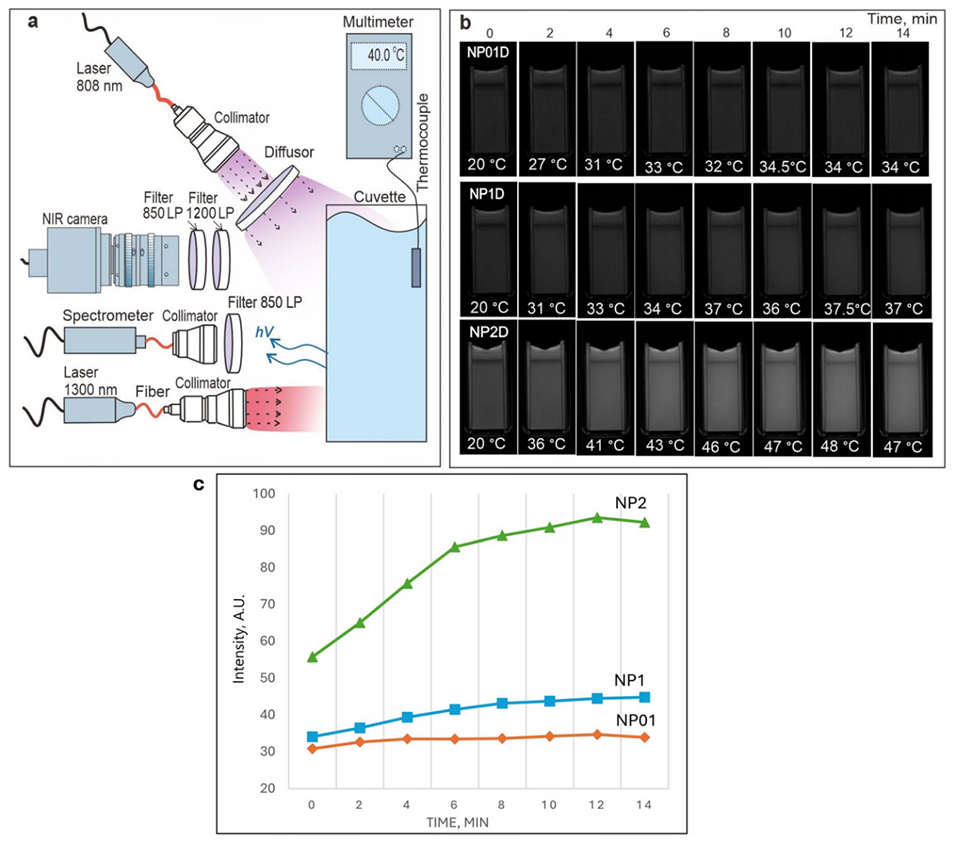
图3.(a):用于评估纳米制剂在1300 nm激光加热下近红外-短波红外(NIR-SWIR)荧光变化的实验装置示意图。(b):在1300 nm激光加热过程中,NP01D、NP1D、NP2D纳米制剂的NIR-SWIR荧光图像。(c):NIR-SWIR荧光强度随加热时间的变化。
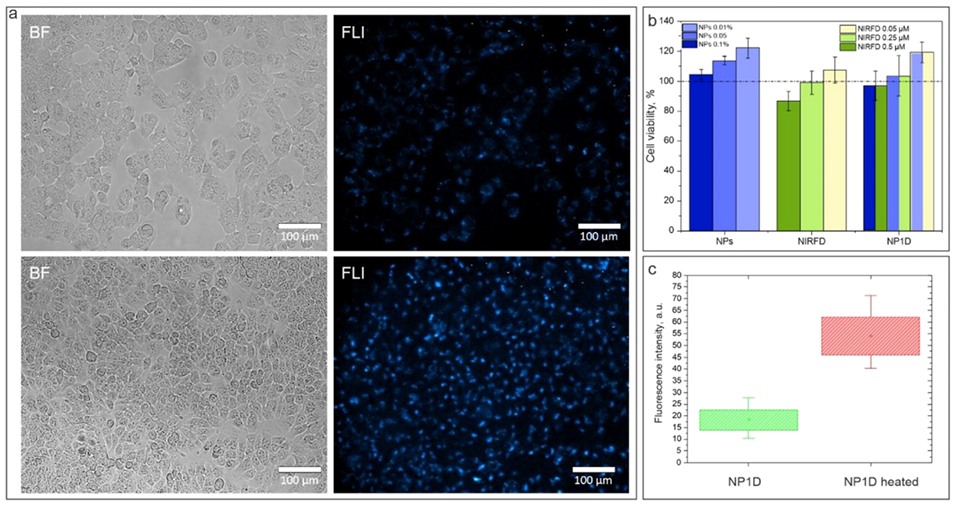
图4.(a):用NP1D处理的LLC细胞的透射(左列)和NIR-SWIR荧光(右列)显微镜图像,加热前(上)和加热后(下)。(b):LLC细胞在经过空白纳米颗粒、游离NIRFD和NP1D处理24小时后的细胞活性。(c):用NP1D处理的细胞在加热前后的荧光信号直方图。

图5.(a):NP01PS和NP1PS纳米制剂在加热前后的荧光光谱。(b):未加热和加热的NP01PS和NP1PS纳米制剂的HPPH荧光衰减曲线。(c):NP01PS和NP1PS纳米制剂在加热前后的HPPH荧光各向异性光谱,游离PS在有机溶液中的荧光各向异性光谱,以及不含HPPH的纳米颗粒分散液的荧光各向异性光谱。(d):在加热和未加热条件下,由NP01PS和NP1PS敏化的单线态氧的磷光衰减曲线对比(在1270 nm处检测)。
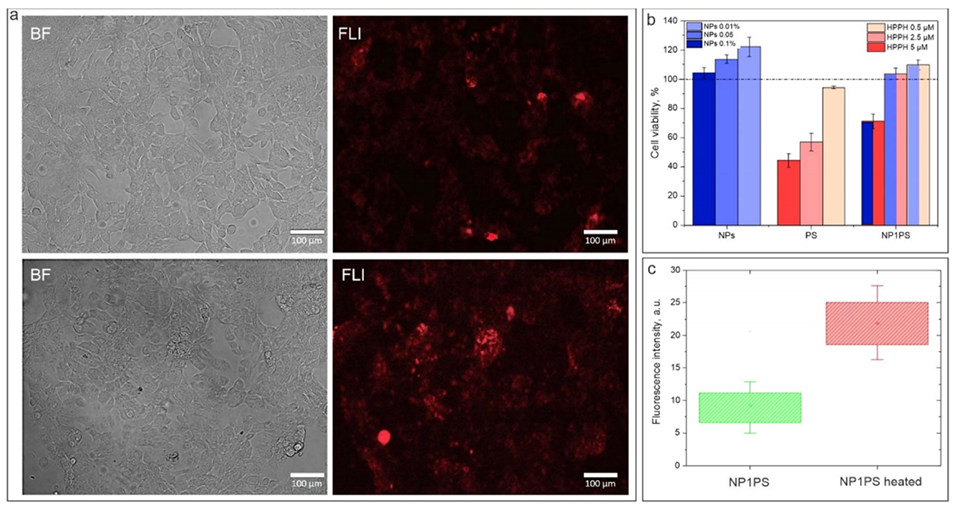
图6.(a):用NP1PS处理的活细胞的透射和荧光显微镜图像,加热前(上)和加热后(下)。(b):经过纳米颗粒、游离HPPH和NP1PS处理24小时后的培养细胞活性。(c):用NP1PS处理的细胞在加热前后的荧光强度直方图。
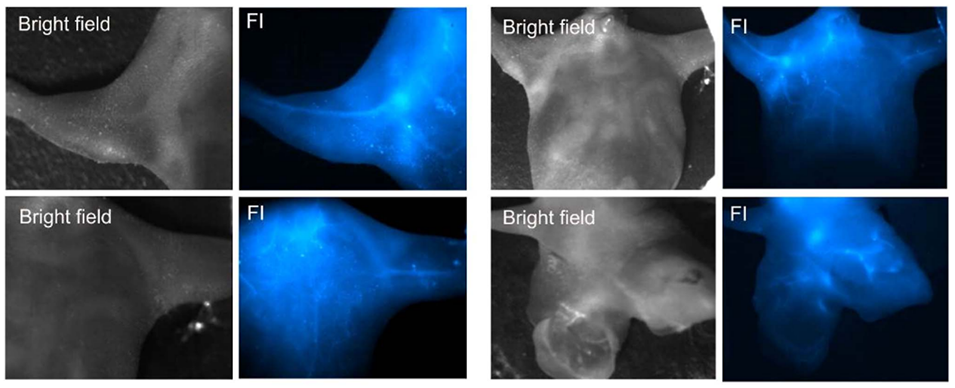
图7.通过尾静脉注射NP1D纳米制剂的小鼠的亮场和NIR-SWIR荧光图像。
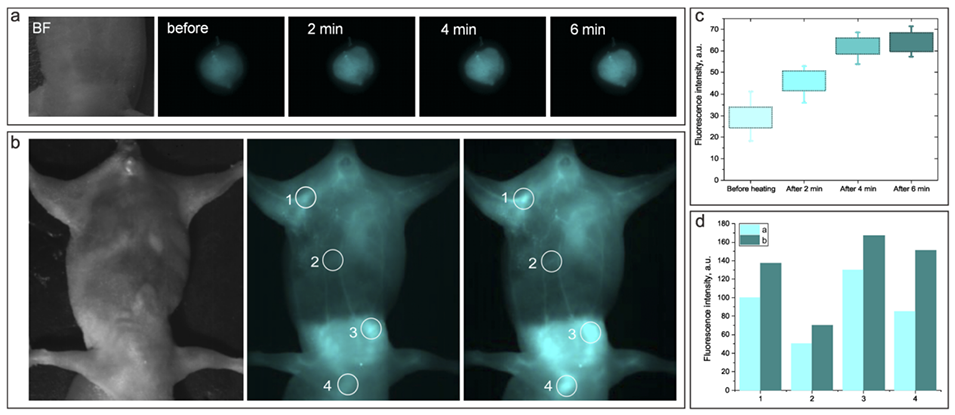
图8.(a)和(b):通过皮下注射(a)和静脉注射(b)NP1D纳米制剂的小鼠模型的亮场和NIR荧光图像,加热前后的对比。(c)和(d):分别表示皮下注射部位(c)和静脉注射后小鼠身体不同部位(d)的NIR-SWIR荧光强度直方图,加热前后的对比。
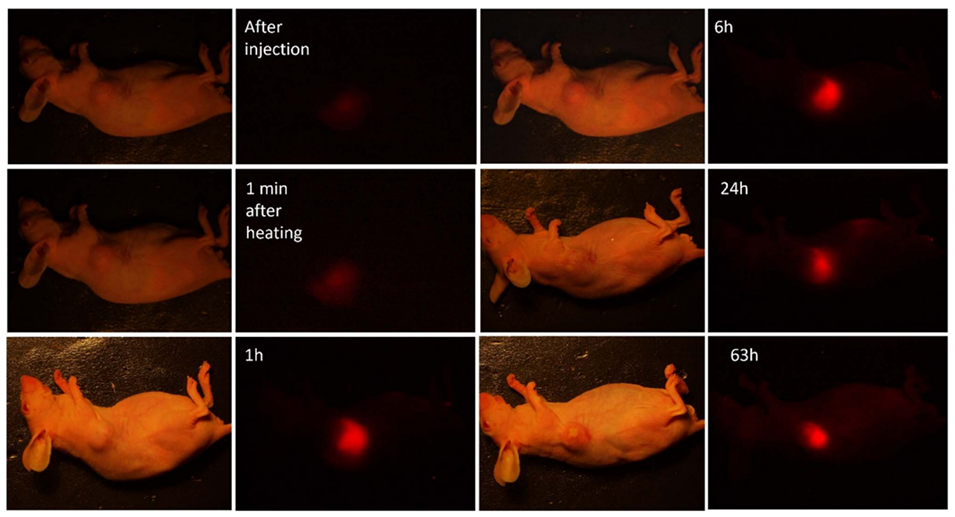
图9.通过瘤内注射NP1PS的小鼠肿瘤模型的亮场和荧光图像,注射后1分钟、5分钟、1小时、6小时、24小时和63小时的成像结果。
论文链接:https://doi.org/10.1039/D4NA00687A














