生物活性陶瓷因其优异的骨诱导、骨传导和骨整合性能,被广泛应用于骨组织修复与再生。然而,由于体内成骨过程复杂、周期长且难以精确追踪,材料与细胞的相互作用机制尚未完全阐明,限制了生物活性陶瓷的进一步发展。传统的细胞实验无法反映体内微环境的复杂性,而动物实验成本高、周期长且难以准确追踪体内过程,亟需更可靠的研究与评估方法。

近期,四川大学张兴栋院士、樊渝江教授、梁洁教授、袁暾研究员等人通过构建陶瓷微桥微流控芯片系统,结合计算仿生模型,模拟免疫微环境下的骨诱导过程,探究了磷酸钙陶瓷对间充质干细胞成骨分化的影响,并验证了其与动物实验结果的一致性,为生物活性材料的研究与评估提供了可行的体外方法。相关研究以“A ceramic microbridge microfluidic chip to study osteogenic differentiation of mesenchymal stem cells in bioactive ceramic immune microenvironment”为题目,发表在期刊《Bioactive Materials》上。
本文要点:
1、本研究利用计算仿真模型模拟了免疫相关因素存在下磷酸钙陶瓷的骨诱导过程,并采用微流控芯片系统研究了在以巨噬细胞为主导的免疫微环境中,磷酸钙陶瓷对间充质干细胞成骨分化的影响。
2、结果表明,上游通道中的巨噬细胞极化和炎症因子、生长因子的分泌诱导了间充质干细胞向上通道的迁移,细胞状态也随之发生变化。
3、当氧含量从20%降至5%时,细胞增殖、迁移和分化相关的基因表达和信号通路被抑制,这使得间充质干细胞难以在低氧环境中增殖、迁移和分化。
4、计算仿生模型和微流控芯片实验结果与动物实验报告基本一致,证实了采用微流控芯片模型研究磷酸钙陶瓷成骨行为的可行性。
5、该研究方法和模型可推广至其他生物材料,为其机理研究和安全性评估提供可行途径。
使用微流控芯片系统研究生物活性陶瓷具有以下优势:
1、模拟体内微环境:微流控芯片能够通过设置参数(如氧浓度、流速等)精确模拟体内复杂的免疫微环境和骨诱导过程,重现材料与细胞的相互作用。
2、高效性和可控性:相比动物实验,微流控芯片实验周期短、成本低,且实验条件可控,便于研究不同变量对细胞行为的影响。
3、多参数研究:芯片系统可以同时研究多种微环境参数(如氧浓度梯度、生长因子浓度分布等)对细胞迁移、增殖和分化的影响,提供全面的研究数据。
4、动态观察:微流控芯片支持实时动态观察细胞行为(如迁移、增殖和分化),提高了实验的可追踪性和数据的准确性。
5、与计算仿生模型结合:通过结合计算仿生模型,微流控芯片能够验证和优化模型预测的微环境参数,进一步提高实验的科学性和可靠性。
6、减少动物实验依赖:微流控芯片提供了一种体外研究方法,减少了对动物实验的依赖,符合伦理要求,同时实验结果与动物实验具有较高的一致性。
7、可推广性:该研究方法和芯片系统不仅适用于生物活性陶瓷,还可推广至其他生物材料的研究与评估,为材料的开发提供新的工具和思路。
本研究主要采用以下方法来评估生物活性陶瓷材料与细胞的相互作用:
1、计算仿生模型:建立基于对流-扩散方程的三维圆柱形孔道模型,模拟了生物活性陶瓷植入后骨诱导过程中间充质干细胞的迁移、增殖和分化。该模型可以预测不同孔径陶瓷材料内部的生长因子浓度梯度和氧浓度梯度。
2、微流控芯片系统:设计了一种带有可拆卸微桥结构的三通道四微桥芯片,在芯片中重现了计算仿生模型预测的微环境参数,如不同深度的氧浓度梯度。通过该芯片系统,研究了生物活性陶瓷在巨噬细胞主导的免疫微环境中对间充质干细胞成骨分化的影响。
3、生物学实验分析:在微流控芯片上,通过细胞迁移观察、ELISA检测、RT-qPCR和RNA测序等手段,分析了不同生物活性陶瓷材料对巨噬细胞极化、炎症因子和生长因子分泌以及间充质干细胞增殖、迁移和分化的影响。
4、结果验证:将微流控芯片系统的实验结果与之前报道的动物实验结果进行对比,发现二者基本一致,验证了该方法的可行性。
综上所述,本研究充分利用了计算仿生模型和微流控芯片系统,系统地研究了生物活性陶瓷在免疫微环境下的成骨行为,为进一步优化这类材料的骨诱导能力提供了重要的理论依据和实验基础。

图1.微流控芯片和微桥支架。(A)可拆卸微流控芯片;(B)实验图;(C)模拟多孔支架示意图;(D)-(F)400μm BCP陶瓷(BCP400);(G)-(I)600μm BCP陶瓷(BCP600);(J)-(L)800μm BCP陶瓷(BCP800);(M)-(O)600μM HA陶瓷(HA600);(P)-(R)600μm TCP陶瓷(TCP4600)。
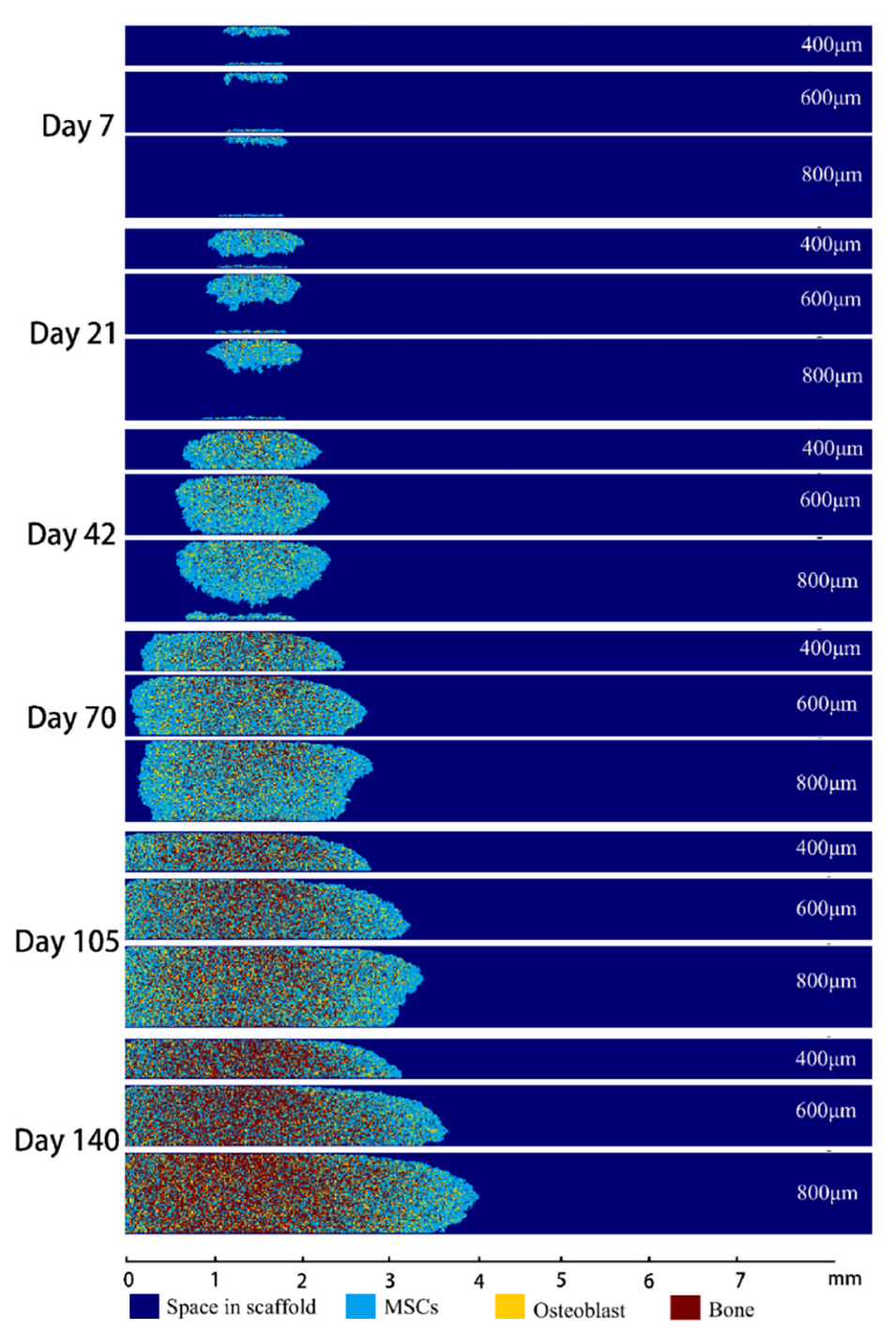
图2.通道骨形成过程中的细胞迁移、增殖和分化。MSCs在7天后开始分化为成骨细胞前体细胞,而成骨前体细胞在接下来的8天内逐渐成熟。然后,活性成骨细胞转化为骨细胞,并嵌入是其体积三倍的有机基质中,该基质在4天内合成和分泌。随后,新形成的有机骨基质与无机钙和磷离子一起发生矿化,导致新骨形成,通常发生在30-60天内。

图3.巨噬细胞-陶瓷微桥-MSCs细胞相互作用的倒置荧光图。比例尺=500μm。

图4.氧含量为5%的BCP600-5组和氧含量为20%的BCP600-MC组(用丝裂霉素C处理的MSCs)的倒置荧光图像。比例尺=500μm。

图5.分析了不同陶瓷材料和氧含量条件下,巨噬细胞分泌的炎性细胞因子和生长因子的变化情况。

图6.分析每个陶瓷微桥微流控芯片中巨噬细胞的极化。

图7.BCP600、HA600和TCP600 GO富集柱状图。
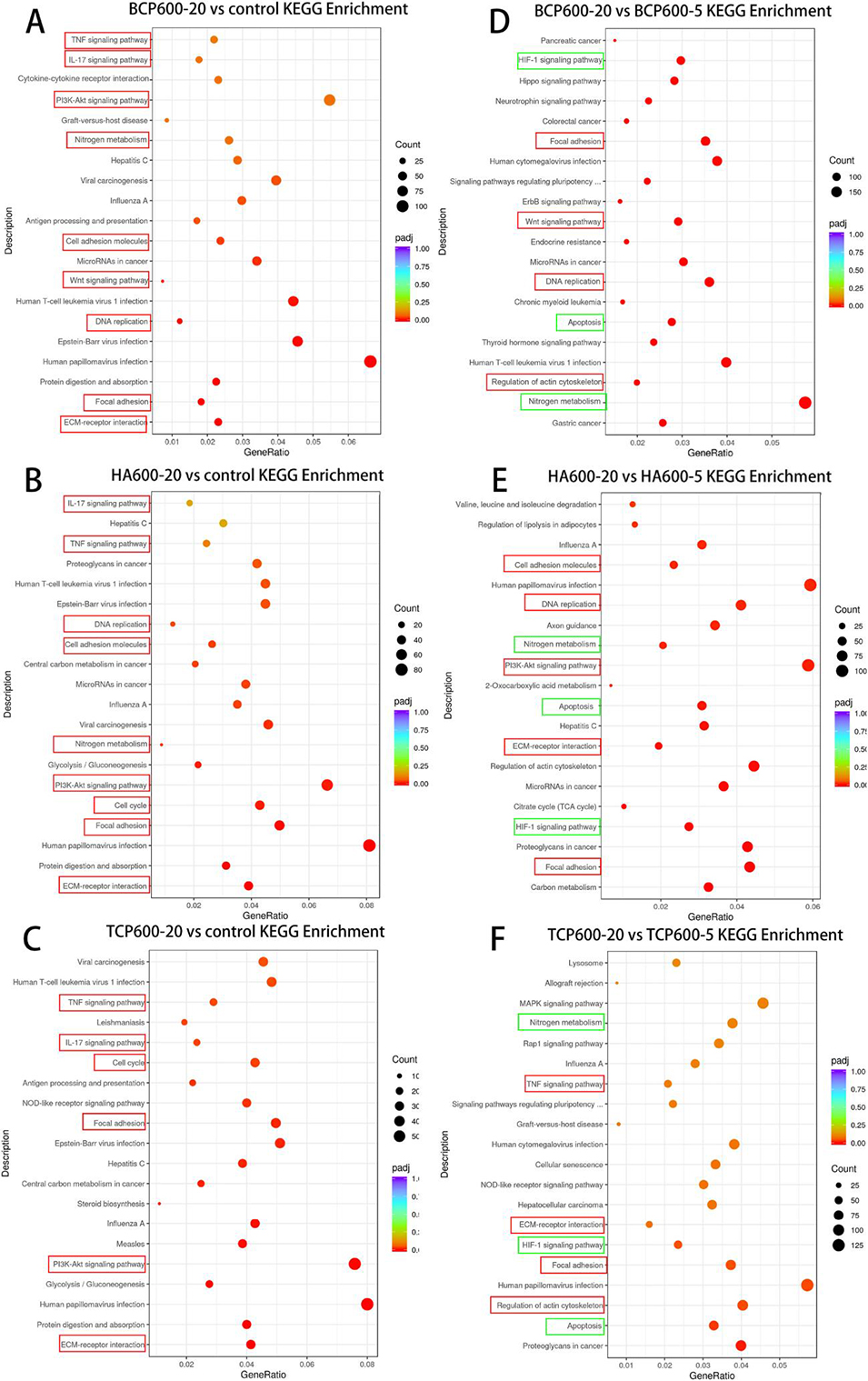
图8.BCP600、HA600和TCP600差异基因KEGG富集分析的气泡图。
论文链接:https://doi.org/10.1016/j.bioactmat.2024.11.005














